지방세포
Adipocyte| 지방세포 | |
|---|---|
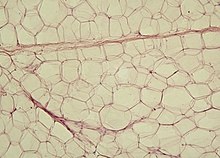
 백색 지방 세포를 묘사하는 일러스트. | |
| 세부 사항 | |
| 식별자 | |
| 라틴어 | 지방 세포 |
| 메쉬 | D017667 |
| TH | H2.00.03.01005 |
| FMA | 63880 |
| 미세해부술의 해부학적 용어 | |
지방세포와 지방세포로도 알려진 지방세포는 주로 지방조직을 구성하는 세포로,[1] 지방으로서 에너지를 저장하는 데 특화되어 있다.지방세포는 지방형성을 통해 지방세포를 생성하는 중간엽 줄기세포에서 유래한다.세포 배양에서 지방세포 전구체는 골아세포, 근구 및 다른 세포 유형을 형성할 수 있다.
지방조직에는 백색지방조직(WAT)과 갈색지방조직(BAT)이라는 두 가지 유형이 있으며, 각각 백색지방과 갈색지방으로 알려져 있으며 두 가지 유형의 지방세포로 구성되어 있다.
구조.
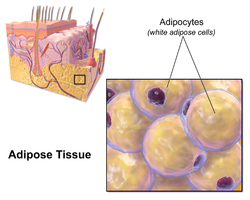
백색 지방 세포
백색 지방 세포는 세포질 층에 둘러싸인 하나의 큰 지질 방울을 포함하고 있으며, 단일 지방 세포로 알려져 있습니다.핵은 평평해지고 주변으로 밀려난다.일반적인 지방 세포는 지름이[2] 0.1mm이고 일부는 그 두 배이고 다른 일부는 그 크기의 절반입니다.그러나 이러한 지방 세포 크기의 수치 추정치는 측정 방법과 지방 [2]조직의 위치에 따라 크게 달라진다.저장된 지방은 반액 상태이며, 주로 트리글리세리드 및 콜레스테릴 에스테르로 구성되어 있습니다.백색 지방 세포는 레지스틴, 아디포넥틴, 렙틴, 아펠린과 같은 아디포킨으로 작용하는 많은 단백질을 분비합니다.평균적인 인간 성인은 30파운드 혹은 13.5킬로그램의 무게의 300억 개의 지방 세포를 가지고 있다.만약 어린이나 청소년이 충분히 과체중이 되면,[3] 지방세포는 24세까지 절대 수가 증가할 수 있다.만약 성인(어린이나 청소년 시절 비만이 아니었던)이 과체중이 되면, 지방세포의 크기가 증가하지만 절대적인 수는 증가하지 않는다. 비록 현존하는 지방세포가 [3]충분히 커지면 지방세포의 수가 증가할 수 있다는 결정적인 증거가 있다.비록 몇몇 증거가 체중 감소 시간이 충분히 긴 기간(>1년 동안 유지되어 져 와가 지방 세포의 수가 있으나, 꽤 힘들다는 것을 더 많은 더 큰 지방 세포를 가진 사람들 체중 감량의 'caput'을 유지하기 위해 감소할 수 있는 것으로 지방 세포의 절대 숫자 식이 개입을 통해를 줄이기에 어렵또는그렇게 오랫동안)[3]
대규모 메타 분석에서 백색 지방 조직 세포 크기는 측정 방법, 지방 조직 퇴적물, 연령 및 체질량 지수에 따라 달라지는 것으로 나타났다. 같은 정도의 비만에 대해 지방 세포 크기의 증가는 포도당과 지질 대사의 [2]조절 장애와도 관련이 있었다.
갈색지방세포
갈색 지방 세포는 모양이 다면체이다.갈색 지방은 피부 세포에서 유래한다.백색 지방 세포와 달리, 이 세포들은 상당한 세포질을 가지고 있고, 여러 개의 지질 방울이 곳곳에 흩어져 있고, 다원 세포로 알려져 있습니다.핵은 둥글고, 편심하지만 세포 주변에 있지 않습니다.갈색은 많은 양의 미토콘드리아에서 나온다."아기 지방"으로도 알려진 갈색 지방은 열을 발생시키는데 사용된다.
골수지방세포
골수지방세포는 백색지방세포와 같은 단원형이다.골수 지방 조직 디포는 생리적 기능과 뼈 건강과의 관련성 측면에서 잘 알려져 있지 않다.골수지방조직은 골밀도가 낮은 상태에서 확장되지만 비만의 [4]환경에서는 추가로 확장된다.운동에 대한 골수 지방 조직 반응은 백색 지방 조직의 [4][5][6][7]반응과 유사하다.운동은 지질결합제 오스뮴으로 얼룩진 뼈의 MRI 또는 μCT 영상으로 정량화된 바와 같이 지방세포 크기와 골수 지방조직량을 감소시킨다.운동은 백색지방에서 갈색지방으로의 전환분화 촉진(브라우징 현상)
발전
전지방세포는 지방세포를 형성하기 위해 자극될 수 있는 미분화 섬유아세포이다.연구들은 지방세포의 정확한 혈통은 [8][9]아직 불분명하지만, 전지방세포의 운명 결정에서 잠재적 분자 메커니즘을 밝혀냈다.정상적인 성장으로 인한 체지방 분포의 변화는 각 지방 [10]저장소에서 발견되는 세포의 본질적인 차이에 의존하는 영양 및 호르몬 상태에 의해 영향을 받는다.
중간엽 줄기세포는 지방세포, 결합조직, 근육 또는 [1]뼈로 분화할 수 있다.
성체 세포의 전구체는 지방아세포라고 불리며, 이 세포 유형의 종양은 지방아세포종이라고 [11]알려져 있다.
기능.
세포 교체
일부 생쥐의 지방 세포는 단식으로 인해 수가 감소하는 것으로 나타났으며 [12]추위에 노출되면 다른 특성이 관찰되었다.
체내 지방세포가 최대 지방 용량에 도달하면 추가 지방 저장을 허용하기 위해 복제할 수 있습니다.
다양한 종류의 성인 쥐들은 몇 달 동안 매우 입맛이 좋은 음식을 먹었을 때 비만이 되었다.그들의 지방 조직 형태 분석 결과 대부분의 디포에서 지방 세포의 크기와 수 모두 증가하였다.이러한 동물들에게 일반적인 식사[13] 식단을 다시 도입하면 체중 감소 기간이 단축되고 평균 지방세포 크기만 정상으로 돌아왔다.지방세포 수치는 체중 [14]증가 기간 동안 달성된 상승 수준을 유지했다.
일부 보고서와 교과서에 따르면, 비록 그 양이 보통 성인의 경우 일정하지만, 지방세포의 수는 어린 시절과 청소년기에 증가할 수 있다.청소년이 아니라 성인이 되어 비만이 된 개인은 [15]예전보다 더 많은 지방세포를 가지고 있지 않다.
어린 시절부터 뚱뚱했던 사람들은 일반적으로 지방세포의 수가 부풀어 오른다.성인이 되어 뚱뚱해진 사람들은 마른 또래들보다 지방세포가 더 많지 않을 수도 있지만, 그들의 지방세포는 더 크다.일반적으로 지방세포가 과잉인 사람들은 단순히 비대해진 지방세포를 [3]가진 비만인 사람들보다 살을 빼고 빼는 것이 더 어렵다는 것을 발견한다.
체지방 세포는 성인 피실험자들에게 연구된 과잉섭취에 국소적인 반응을 보인다.상체에서는 지방세포의 크기가 상체지방 증가와 상관관계가 있으나 지방세포 수는 크게 변화하지 않았다.상체지방세포의 반응과는 대조적으로, 하체지방세포의 수는 실험 과정에서 유의하게 증가했다.특히 하체지방세포의 [16]크기에는 변화가 없었다.
지방세포의 약 10%는 [15]성인기에 지방세포의 전체 수가 크게 증가하지 않고 모든 성인 연령과 체질량 지수 수준에서 매년 갱신된다.
적응.
비만은 지방세포 크기 증가(비대증)를 통한 지방질량의 확대로 특징지어지며, 더 적은 범위로 세포 증식(비대증)[17][2]을 통해 특징지어진다.비만인 사람의 지방조직에서는 글리세롤, 호르몬, 대식세포자극성 케모카인, 소염성 사이토카인 등의 대사조절제 생산이 증가하여 인슐린 [18]저항성이 발달한다.이러한 조절제의 생산과 그에 따른 인슐린 저항성의 병인은 아마도 조직에 [19]침투하는 면역계 대식세포뿐만 아니라 지방세포에 의해 야기될 것이다.
지방세포의 지방생산은 인슐린에 의해 강하게 촉진된다.인슐린은 피루브산탈수소효소 및 아세틸-CoA 카르복실화효소 활성을 제어함으로써 불포화지방산 합성을 촉진한다.그것은 또한 포도당 흡수를 촉진하고 지방 [20]형성을 자극하는 유전자의 전사를 활성화하는 SREBF1을 유도한다.
SREBF1(스테롤조절요소결합전사인자1)은 2개의 막경간나선에 의해 내소체막(ER)에 삽입되는 불활성 전구단백질로서 합성되는 전사인자이다.또한 ER막에는 SREBF1과 결합하는 SCAP(SREBF-cleavage 활성화 단백질)가 고정된다.SREBF1-SCAP 복합체는 INSIG1(인슐린 유도 유전자 1 단백질)에 의해 ER막 내에 유지된다.스테롤 수치가 고갈되면 INSIG1은 SCAP를 방출하고 SREBF1-SCAP 복합체는 코토머 COPII에 의해 코팅된 수송 소포로 분류되어 골지 기기로 수출될 수 있다.본 발명의 골지장치에서는 SREBF1이 분해되어 전사활성성숙단백질로서 방출된다.그리고 나서 그것은 핵으로 자유롭게 이동하고 표적 [21]유전자의 발현을 활성화한다.
임상 연구는 인슐린 저항성이 보통 비만과 관련이 있음에도 불구하고 비만 환자의 지방세포의 막 인지질들은 일반적으로 지방산 [22]불포화 정도가 증가함을 보여준다.이것은 비만과 인슐린 저항성과 관련된 저장 수요 증가에도 불구하고 지방세포가 기능을 유지할 수 있도록 하는 적응 메커니즘을 가리키는 것으로 보인다.
2013년 실시된[22] 연구에 따르면 비만 생쥐와 사람의 지방조직에서 INSIG1과 SREBF1 mRNA 발현이 감소했지만 활성 SREBF1의 양은 정상 생쥐와 비-비만 환자에 비해 증가했다.성숙한 SREBF1의 증가와 결합된 INSIG1 발현의 하향 조절은 SREBF1-타겟 유전자 발현 유지와도 관련이 있었다.따라서 INSIG1을 다운 레귤레이션함으로써 INSIG1/SREBF1 루프가 리셋되어 액티브한 SREBF1 레벨을 유지할 수 있는 것으로 보입니다.이것은 인슐린 저항성의 항지질 유발 효과를 보상하고, 따라서 비만의 영양 압력에 직면하여 지방세포 지방 저장 능력과 적절한 수준의 불포화 지방산의 가용성을 유지하는 데 도움을 주는 것으로 보인다.
내분비역할
지방세포는 안드로겐으로부터 [23]에스트로겐을 합성할 수 있으며, 저체중 또는 과체중이 [24]불임의 위험인자가 될 수 있다.또한 지방세포는 렙틴 호르몬 생성을 담당한다.렙틴은 식욕 조절에 중요하며 포만감 [25]요인으로 작용한다.
「 」를 참조해 주세요.
레퍼런스
- ^ a b Birbrair A, Zhang T, Wang ZM, Messi ML, Enikolopov GN, Mintz A, Delbono O (August 2013). "Role of pericytes in skeletal muscle regeneration and fat accumulation". Stem Cells and Development. 22 (16): 2298–2314. doi:10.1089/scd.2012.0647. PMC 3730538. PMID 23517218.
- ^ a b c d Ye RZ, Richard G, Gévry N, Tchernof A, Carpentier AC (January 2022). "Fat Cell Size: Measurement Methods, Pathophysiological Origins, and Relationships With Metabolic Dysregulations". Endocrine Reviews. 43 (1): 35–60. doi:10.1210/endrev/bnab018. PMC 8755996. PMID 34100954.
- ^ a b c d Pool R (2001). Fat: fighting the obesity epidemic. Oxford [Oxfordshire]: Oxford University Press. pp. 68. ISBN 978-0-19-511853-7.
- ^ a b Styner M, Pagnotti GM, McGrath C, Wu X, Sen B, Uzer G, et al. (August 2017). "Exercise Decreases Marrow Adipose Tissue Through ß-Oxidation in Obese Running Mice". Journal of Bone and Mineral Research. 32 (8): 1692–1702. doi:10.1002/jbmr.3159. PMC 5550355. PMID 28436105.
- ^ Pagnotti GM, Styner M (2016). "Exercise Regulation of Marrow Adipose Tissue". Frontiers in Endocrinology. 7: 94. doi:10.3389/fendo.2016.00094. PMC 4943947. PMID 27471493.
- ^ Styner M, Pagnotti GM, Galior K, Wu X, Thompson WR, Uzer G, et al. (August 2015). "Exercise Regulation of Marrow Fat in the Setting of PPARγ Agonist Treatment in Female C57BL/6 Mice". Endocrinology. 156 (8): 2753–2761. doi:10.1210/en.2015-1213. PMC 4511140. PMID 26052898.
- ^ Styner M, Thompson WR, Galior K, Uzer G, Wu X, Kadari S, et al. (July 2014). "Bone marrow fat accumulation accelerated by high fat diet is suppressed by exercise". Bone. 64: 39–46. doi:10.1016/j.bone.2014.03.044. PMC 4041821. PMID 24709686.
- ^ Coskun H, Summerfield TL, Kniss DA, Friedman A (July 2010). "Mathematical modeling of preadipocyte fate determination". Journal of Theoretical Biology. 265 (1): 87–94. Bibcode:2010JThBi.265...87C. doi:10.1016/j.jtbi.2010.03.047. PMID 20385145.
- 요약 배치 위치:
- ^ Coskun H, Summerfield TL, Kniss DA, Friedman A (July 2010). "Mathematical modeling of preadipocyte fate determination". Journal of Theoretical Biology. 265 (1): 87–94. Bibcode:2010JThBi.265...87C. doi:10.1016/j.jtbi.2010.03.047. PMID 20385145.
- ^ Fried SK, Lee MJ, Karastergiou K (July 2015). "Shaping fat distribution: New insights into the molecular determinants of depot- and sex-dependent adipose biology". Obesity (Review). 23 (7): 1345–1352. doi:10.1002/oby.21133. PMC 4687449. PMID 26054752.
- ^ Hong R, Choi DY, Do NY, Lim SC (July 2008). "Fine-needle aspiration cytology of a lipoblastoma: a case report". Diagnostic Cytopathology. 36 (7): 508–511. doi:10.1002/dc.20826. PMID 18528880. S2CID 22668394.
- ^ Ding H, Zheng S, Garcia-Ruiz D, Hou D, Wei Z, Liao Z, et al. (May 2016). "Fasting induces a subcutaneous-to-visceral fat switch mediated by microRNA-149-3p and suppression of PRDM16". Nature Communications. 7: 11533. Bibcode:2016NatCo...711533D. doi:10.1038/ncomms11533. PMC 4895052. PMID 27240637.
- ^ Warden CH, Fisler JS (April 2008). "Comparisons of diets used in animal models of high-fat feeding". Cell Metabolism. 7 (4): 277. doi:10.1016/j.cmet.2008.03.014. PMC 2394560. PMID 18396128.
Regular chow is composed of agricultural byproducts, such as ground wheat, corn, or oats, alfalfa and soybean meals, a protein source such as fish, and vegetable oil and is supplemented with minerals and vitamins. Thus, chow is a high fiber diet containing complex carbohydrates, with fats from a variety of vegetable sources. Chow is inexpensive to manufacture and is palatable to rodents.
- ^ Faust IM, Johnson PR, Stern JS, Hirsch J (September 1978). "Diet-induced adipocyte number increase in adult rats: a new model of obesity". The American Journal of Physiology. 235 (3): E279–E286. doi:10.1152/ajpendo.1978.235.3.E279. PMID 696822.
- ^ a b Spalding KL, Arner E, Westermark PO, Bernard S, Buchholz BA, Bergmann O, et al. (June 2008). "Dynamics of fat cell turnover in humans". Nature. 453 (7196): 783–787. Bibcode:2008Natur.453..783S. doi:10.1038/nature06902. PMID 18454136. S2CID 4431237.
- ^ Tchoukalova YD, Votruba SB, Tchkonia T, Giorgadze N, Kirkland JL, Jensen MD (October 2010). "Regional differences in cellular mechanisms of adipose tissue gain with overfeeding". Proceedings of the National Academy of Sciences of the United States of America. 107 (42): 18226–18231. doi:10.1073/pnas.1005259107. PMC 2964201. PMID 20921416.
- ^ Blüher M (June 2009). "Adipose tissue dysfunction in obesity". Experimental and Clinical Endocrinology & Diabetes. 117 (6): 241–250. doi:10.1055/s-0029-1192044. PMID 19358089.
- ^ Kahn SE, Hull RL, Utzschneider KM (December 2006). "Mechanisms linking obesity to insulin resistance and type 2 diabetes". Nature. 444 (7121): 840–846. Bibcode:2006Natur.444..840K. doi:10.1038/nature05482. PMID 17167471. S2CID 120626.
- ^ Bastard JP, Maachi M, Lagathu C, Kim MJ, Caron M, Vidal H, et al. (March 2006). "Recent advances in the relationship between obesity, inflammation, and insulin resistance". European Cytokine Network. 17 (1): 4–12. PMID 16613757.
Several factors derived not only from adipocytes but also from infiltrated macrophages probably contribute to the pathogenesis of insulin resistance.
- ^ Kahn BB, Flier JS (August 2000). "Obesity and insulin resistance". The Journal of Clinical Investigation. 106 (4): 473–481. doi:10.1172/JCI10842. PMC 380258. PMID 10953022.
- ^ Rawson RB (August 2003). "The SREBP pathway--insights from Insigs and insects". Nature Reviews. Molecular Cell Biology. 4 (8): 631–640. doi:10.1038/nrm1174. PMID 12923525. S2CID 20818196.
- ^ a b Carobbio S, Hagen RM, Lelliott CJ, Slawik M, Medina-Gomez G, Tan CY, et al. (November 2013). "Adaptive changes of the Insig1/SREBP1/SCD1 set point help adipose tissue to cope with increased storage demands of obesity". Diabetes. 62 (11): 3697–3708. doi:10.2337/db12-1748. PMC 3806615. PMID 23919961.
- ^ Nelson LR, Bulun SE (September 2001). "Estrogen production and action". Journal of the American Academy of Dermatology. 45 (3 Suppl): S116–S124. doi:10.1067/mjd.2001.117432. PMID 11511861.
- ^ "FERTILITY FACT: Female Risks". American Society for Reproductive Medicine (ASRM). Archived from the original on 22 September 2007.
- ^ Klok MD, Jakobsdottir S, Drent ML (January 2007). "The role of leptin and ghrelin in the regulation of food intake and body weight in humans: a review". Obesity Reviews. 8 (1): 21–34. doi:10.1111/j.1467-789X.2006.00270.x. PMID 17212793. S2CID 24266123.
외부 링크
- 조직학 이미지: 08201loa – 보스턴 대학의 조직학 학습 시스템 – "결합 조직: 단안구(흰색) 지방 세포"
- 조직 이미지: 04901lob – 보스턴 대학의 조직학 학습 시스템 – "결합 조직: 다원(갈색) 지방 세포"