골아세포
Osteoclast| 골아세포 | |
|---|---|
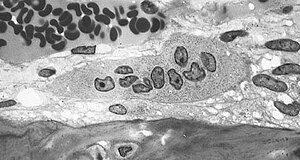 | |
 단일 골세포를 보여주는 그림 | |
| 세부 사항 | |
| 전구체 | 골세포 전구체 |
| 위치 | 뼈. |
| 기능. | 골조직의 파괴 |
| 식별자 | |
| 라틴어 | 골아세포 |
| 메쉬 | D010010 |
| TH | H2.00.03.7.00005 |
| FMA | 66781 |
| 미세해부술의 해부학적 용어 | |
골세포는 골조직을 분해하는 골세포의 일종이다.이 기능은 척추골격의 뼈의 유지, 수리 및 리모델링에 매우 중요합니다.골아세포는 산과 콜라게나아제를 분비함으로써 분자 수준에서 수화 단백질과 미네랄의 혼합물을 분해하고 소화하는데, 이는 뼈 재흡수라고 알려진 과정이다.이 과정은 또한 혈중 칼슘 수치를 조절하는데 도움을 준다.
골아세포는 흡착이 진행 중인 뼈 표면에서 발견됩니다.이러한 표면에서 골세포는 흡착 베이(Howship's lacunae)라고 하는 얕은 함몰부에 있는 것으로 보입니다.흡착 베이는 기초 뼈에 있는 골세포의 부식 작용에 의해 생성됩니다.골세포의 아래쪽 테두리는 세포막의 깊은 굴곡으로 인해 손가락과 같은 과정을 보입니다. 이 테두리를 주름진 테두리라고 합니다.주름진 테두리는 흡착 베이의 골격 표면과 접촉합니다.주름진 테두리의 주변은 세포소기관에는 없지만 액틴 필라멘트가 풍부한 고리 모양의 세포질 구역으로 둘러싸여 있습니다.이 구역을 클리어 존 또는 씰링 존이라고 합니다.액틴 필라멘트는 밀봉 구역을 둘러싼 세포막을 하우십 열골의 뼈 벽에 단단히 고정할 수 있게 합니다.이와 같이 주름진 테두리와 흡착 중인 뼈 사이에 닫힌 골격하 구획이 생성됩니다.골세포는 수소 이온, 콜라겐 효소, 카테프신 K 및 가수 분해 효소를 이 구획으로 분비합니다.골세포에 의한 골매트릭스의 재흡수는 (1) 무기성분(광물)의 용해와 (2) 골매트릭스의 유기성분의 소화 두 가지 단계를 포함한다.골아세포는 수소 이온을 아골쇄성 구획에 주입하여 산성 미세 환경을 조성하고, 이는 골광물의 용해성을 증가시켜 골광물의 방출과 재진입을 유발하여 가까운 모세혈관에 전달된다.미네랄 제거 후 콜라게나아제 및 젤라틴화효소가 아골격체 내에 분비된다.이 효소들은 콜라겐과 탈석화된 뼈 매트릭스의 다른 유기 성분들을 소화시키고 분해한다.분해 생성물은 주름진 테두리의 골세포에 의해 식세포된다.그들의 식세포 특성 때문에, 골세포는 단핵 식세포 시스템(MPs)의 구성요소로 간주된다.골세포의 활동은 호르몬과 사이토카인에 의해 조절된다.갑상선의 호르몬인 칼시토닌은 골쇄성 활동을 억제한다.골아세포는 부갑상선호르몬(PTH) 수용체를 가지고 있지 않다.하지만, PTH는 골아세포를 자극하여 골아세포 자극 인자라고 불리는 골아세포 자극 인자를 분비하는데, 이것은 골아세포 [1]활동의 강력한 자극제이다.
오돈토클라스트(/odon·to·clast/; o-don·to-klast)는 낙엽성 [2][3][4]치아의 뿌리 흡수와 관련된 골세포이다.
구조.
골세포는 큰 다핵세포이며 뼈에 있는 인간 골세포는 전형적으로 5개의 핵을 가지고 있으며 지름은 150–200 µm이다.대식세포를 골세포로 변환하기 위해 골세포를 유도하는 사이토카인을 사용하면 직경 100µm에 이르는 매우 큰 세포가 발생한다.이것들은 수십 개의 핵을 가지고 있을 수 있고, 전형적으로 주요 골세포 단백질을 발현하지만, 자연스럽지 않은 [5][6]기질 때문에 살아있는 뼈의 세포와 큰 차이를 가지고 있다.다핵조립골세포의 크기는 많은 대식세포의 이온수송, 단백질 분비 및 소포수송 능력을 뼈의 국소적인 영역에 집중시킬 수 있게 합니다.
위치
뼈에서 골세포는 뼈 표면의 구덩이에서 발견되는데, 이를 흡착 베이 또는 하우십 열상이라고 합니다.골아세포는 균질하고 "포말 같은" 외관을 가진 세포질로 특징지어진다.이러한 현상은 소포와 액포의 농도가 높기 때문입니다.이 액포들은 산성 포스파타아제로 채워진 리소좀을 포함한다.이를 통해 타르트산 내성산 포스파타아제(TRAP) 및 카테프신 K의 높은 발현을 위해 염색함으로써 골세포의 특성을 파악할 수 있습니다.골세포의 거친 소포체는 희박하고 골지 복합체는 [7][8][9]광범위하다.
골흡수가 활발한 부위에서 골세포는 골조직의 표면에 대항하는 특수한 세포막인 "주름 테두리"를 형성한다.이 광범위하게 접히거나 주름진 테두리는 세포 표면을 극적으로 증가시켜 흡수 구획의 내용물을 흡수함으로써 뼈 제거를 용이하게 하며, 뼈를 활발하게 흡수하는 골세포의 형태학적 특성이다.
발전
1873년 그들이 발견된 이후 그들의 기원에 대해 상당한 논란이 있어왔다.1949년부터 1970년까지 세 가지 이론이 지배적이었다. 결합조직 기원은 골아세포와 골아세포가 같은 혈통이고 골아세포가 서로 융합하여 골아세포를 형성한다는 것이다.수년간의 논란 끝에 이 세포들이 대식세포의 [10]자기 융합으로부터 발전한다는 것이 이제 명백해졌다.단구 식세포계가 골세포의 [11]전구체로 인식된 것은 1980년 초였다.골아세포 형성을 위해서는 RANKL(핵인자 β 리간드의 수용체 활성화제)과 M-CSF(대식세포 콜로니 자극인자)가 필요하다.이러한 막결합 단백질은 인접한 간질 세포와 골아세포에 의해 생성되므로 이러한 세포와 골아세포 전구체 사이의 직접적인 접촉이 필요하다.
M-CSF는 그 수용체를 통해 트랜스막 티로신 키나제 수용체인 골아세포 c-fms(콜론 자극 인자 1 수용체)에 작용하여 티로신 키나제 Src의 2차 메신저 활성화를 유도한다.이들 분자는 모두 골세포 형성에 필요하며 단구/대식세포 유도세포 분화에 광범위하게 관여한다.
RANKL은 종양괴사 패밀리(TNF)의 일원으로 골세포 형성에 필수적입니다.RANKL 녹아웃 마우스는 골아세포의 부재 또는 결핍과 함께 치아의 발진 및 발진의 표현형을 나타낸다.RANKL은 RANK를 통해 NF-δβ(핵인자-δβ) 및 NFATc1(활성화된 t세포의 핵인자, 세포질, 칼시뉴린 의존성 1)을 활성화하며, NF-δβ 활성화는 RANKL-RANK 상호작용 발생 직후에 자극되어 업 조절되지 않는다.그러나 NFATC1 자극은 결합 발생 후 최대 24~48시간 후에 시작되며, 그 발현은 RANKL에 의존하는 것으로 나타났다.
골아세포 분화는 골아세포에 의해 생성되고 RANKL에 결합되어 RANK와의 상호작용을 방지하는 골단백질(OPG)에 의해 억제된다.골아세포는 조혈 계통에서 유래하는 반면 골아세포는 간엽 줄기세포에서 [12][13]유래한다는 것을 알아두는 것이 중요하다.
기능.
활성화되면 골세포는 화학작용을 통해 뼈의 미세골절 영역으로 이동합니다.골아세포는 하워프 라쿠나라고 불리는 작은 구멍에 있는데, 이는 밑부분 뼈의 소화로 형성된다.봉합 구역은 골세포의 혈장막을 밑 뼈에 부착하는 것입니다.밀폐 구역은 포도솜이라고 불리는 특수 접착 구조의 벨트로 둘러싸여 있습니다.골매트릭스 단백질의 특정 아미노산 모티브 Arg-Gly-Asp를 통해 αvβ3 등의 인테그린 수용체에 의해 골매트릭스로의 부착이 촉진된다.골세포는 탄소 무수분해효소(HO2 + CO2 → HCO3− + H+)의 작용을 통해 수소 이온을 방출하고, 광화된 뼈 기질을 산성화하여 Ca, HPO34, HCO23, 물 및 기타 물질로 분해한다2+.탄소성 무수효소의 기능 장애는 어떤 형태의 골편화를 일으키는 것으로 입증되었다.수소 이온은 양성자 펌프, 특히 독특한 액포-ATPase에 의해 고농도 구배에 대해 펌핑된다.이 효소는 골다공증 예방을 목표로 하고 있다.또한 카테프신 및 매트릭스메탈로프로테아제(MMP) 그룹의 멤버와 같은 몇 가지 가수분해효소가 매트릭스의 유기성분을 소화하기 위해 방출된다.이 효소들은 리소좀에 의해 구획으로 방출된다.이러한 가수분해 효소 중 카테프신 K가 가장 중요하다.
카테프신 K 및 기타 카테프신
카테프신K는 주로 골아세포에서 발현되는 콜라겐 분해성 파파인 유사 시스테인 단백질 분해효소로서 흡수성 피트 내에 분비된다.카테프신 K는 I형 콜라겐과 다른 비콜라겐 단백질의 분해에 관여하는 주요 단백질 분해효소이다.카테프신 K 유전자의 돌연변이는 기능성 카테프신 K 발현 결여를 특징으로 하는 유전성 골감영증인 피크노디소스토시스(pycnodysostosis)와 관련이 있다.생쥐에서 카테프신 K에 대한 녹아웃 연구는 골편광 표현형으로 이어지며, 이는 카테프신 K 이외의 단백질 분해효소 발현 증가와 골아세포 형성을 강화함으로써 부분적으로 보상된다.
카테프신 K는 산성 조건에서 최적의 효소 활성을 가진다.이는 분자량 37kDa의 프로엔자임으로 합성되며, 자기촉매개열로 활성화되면 분자량 ~27kDa의 성숙한 활성 형태로 변환된다.
골세포가 흡착 부위에 편극되면 카테프신 K가 주름진 경계에서 흡착구 안으로 분비된다.카테프신 K는 세포간 소포를 통해 주름진 경계를 가로질러 변이된 후 기능성 분비 영역에 의해 방출된다.이러한 세포간 소포 내에서 카테프신 K는 TRAP에 의해 생성된 활성산소와 함께 뼈 세포외 매트릭스를 더욱 분해한다.
카테프신 B, C, D, E, G 및 L을 포함한 여러 다른 카테프신이 골세포에서 발현된다.이러한 시스테인과 아스파르트 단백질 분해효소의 기능은 일반적으로 뼈 내에서 알려져 있지 않으며, 카테프신 K보다 훨씬 낮은 수준에서 발현된다.
카테프신 L 녹아웃 생쥐에 대한 연구는 야생형에 비해 호모 접합 및 헤테로 접합 카테프신 L 녹아웃 생쥐의 삼엽골 감소 보고와 골격 이상을 발견하지 못한 다른 보고와 함께 혼합되었다.
매트릭스금속단백질가수분해효소
매트릭스 금속단백질가수분해효소(MMP)는 20개 이상의 아연 의존성 엔도펩티다아제 패밀리로 구성됩니다.골세포생물학에서 매트릭스메탈로프로테아제(MMP)의 역할은 잘못 정의되어 있지만, 다른 조직에서는 성장인자의 활성화와 같은 종양 촉진 활동과 연계되어 종양 전이 및 혈관 형성에 필요하다.
MMP9는 골격 미세 환경과 관련되어 있습니다.그것은 골세포에 의해 발현되며, 골세포 이동에 필요한 것으로 알려져 있으며 강력한 젤라틴화효소이다.MMP-9가 없는 트랜스제닉 마우스는 뼈의 발달, 골내 혈관신생, 골절 복구에 결함이 생긴다.
MMP-13은 녹아웃 생쥐가 골세포 수 감소, 골편화, 골흡수 감소를 나타냄에 따라 뼈의 흡수와 골세포 분화에 관여하는 것으로 여겨진다.
골세포에 의해 발현되는 MMP는 MMP-9, -10, -12 및 -14를 포함하며, MMP-9 외에 골세포와의 관련성에 대해서는 거의 알려져 있지 않지만, 봉합부위에서는 높은 수준의 MMP-14가 발견된다.
골아세포생리학
1980년대와 90년대에는 전형적인 골세포의 생리학이 상세하게 연구되었다.주름진 테두리가 분리되면서, 경계를 가로지르는 이온 전달이 생화학적으로 직접 연구되었다.에너지 의존성 산수송을 검증하고 가정된 양성자 펌프를 [14][15]정제하였다.골세포의 성공적인 배양으로, 골세포는 흡수 구획의 산성화와 골 미네랄의 가용화를 위해 양성자의 대량 수송을 지원하도록 조직되어 있는 것이 분명해졌다.여기에는 막 전위를 제어하기 위한 주름진 경계− Cl 투과성과 생리적으로 허용되는 범위에서 [16][17][18]세포질 pH를 유지하기 위한 기저측 Cl−/HCO3− 교환이 포함된다.
이온 분비의 효과는 흡수 구획 주위에 효과적인 씰을 형성하는 골세포에 따라 달라집니다.이 "씰링 영역"의 위치는 골세포 [19]표면에 표현된 인테그린에 의해 매개되는 것으로 보입니다.봉합 구역이 정해진 상태에서 다핵 골세포가 스스로 재구성됩니다.흡착 구획에 해당하는 고침입 주름막을 현상함으로써 대량의 분비활동이 가능해진다.또한 광물질 및 분해된 콜라겐을 주름진 경계에서 세포 유리막으로 소포성 경세포화시켜 세포외부로 [20][21]방출할 수 있도록 한다.이 활동은 뼈 흡수를 완료하고 미네랄 성분과 콜라겐 조각이 일반 순환으로 방출됩니다.
규정
골아세포는 부갑상선의 부갑상선 호르몬(PTH), 갑상선의 칼시토닌, 그리고 성장인자 인터류킨 6(IL-6)을 포함한 여러 호르몬에 의해 조절된다.마지막 호르몬인 IL-6는 골다공증의 요인 중 하나입니다.골다공증은 골세포의 뼈 흡수 활동과 골세포의 [22]뼈 형성 활동 사이에 불균형이 있을 때 발생한다.
골아세포 활성은 또한 골아세포에 의해 생성된 두 분자, 즉 골단백질과 RANK 배위자의 상호작용에 의해 매개된다.이러한 분자는 또한 골세포의 [23]분화를 조절합니다.
오돈토클라스트
오돈토클라스트(/odon·to·clast/; o-don·to-klast)는 낙엽성 [2][3][4]치아의 뿌리 흡수와 관련된 골세포이다.
용어의 대체 사용
골세포는 골절 및 리셋에 사용되는 기구일 수도 있습니다(원래는 그리스 골격: 골격: 골절 및 클라스토스: 골절).혼동을 피하기 위해, 그 세포는 원래 osotoclast라고 불렸다.그 수술 도구가 사용되지 않게 되자, 그 세포는 현재의 이름으로 알려지게 되었다.
임상적 의의
거대한 골세포는 파제트병과 비스포네이트 독성을 포함한 몇몇 질병에서 발생할 수 있다.
고양이에서 비정상적인 치핵세포 활동은 고양이 치핵흡수성 병변을 일으킬 수 있으며, 이로 인해 치아를 뽑아야 한다.
역사
골세포는 1873년 [11]콜리커에 의해 발견되었다.
「 」를 참조해 주세요.
레퍼런스
- ^ Laiq Hussain Siddiqui의 의료조직학 (제6판)
- ^ a b "Odontoclast". Farlex, The Free Dictionary. 2007. Retrieved 2013-11-06.
- ^ a b Wang Z, McCauley LK (March 2011). "Osteoclasts and odontoclasts: signaling pathways to development and disease". Oral Diseases. 17 (2): 129–42. doi:10.1111/j.1601-0825.2010.01718.x. PMID 20659257.
- ^ a b Chatterjee K (1 December 2006). Essentials of Oral Histology. Jaypee Brothers Publishers. p. 155. ISBN 978-81-8061-865-9.
- ^ Basle MF, Mazaud P, Malkani K, Chretien MF, Moreau MF, Rebel A (1988). "Isolation of osteoclasts from Pagetic bone tissue: morphometry and cytochemistry on isolated cells". Bone. 9 (1): 1–6. doi:10.1016/8756-3282(88)90020-8. PMID 2837260.
- ^ Jain N, Weinstein RS (2009). "Giant osteoclasts after long-term bisphosphonate therapy: diagnostic challenges". Nat Rev Rheumatol. 5 (6): 341–6. doi:10.1038/nrrheum.2009.87. PMC 2860596. PMID 19491914.
- ^ Standring S, ed. (2005). Gray's Anatomy (39th ed.). Elsevier.
- ^ Holtrop ME, King GJ (1977). "The ultrastructure of the osteoclast and its functional implications". Clinical Orthopaedics and Related Research. 123 (123): 177–96. doi:10.1097/00003086-197703000-00062. PMID 856515. S2CID 30010574.
- ^ Väänänen HK, Zhao H, Mulari M, Halleen JM (February 2000). "The cell biology of osteoclast function". Journal of Cell Science. 113 (3): 377–81. doi:10.1242/jcs.113.3.377. PMID 10639325.
- ^ S. L. Teitelbaum (2000), "Bone Resorption by Osteoclasts", Science, 289 (5484): 1504–1508, Bibcode:2000Sci...289.1504T, doi:10.1126/science.289.5484.1504, PMID 10968780
- ^ a b Nijweide PJ, Burger EH, Feyen JH (October 1986). "Cells of bone: proliferation, differentiation, and hormonal regulation". Physiological Reviews. 66 (4): 855–86. doi:10.1152/physrev.1986.66.4.855. PMID 3532144.
- ^ Michou, Laëtitia; Numan, Mohamed; Amiable, Nathalie; Brown, Jacques P. (2015). "Paget's disease of bone: An osteoimmunological disorder?". Drug Design, Development and Therapy. 9: 4695–707. doi:10.2147/DDDT.S88845. PMC 4544727. PMID 26316708.
- ^ Numan, Mohamed; Brown, Jacques; Michou, Laëtitia (2015). "Impact of Air Pollutants on Oxidative Stress in Common Autophagy-Mediated Aging Diseases". International Journal of Environmental Research and Public Health. 12 (2): 2289–2305. doi:10.3390/ijerph120202289. PMC 4344726. PMID 25690002.
- ^ Blair HC, Teitelbaum SL, Ghiselli R, Gluck S (August 1989). "Osteoclastic bone resorption by a polarized vacuolar proton pump". Science. 245 (4920): 855–7. Bibcode:1989Sci...245..855B. doi:10.1126/science.2528207. PMID 2528207.
- ^ Mattsson JP, Schlesinger PH, Keeling DJ, Teitelbaum SL, Stone DK, Xie XS (October 1994). "Isolation and reconstitution of a vacuolar-type proton pump of osteoclast membranes". The Journal of Biological Chemistry. 269 (40): 24979–82. doi:10.1016/S0021-9258(17)31485-0. PMID 7929181.
- ^ Teti A, Blair HC, Teitelbaum SL, Kahn AJ, Koziol C, Konsek J, Zambonin-Zallone A, Schlesinger PH (January 1989). "Cytoplasmic pH regulation and chloride/bicarbonate exchange in avian osteoclasts". The Journal of Clinical Investigation. 83 (1): 227–33. doi:10.1172/jci113863. PMC 303666. PMID 2910910.
- ^ Blair HC, Teitelbaum SL, Tan HL, Koziol CM, Schlesinger PH (June 1991). "Passive chloride permeability charge coupled to H(+)-ATPase of avian osteoclast ruffled membrane". The American Journal of Physiology. 260 (6 Pt 1): C1315-24. doi:10.1152/ajpcell.1991.260.6.C1315. PMID 1829326.
- ^ Schlesinger PH, Blair HC, Teitelbaum SL, Edwards JC (July 1997). "Characterization of the osteoclast ruffled border chloride channel and its role in bone resorption". The Journal of Biological Chemistry. 272 (30): 18636–43. doi:10.1074/jbc.272.30.18636. PMID 9228032.
- ^ Väänänen HK, Zhao H, Mulari M, Halleen JM (February 2000). "The cell biology of osteoclast function". Journal of Cell Science. 113 ( Pt 3) (3): 377–81. doi:10.1242/jcs.113.3.377. PMID 10639325.
- ^ Salo J, Lehenkari P, Mulari M, Metsikkö K, Väänänen HK (April 1997). "Removal of osteoclast bone resorption products by transcytosis". Science. 276 (5310): 270–3. doi:10.1126/science.276.5310.270. PMID 9092479.
- ^ Nesbitt SA, Horton MA (April 1997). "Trafficking of matrix collagens through bone-resorbing osteoclasts". Science. 276 (5310): 266–9. doi:10.1126/science.276.5310.266. PMID 9092478.
- ^ Dance, Amber (23 February 2022). "Fun facts about bones: More than just scaffolding". Knowable Magazine. doi:10.1146/knowable-022222-1. Retrieved 8 March 2022.
- ^ Schoppet M, Preissner KT, Hofbauer LC (April 2002). "RANK ligand and osteoprotegerin: paracrine regulators of bone metabolism and vascular function". Arteriosclerosis, Thrombosis, and Vascular Biology. 22 (4): 549–53. doi:10.1161/01.ATV.0000012303.37971.DA. PMID 11950689.
외부 링크
- 메디신넷
- 미국 국립 의학 도서관 의학 주제 제목(MeSH)의 골세포
- 오스테오클라스트의 생애
- Random42: 골세포가 뼈 리모델링에 미치는 역할에 관한 Random42 Scientific Communication의 애니메이션




