글리옥실산
Glyoxylic acid | |
 | |
| 이름 | |
|---|---|
| 선호 IUPAC 이름 옥소아세트산[1] | |
| 체계적 IUPAC 이름 옥소에탄노산 | |
| 기타 이름 | |
| 식별자 | |
3D 모델(JSmol) | |
| 체비 | |
| 켐벨 | |
| 켐스파이더 | |
| 드러그뱅크 | |
| ECHA InfoCard | 100.005.508 |
| 케그 | |
펍켐 CID | |
| 유니 | |
CompTox 대시보드 (EPA) | |
| |
| |
| 특성. | |
| C2H2O3 | |
| 어금질량 | 74.035 g·1998−1 |
| 밀도 | 1.384 g/mL |
| 녹는점 | 80°C(176°F, 353K)[4] |
| 비등점 | 111°C(232°F, 384K) |
| 산도(pKa) | 3.18,[2] 3.32 [3] |
| 관련 화합물 | |
기타 음이온 | 글리옥실산염 |
관련 카르복실산 | 포름산 아세트산 글리콜산 옥살산 프로피온산 피루브산 |
관련 화합물 | 아세트알데히드 당화성의 글리콜알데히드 |
달리 명시된 경우를 제외하고, 표준 상태(25°C [77°F], 100 kPa)의 재료에 대한 데이터가 제공된다. | |
| Infobox 참조 자료 | |
글리옥실산 또는 옥소아세트산은 유기 화합물이다. 아세트산, 글리콜산, 옥살산과 함께 글리옥실산은 C2 카르복실산 중 하나이다. 그것은 자연적으로 발생하며 산업적으로 유용한 무색 고체다.
구조 및 명명법
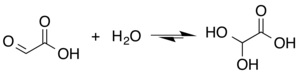
글리옥실릭산의 구조는 알데히드 기능군을 가진 것으로 설명되지만, 알데히드는 어떤 상황에서 가장 널리 퍼져 있는 형태의 작은 구성 요소일 뿐이다. 대신, 그것은 종종 수화물이나 주기적 조광기로 존재한다. 예를 들어, 물이 있는 곳에서 카보닐은 보석 디올(이하 "단수화물"이라 한다)으로 빠르게 전환된다. 평형 상수(K)는 상온에서 디히드록시아세트산을 형성하기 위해 300이다.[5]
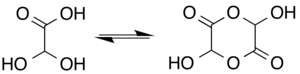
용액에서 단수화물(monohydrate)은 헤미실용 조광기 형태와 평형을 이루며 존재한다.[6]
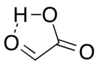
알데히드 구조는 주요 컨포머로서 알데히드 카보닐이 카복실 수소에 근접하여 있는 순환 수소 결합 구조를 가지고 있다.[7]
글리옥시릴산의 헨리의 법칙 상수는H K = 1.09 × 104 × exp[(40.0 × 103/R) × (1/T - 1/298)]이다.[8]
준비
글리옥시릴산의 결합 베이스는 글리옥실산염으로 알려져 있으며, 중성 pH에서 용액에 화합물이 존재하는 형태다. 글리옥실레이트(Glyoxylate)는 여러 개의 첨가된 펩타이드의 생합성 과정에서 발생하는 아드레날레이션 과정의 부산물이다.
역사적 기록을 위해, glyoxylic acid는 전기합성적으로 옥살산으로부터 준비되었다.[9][10] 유기적 합성에서는, 황산 전해액에 있는 옥살산의 글리옥시릴산을 준비하기 위해 이산화납 음극이 사용되었다.[11]
뜨거운 질산은 글리옥셀을 글리옥실릭으로 산화시킬 수 있다. 그러나 이 반응은 발열성이 강하고 열가동하기 쉽다. 게다가 옥살산이 주산이다.
생물학적 역할
글리옥실레이트(Glyoxylate)는 글리옥실산 주기(glyoxylate cycle)의 중간으로, 박테리아, 곰팡이,[12] 식물 등 유기체가 지방산을 탄수화물로 변환할 수 있게 한다. 글리옥실산염 주기는 곰팡이에 반응하는 식물 방어 메커니즘의 유도에도 중요하다.[14] 글리옥실산염 주기는 이소시틸레이트 리아제의 활동을 통해 시작되며, 이소시틸레이스를 글리옥실산염으로 변환하여 굴복시킨다. 굴복의 생합성 등 다양한 용도의 경로를 공동 선택하기 위한 연구가 진행되고 있다.[15]
인간에게
글리옥실산염은 과록시솜에서 글리콜레이트 산화를 통해 또는 미토콘드리아에서 히드록시프로라인의 카타볼리즘을 통해 생성된다.[16] 과록시솜에서 글리옥실산은 AGT1에 의해 글리신 또는 글리콜레이트 산화효소에 의해 옥살산염으로 전환된다. 미토콘드리아에서 글리코실레이트는 AGT2에 의해 글리신 또는 글리콜레이트 환원효소에 의해 글리콜레이트로 변환된다. 소량의 글리옥실산염은 세포질 유산균 탈수소효소에 의해 옥살산염으로 전환된다.[17]
식물에서
글리옥실산염 경로의 중간이 되는 것 외에도 글리옥실산염은 광자극 경로의 중요한 중간이다. 광자극은 루비스의 측면 반응의 결과물이다.CO2 대신 O로2 CO. 처음에는 에너지와 자원의 낭비로 간주되었지만, 광자극은 탄소 및 CO를2 재생하고, 독성 인산염은 제거하며, 방어 메커니즘을 시작하는 중요한 방법임이 밝혀졌다.[18][19] 광자극에서 글리콜산염은 과산화질소 내 글리콜산염 산화효소의 활동을 통해 글리콜산염에서 변환된다. 그런 다음 SSGAT와 GGAT에 의해 병렬 작용을 통해 글리신(glycine)으로 변환되어 미토콘드리아로 운반된다.[20][19] 또한 화농산 탈수소효소 복합체가 글리콜산염과 글리옥실산염 신진대사에 역할을 할 수 있다고 보고되었다.[21]
질병 관련성
당뇨병
글리옥실산염은 제2형 당뇨병의 잠재적인 초기 표식물로 여겨진다.[22] 당뇨병리학의 주요 조건 중 하나는 고혈당증으로 인한 고급 글리제 최종 산물(AG)[23]의 생산이다. AGE는 조직 손상과 심혈관 질환과 같은 당뇨병의 추가적인 합병증으로 이어질 수 있다.[24] 그것들은 일반적으로 환원 당류나 알파-옥소-옥소-옥소-탈하이드와 같은 반응성 알데하이드로부터 형성된다. 한 연구에서 나중에 제2형 당뇨병을 진단받은 환자들에서 글리옥실산염 수치가 크게 증가한 것으로 밝혀졌다.[22] 상승된 수치는 때때로 진단 3년 전에 발견되어 글리옥실산염의 잠재적인 역할이 초기 예측 표식기가 될 수 있음을 보여주었다.
네프로롤리티아시스
글리옥실산염은 네프로롤리티아스(일반적으로 신장결석이라고 알려져 있음)의 주요 원인인 과옥살루리아(hyperoxaluria)의 발달에 관여하고 있다. 글리옥실레이트(Glyoxylate)는 옥살레이트 수송을 담당하는 유전자인 황산염 음이온 트랜스포터-1(sat-1)의 기질이자 인덕터로서 sat-1 mRNA 발현을 증가시키고 그 결과 옥살레이트 배출이 세포에서 발생한다. 옥살산염 방출량이 증가하면 소변에서 옥살산칼슘이 축적되어 결국 신장결석이 형성된다.[17]
글리옥실산염 신진대사의 붕괴는 고산칼루리아 발달을 위한 추가적인 메커니즘을 제공한다. HOGA1 유전자의 함수 돌연변이가 상실되면 글리옥실산염 경로에 대한 히드록시프로라인 내 효소인 4-하이드록시-2-옥소글루타레이트 알돌라아제가 상실된다. 이 경로에서 발생하는 글리옥실산염은 일반적으로 세포솔에서 옥살산염으로의 산화를 방지하기 위해 멀리 저장된다. 그러나 이 교란된 통로는 4-히드록시-2-옥소글루타레이트 축적을 일으키는데, 이 축적은 시토솔로 운반되어 다른 알돌라제를 통해 글리옥실산염으로 변환될 수도 있다. 이러한 글리옥실산염 분자는 옥살산염으로 산화되어 농도가 높아지고 고옥살루증을 일으킬 수 있다.[16]
반응 및 사용
글리옥실산은 아세트산보다 약 10배 강한 산이며, 산 분해 상수는 4.7 × 10−4(pKa = 3.32)이다.
- OCHCOH2 ⇌ OCHCO−
2+ + H
염기성 글리옥실산은 불균형하며 수산화산 및 옥살산을 형성한다.[citation needed]
- 2 OCHCOH2 + HO2 → HOCCOH22 + HOCCOH22
글리옥실산은 요소와 1,2-다이아미노벤젠으로 응축 시 헤테로사이클을 준다.
페놀 유도체
일반적으로 글리옥실산은 페놀과 함께 전기영양 방향족 치환 반응을 일으키는데, 이것은 다른 여러 화합물들의 합성에 있어 다용도적인 단계다.
페놀 그 자체로 즉시 생산되는 제품은 4-히드록시만델릭산이다. 이 종은 암모니아와 반응하여 아목시실린의 전구체인 히드록시페닐글리신(hydroxyphenylglycine)을 투여한다. 4-히드록시만델릭산을 줄이면 아테놀의 전구체인 4-히드록시페닐아세트산이 나온다.
글리옥시릴산이 페놀 성분의 과이아콜과 반응한 후 산화 및 데카복시화 과정으로 바닐린으로 가는 경로를 제공한다.[6][25][26]
홉킨스 콜 반응
글리옥실산은 홉킨스-콜레 반응의 성분으로 단백질에 트립토판이 있는지 확인하는 데 사용된다.[27]
환경화학
글리옥실산은 2차 유기 에어로졸에 풍부한 케톤과 알데히드를 함유한 카복실산 중 하나이다. 물과 햇빛이 있는 곳에서 글리옥시릴산은 광화학 산화를 겪을 수 있다. 여러 가지 다른 반응 경로가 뒤따를 수 있고, 다양한 다른 카르복실산과 알데히드 제품들로 이어질 수 있다.[28]
안전
이 화합물은 2500mg/kg의 랫드에50 대한 LD로 그다지 독성이 없다.
참조
- ^ a b "Front Matter". Nomenclature of Organic Chemistry : IUPAC Recommendations and Preferred Names 2013 (Blue Book). Cambridge: The Royal Society of Chemistry. 2014. p. 748. doi:10.1039/9781849733069-FP001. ISBN 978-0-85404-182-4.
- ^ 유기산 및 염기 분리 상수(600 화합물), http://zirchrom.com/organic.htm.
- ^ R에 의해 컴파일된 pKa 데이터. Williams, : CS1 maint: 타이틀로 보관된 복사본(링크)
- ^ 머크 지수, 11판, 4394
- ^ Sørensen, P. E.; Bruhn, K.; Lindeløv, F. (1974). "Kinetics and equilibria for the reversible hydration of the aldehyde group in glyoxylic acid". Acta Chem. Scand. 28: 162–168. doi:10.3891/acta.chem.scand.28a-0162.
- ^ a b c Georges Mattioda와 Yani Christidis "Glyoxylic Acid" 울만의 산업 화학 백과사전, 2002년 Wiley-VCH, Weinheim. doi:10.1002/14356007.a12_495
- ^ Redington, Richard L.; Liang, Chin-Kang Jim (1984). "Vibrational spectra of glyoxylic acid monomers". Journal of Molecular Spectroscopy. 104 (1): 25–39. Bibcode:1984JMoSp.104...25R. doi:10.1016/0022-2852(84)90242-X.
- ^ Ip, H. S. Simon; Huang, X. H. Hilda; Yu, Jian Zhen (2009). "Effective Henry's law constants of glyoxal, glyoxylic acid, and glycolic acid" (PDF). Geophysical Research Letters. 36 (1): L01802. Bibcode:2009GeoRL..36.1802I. doi:10.1029/2008GL036212.
- ^ Tafel, Julius; Friedrichs, Gustav (1904). "Elektrolytische Reduction von Carbonsäuren und Carbonsäureestern in schwefelsaurer Lösung". Berichte der Deutschen Chemischen Gesellschaft. 37 (3): 3187–3191. doi:10.1002/cber.190403703116.
- ^ Cohen, Julius (1920). Practical Organic Chemistry 2nd Ed (PDF). London: Macmillan and Co. Limited. pp. 102–104.
- ^ François Cardarelli (2008). Materials Handbook: A Concise Desktop Reference. Springer. p. 574. ISBN 978-1-84628-668-1.
- ^ Holms WH (1987). "Control of flux through the citric acid cycle and the glyoxylate bypass in Escherichia coli". Biochem Soc Symp. 54: 17–31. PMID 3332993.
- ^ Escher CL, Widmer F (1997). "Lipid mobilization and gluconeogenesis in plants: do glyoxylate cycle enzyme activities constitute a real cycle? A hypothesis". Biol. Chem. 378 (8): 803–813. PMID 9377475.
- ^ Dubey, Mukesh K.; Broberg, Anders; Sooriyaarachchi, Sanjeewani; Ubhayasekera, Wimal; Jensen, Dan Funck; Karlsson, Magnus (September 2013). "The glyoxylate cycle is involved in pleotropic phenotypes, antagonism and induction of plant defence responses in the fungal biocontrol agent Trichoderma atroviride". Fungal Genetics and Biology. 58–59: 33–41. doi:10.1016/j.fgb.2013.06.008. ISSN 1087-1845. PMID 23850601.
- ^ Zhu, Li-Wen; Li, Xiao-Hong; Zhang, Lei; Li, Hong-Mei; Liu, Jian-Hua; Yuan, Zhan-Peng; Chen, Tao; Tang, Ya-Jie (November 2013). "Activation of glyoxylate pathway without the activation of its related gene in succinate-producing engineered Escherichia coli". Metabolic Engineering. 20: 9–19. doi:10.1016/j.ymben.2013.07.004. ISSN 1096-7176. PMID 23876414.
- ^ a b Belostotsky, Ruth; Pitt, James Jonathon; Frishberg, Yaacov (2012-12-01). "Primary hyperoxaluria type III—a model for studying perturbations in glyoxylate metabolism". Journal of Molecular Medicine. 90 (12): 1497–1504. doi:10.1007/s00109-012-0930-z. hdl:11343/220107. ISSN 0946-2716. PMID 22729392. S2CID 11549218.
- ^ a b Schnedler, Nina; Burckhardt, Gerhard; Burckhardt, Birgitta C. (March 2011). "Glyoxylate is a substrate of the sulfate-oxalate exchanger, sat-1, and increases its expression in HepG2 cells". Journal of Hepatology. 54 (3): 513–520. doi:10.1016/j.jhep.2010.07.036. ISSN 0168-8278. PMID 21093948.
- ^ "photorespiration". Retrieved 2017-03-09.
- ^ a b Peterhansel, Christoph; Horst, Ina; Niessen, Markus; Blume, Christian; Kebeish, Rashad; Kürkcüoglu, Sophia; Kreuzaler, Fritz (2010-03-23). "Photorespiration". The Arabidopsis Book / American Society of Plant Biologists. 8: e0130. doi:10.1199/tab.0130. ISSN 1543-8120. PMC 3244903. PMID 22303256.
- ^ Zhang, Zhisheng; Mao, Xingxue; Ou, Juanying; Ye, Nenghui; Zhang, Jianhua; Peng, Xinxiang (January 2015). "Distinct photorespiratory reactions are preferentially catalyzed by glutamate:glyoxylate and serine:glyoxylate aminotransferases in rice". Journal of Photochemistry and Photobiology B: Biology. 142: 110–117. doi:10.1016/j.jphotobiol.2014.11.009. ISSN 1011-1344. PMID 25528301.
- ^ Blume, Christian; Behrens, Christof; Eubel, Holger; Braun, Hans-Peter; Peterhansel, Christoph (November 2013). "A possible role for the chloroplast pyruvate dehydrogenase complex in plant glycolate and glyoxylate metabolism". Phytochemistry. 95: 168–176. doi:10.1016/j.phytochem.2013.07.009. ISSN 0031-9422. PMID 23916564.
- ^ a b Nikiforova, Victoria J.; Giesbertz, Pieter; Wiemer, Jan; Bethan, Bianca; Looser, Ralf; Liebenberg, Volker; Ruiz Noppinger, Patricia; Daniel, Hannelore; Rein, Dietrich (2014). "Glyoxylate, a New Marker Metabolite of Type 2 Diabetes". Journal of Diabetes Research. 2014: 685204. doi:10.1155/2014/685204. ISSN 2314-6745. PMC 4265698. PMID 25525609.
- ^ Nguyen, Dung V.; Shaw, Lynn C.; Grant, Maria B. (2012-12-21). "Inflammation in the pathogenesis of microvascular complications in diabetes". Frontiers in Endocrinology. 3: 170. doi:10.3389/fendo.2012.00170. ISSN 1664-2392. PMC 3527746. PMID 23267348.
- ^ Piarulli, Francesco; Sartore, Giovanni; Lapolla, Annunziata (April 2013). "Glyco-oxidation and cardiovascular complications in type 2 diabetes: a clinical update". Acta Diabetologica. 50 (2): 101–110. doi:10.1007/s00592-012-0412-3. ISSN 0940-5429. PMC 3634985. PMID 22763581.
- ^ Fatiadi, Alexander; Schaffer, Robert (1974). "An Improved Procedure for Synthesis of DL-4-Hydroxy-3-methoxymandelic Acid (DL-"Vanillyl"-mandelic Acid, VMA)". Journal of Research of the National Bureau of Standards Section A. 78A (3): 411–412. doi:10.6028/jres.078A.024. PMID 32189791.
- ^ Kamlet, Jonas; Mathieson, Olin (1953). Manufacture of vanillin and its homologues U.S. Patent 2,640,083 (PDF). U.S. Patent Office.
- ^ R.A. Joshi (2006). Question Bank of Biochemistry. New Age International. p. 64. ISBN 978-81-224-1736-4.
- ^ Eugene, Alexis J.; Xia, Sha-Sha; Guzman, Marcelo I. (2016). "Aqueous Photochemistry of Glyoxylic Acid". J. Phys. Chem. A. 120 (21): 3817–3826. Bibcode:2016JPCA..120.3817E. doi:10.1021/acs.jpca.6b00225. PMID 27192089.