크로타민
Crotamine| 크로타민 | |||||||
|---|---|---|---|---|---|---|---|
 | |||||||
| 식별자 | |||||||
| 유기체 | ? | ||||||
| 기호 | CRO2 | ||||||
| 유니프로트 | Q9PWF3 | ||||||
| |||||||
크로타민은 남미 방울뱀(Crotalus durissus breastus)의 독에 존재하는 독소다.기본 잔류물 11개(라이신 9개, 아르기닌 2개)와 시스테인 6개를 함유한 42리듀 장단백질이다.또한 북미 대초원 방울뱀인 크로탈루스 비르디시스 비르디스의 독으로부터 격리되어 있다.처음에는 브라질 과학자 조제 모우라 곤살베스(José Morua Gonsalves)에 의해 고립되고 정화되었으며, 이후 상파울루 대학의 리바이랑 프레토 의과대학에서 그의 협력자 그룹에 의해 집중적으로 연구되었다.
생물 함수
크로타민은 세포막의 나트륨 통로에 작용하고, 약간 진통성이 있으며, 근독성, 즉 근육의 세포에 침투하여 괴사를 촉진하는 등 여러 생물학적 작용을 가지고 있다.크로타민은 다른 독성 미오톡신과 동질성이 있으며 α-,β-디펜신과 유사하다.
생화학 및 메커니즘
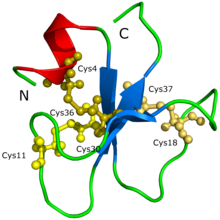
아미노산 염기서열 (YKQCHKKGGHCFPKEKICLPPSSDFGKMDCRWRWKCCKKGSG, Cys4-Cys36, Cys11-Cys30, Cys18-Cys37) and the 3D molecular structure of crotamine have already been determined.
크로타민의 단백질 구조는 단백질 결정이나 X선 회절 등을 통해 초기에는 결정할 수 없었다.[1]크로타민에는 이소성형이 너무 많아 골재가 형성되고 단백질의 가능한 순응이 다르기 때문이라고 추측했다.단백질의 구조와 모양은 시케이라 외 연구진이 생성한 3D 모델을 통해 제안되었다.(2002) 집중적인 분자역학 시뮬레이션 및 동종학 모델링 절차에서 지원되는 계산 계산을 기반으로 한다.이후 니카스트로 외 연구진.(2003) 핵자기공명 분광법을 통해 크로타민의 구조를 발견했다.크로타민은 이온 채널을 표적으로 하는 활성 독소에서는 이전에는 볼 수 없었던 위상이 있는데, 단백질 형성의 한 종류인 짧은 N단자 알파 나선과 또 다른 종류의 단백질 형성의 한 종류인 작은 항타렐 3단자 베타 시트로 구성되어 있으며, 아브1b2b3 위상에 배열되어 있다.크로타민은 동일한 이황화 교량 배열뿐만 아니라 인간 b-defensin 계열과 유사한 구조 접이식 교량을 가지고 있다.[1]
[필요한 그림]
그 합성을 책임지는 유전자와 염색체 위치는 브라질 상파울루 부탄탄 연구소에서 일하는 간디 라디스 바티스타가 이끄는 그룹에 의해 확인되었다.mRNA는 약 340개의 뉴클레오티드를 함유하고 있으며 신호 펩타이드, 숙성 크로토아민, 최종 리신을 포함한 프리크로타민을 성문화한다.crotamine)을 성문화한다.
크로타민 유전자는 뱀 염색체에 지도화된 첫 번째 유전자였다.[1]크로타민 단백질의 코딩을 담당하는 유전자는 Crt-p1로 표시되며, 염기쌍 염기쌍 염기서열 길이는 약 1.1kbp 또는 1100bp이다.크로타민 유전자는 두 개의 다른 시료에서 두 번 격리되었는데, 하나는 유전자 크기가 1.8kbp, 다른 하나는 유전자 크기가 1.1kbp인 것으로 보고되었다.[2]이 유전자는 이전에 C. durissus breastus 게놈에서 격리되었고 단백질 자체는 작은 기본 폴리펩타이드 미오톡신 그룹에 속한다.크로탈루스 정맥의 내용은 아종과 지리적 위치에 따라 달라질 수 있다.[3]Crt-p1 유전자는 Radis-Bastista et al. 2003에서 설명한 바와 같이 약 3개의 exon으로 구성되어 있으며, 1개의 짧은 위상-2(140bp)와 1개의 긴 위상-1(900bp) 인트로 분리되어 있다.Exon 1 코드는 신호 펩타이드의 첫 19개 아미노산에 대한 것이며 5'-분산되지 않은 부위를 포함한다.엑손 2는 39개의 아미노산을 성숙한 크로타민과 3개의 신호 펩타이드 아미노산으로 코드화한다.단자 리신을 위한 Exon 3 코드와 성숙 독소의 마지막 세 아미노산.크로탈루스의 다른 종들 사이에서 SBPM 아미노산 염기서열에 대한 연구는 83% - 98%[2]의 높은 유사도를 보여주었다.
크로타민 성분이 함유된 작은 기본 폴리펩타이드 미오톡신 계열 단백질의 아미노산 코드가 서열화됐다.이들은 평균 83%의 차이를 보이며 비슷한 것으로 나타났다.크로타민 아미노산 염기서열은 미오톡신 a의 복제 DNA와 비교되었다. (SBPMs가 어떻게 작용하는지를 모형화하는 데 사용한 미오톡신)비교 결과 숙성된 묘톡신, 신호펩타이드 등 엑손 코딩 부위가 각각 98%, 100% 유사했다.샘플과 myotoxin a cDNA 사이의 5'와 3'의 미번역 부위는 각각 60%, 80%이었다.뱀 정맥에서 발견된 SBPM 계열이 아닌 다른 단백질의 아미노산 염기서열을 비교할 때, 보통 큰 차이가 있다.SBPM 단백질을 보면 크로탈루스 속 여러 아종과 같은 아종의 다른 개인들 사이에 유사성이 높다.이는 라디스 바티스타 외 2003년 연구에 따르면 크로타민 유전자와 다른 SBPM 유전자가 최근 진화했음을 나타낸다.
참조
- ^ a b c Oguiura N, Boni-Mitake M, Rádis-Baptista G (September 2005). "New view on crotamine, a small basic polypeptide myotoxin from South American rattlesnake venom". Toxicon. 46 (4): 363–70. doi:10.1016/j.toxicon.2005.06.009. PMID 16115660.
- ^ a b Samejima Y, Aoki Y, Mebs D (1991). "Amino acid sequence of a myotoxin from venom of the eastern diamondback rattlesnake (Crotalus adamanteus)". Toxicon. 29 (4–5): 461–8. doi:10.1016/0041-0101(91)90020-r. PMID 1862521.
- ^ Schenberg S (May 1959). "Geographical pattern of crotamine distribution in the same rattlesnake subspecies". Science. 129 (3359): 1361–3. doi:10.1126/science.129.3359.1361. PMID 13658964.
추가 읽기
- Goncalves JM, Deutsch HF (February 1956). "Ultracentrifugal and zone electrophoresis studies of some crotalidae venoms". Archives of Biochemistry and Biophysics. 60 (2): 402–11. doi:10.1016/0003-9861(56)90444-1. PMID 13292919.
- Giglio JR (November 1975). "Analytical studies on crotamine hydrochloride". Analytical Biochemistry. 69 (1): 207–21. doi:10.1016/0003-2697(75)90581-3. PMID 2030.
- Laure CJ (February 1975). "[The primary structure of crotamine (author's transl)]". Hoppe-Seyler's Zeitschrift für Physiologische Chemie (in German). 356 (2): 213–5. PMID 1176086.
- De Lucca FL, Imaizumi MT, Haddad A (April 1974). "Characterization of ribonucleic acids from the venom glands of Crotalus durissus terrifucus (Ophidia, Reptilia) after manual extraction of the venom. Studies on template activity and base composition". The Biochemical Journal. 139 (1): 151–6. doi:10.1042/bj1390151. PMC 1166261. PMID 4463939.
- Ownby CL, Cameron D, Tu AT (October 1976). "Isolation of myotoxic component from rattlesnake (Crotalus viridis viridis) venom. Electron microscopic analysis of muscle damage". The American Journal of Pathology. 85 (1): 149–66. PMC 2032543. PMID 970437.
- Rádis-Baptista G, Oguiura N, Hayashi MA, Camargo ME, Grego KF, Oliveira EB, Yamane T (July 1999). "Nucleotide sequence of crotamine isoform precursors from a single South American rattlesnake (Crotalus durissus terrificus)". Toxicon. 37 (7): 973–84. doi:10.1016/s0041-0101(98)00226-8. PMID 10484745.
- Kerkis A, Kerkis I, Rádis-Baptista G, Oliveira EB, Vianna-Morgante AM, Pereira LV, Yamane T (September 2004). "Crotamine is a novel cell-penetrating protein from the venom of rattlesnake Crotalus durissus terrificus". FASEB Journal. 18 (12): 1407–9. doi:10.1096/fj.03-1459fje. PMID 15231729. S2CID 20510076.
- Rádis-Baptista G, Kubo T, Oguiura N, Prieto da Silva AR, Hayashi MA, Oliveira EB, Yamane T (June 2004). "Identification of crotasin, a crotamine-related gene of Crotalus durissus terrificus". Toxicon. 43 (7): 751–9. doi:10.1016/j.toxicon.2004.02.023. PMID 15284009.
- Rádis-Baptista G, Kubo T, Oguiura N, Svartman M, Almeida TM, Batistic RF, et al. (December 2003). "Structure and chromosomal localization of the gene for crotamine, a toxin from the South American rattlesnake, Crotalus durissus terrificus". Toxicon. 42 (7): 747–52. doi:10.1016/j.toxicon.2003.10.019. PMID 14757205.
- Nicastro G, Franzoni L, de Chiara C, Mancin AC, Giglio JR, Spisni A (May 2003). "Solution structure of crotamine, a Na+ channel affecting toxin from Crotalus durissus terrificus venom". European Journal of Biochemistry. 270 (9): 1969–79. doi:10.1046/j.1432-1033.2003.03563.x. PMID 12709056. S2CID 20601072.
- Mouhat S, Jouirou B, Mosbah A, De Waard M, Sabatier JM (March 2004). "Diversity of folds in animal toxins acting on ion channels". The Biochemical Journal. 378 (Pt 3): 717–26. doi:10.1042/BJ20031860. PMC 1224033. PMID 14674883.
외부 링크
- 크로타신을 위한 뉴클레오티드 시퀀스 및 번역.엔트레스 데이터베이스.국립생명공학정보센터


