플루오르화 주석(IV)
Tin(IV) fluoride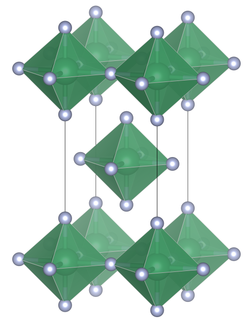 플루오르화 주석(IV) 단위 셀 | |
| 이름 | |
|---|---|
| IUPAC 이름 플루오르화 주석(IV) | |
| 기타 이름 불화 주석, 사불화 주석 | |
| 식별자 | |
3D 모델(JSmol) | |
| ECHA 정보 카드 | 100.029.105 |
| EC 번호 |
|
PubChem CID | |
| 유니 | |
| |
| |
| 특성. | |
| SnF4 | |
| 몰 질량 | 194.704 g/g |
| 외모 | 백색 고체 |
| 녹는점 | 700°C 이상(하위 시간) |
| 구조. | |
| 사각형, tI10 | |
| I4/mm, 139호 | |
| 관련 화합물 | |
기타 음이온 | 염화 주석(IV) 브롬화 주석(IV) 요오드화 주석(IV) |
기타 캐티온 | 사불화탄소 사불화 규소 사불화 게르마늄 사불화 주석 사불화납 |
달리 명시되지 않은 한 표준 상태(25°C[77°F], 100kPa)의 재료에 대한 데이터가 제공됩니다. | |
불화 주석(IV)은 주석과 불소의 화학식 SnF의4 화합물로, 녹는점이 700°[1]C 이상인 흰색 고체입니다.
SnF는4 주석 금속과 불소 [2]가스를 반응시켜 제조할 수 있습니다.
- Sn + 2F2 → SnF4
그러나, 부동화 금속 불소층이 생성되어 표면은 반응하지 않게 됩니다.대체4 합성으로는 SnCl과 무수 [1]불화수소의 반응이다.
- SnCl4 + 4HF → SnF4 + 4HCl
알칼리 금속 플루오르화물(예: KF)을 사용하여 헥사플루오로스탄산염(예:KSnF26)에는 8면체의62− SnF 음이온이 포함되어 있습니다.SnF는4 Lewis산으로 작용하며 L4·SnF 및4 L·SnF 부가물이2 [2]생성되었다.
구조.
사방배위주석을 함유하는 다른 사방배위주석, 염화주석(IV) 브롬화주석 및 요오드화주석(IV)과는 달리, 불화주석은 팔방배위주석의 평면층을 포함하고 있으며, 불화주석은 팔방배위주석이 4개의 모서리를 공유하며, 2개의 말단 불소원자가 서로 전이한다.[3]SnF의4 녹는점은 상대적으로 낮은 녹는 다른 주석(IV)보다 훨씬 높습니다(SnCl4, -33.3°C; SnBr4, 31°C; SnI4, 144°C).[1]이 구조는 또한 고체 상태에서 [2]분자 결정을 형성하는 그룹 14의 가벼운 구성원4(CF4, SiF 및4 GeF)의 4불화물과 대조될 수 있다.
「 」를 참조해 주세요.
레퍼런스
- ^ a b c Greenwood, N. N.; Earnshaw, A. (1997). Chemistry of the Elements (2nd ed.). Oxford:Butterworth-Heinemann. pp. 381. ISBN 0-7506-3365-4.
- ^ a b c Holleman, A. F.; Wiberg, E.; Wiberg, N. (2001). Inorganic Chemistry, 1st Edition. Academic Press. p. 908. ISBN 0-12-352651-5.
- ^ 무기화학 [페이퍼백], 2d판, Housecroft, Sharpe, 2004, Pearson Education ISBN 0130399132, ISBN 978-0130399137


