구조 이성질체
Structural isomer화학에서, 화합물의 구조적 이성질체(또는 IUPAC 명명법에서[1] 입헌 이성질체)는 분자가 각 원소의 원자 수는 같지만 논리적으로 서로 다른 결합을 갖는 또 다른 화합물이다.[2][3] 메타메이터라는 용어는 이전에 같은 개념으로 사용되었다.[4]
예를 들어, 부탄올 HC
3–(CH
2)–
3OH, 메틸 프로필 에테르 HC
3–(CH
2)–
2O–CH
3 및 디에틸 에테르(HC
3–CH
2–)2O는 분자 공식 CHO는
4
10 동일하지만, 세 가지 구조 등가선이다.
이 개념은 동일한 총전하를 가진 다원자 이온에도 적용된다. 고전적인 예로 청록산 이온 O=C=N과− 풀라이드 이온− CnoNO가+− 있다. 또한 이온 화합물에도 확장되어 (예를 들어)시안산암모늄[NH
4]+ [O=C=N]−과 요소[HN
2–)2C=O가 구조 이소재로 간주되며,[4] 메틸람모늄 포메이트[HC
3
2–NH
3]+−와 아세테이트[HC
4
3–+CO
2]− 암모늄 포메틸람모늄 포메테이트[HC–CO]도 있다.
구조 이소머리즘은 가장 급진적인 형태의 이소머리즘이다. 원자와 본딩 방식은 같지만 원자의 상대적 공간배열만 다른 입체파괴주의에 반대한다.[5][6] 후자의 예로는 에반토머가 있는데, 에반토머의 분자는 서로의 거울상이며, 2-부틴의 시스와 트랜스버전이다.
구조용 이소머 중 골격 이소머, 위치 이소머(또는 레지오이소머), 기능 이소머, 자동 이소머, 구조 토포이저 등 여러 부류를 구분할 수 있다.[7]
골격 이성질체학
화합물의 골격 이성질체는 분자의 "골격"을 구성하는 것으로 간주되는 원자와 결합에서 그것과 다른 구조 이성질체다. 알칸과 같은 유기 화합물의 경우, 그것은 보통 탄소 원자와 그 사이의 결합을 의미한다.
예를 들어 펜탄의 골격 이소머는 n-펜탄(흔히 '펜탄'이라고 부른다), 이소펜탄(2-메틸부탄), 네오펜탄(디메틸프로판) 등 세 가지가 있다.[8]
 |  | |
| 엔펜탄 | 이소펜탄 | 네오펜탄 |
위의 예에서와 같이 골격이 반복적인 경우, 체인 이소머리즘이라는 용어를 사용할 수 있다.
포지션 이소머리즘(지역이소머리즘)
포지션 이소머(Positional Isomer 또는 Regioisomer)는 기능 그룹의 위치, 대체물 또는 "부모" 구조에서 일부 다른 특징에서만 다른 것으로 볼 수 있는 구조 이소머이다.[9]
예를 들어, n-펜탄 모 분자에서 수소 원자 12개 중 1개(H)를 히드록실 그룹으로 교체하면 다음과 같은 세 가지 위치 등가선 중 하나를 얻을 수 있다.
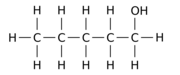 | 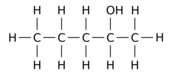 | 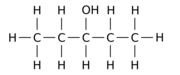 |
| 펜탄-1-올 | 펜탄-2-올 | 펜탄-3-올 |
기능 이성질체론
기능적 이소머는 서로 다른 기능 그룹을 갖는 구조적 이소머로, 화학적, 물리적 특성이 크게 달라진다.[10]
예를 들어 프로판날 HC-C32(=O)-H와 아세톤 HC-C3(=O)-CH3 쌍을 들 수 있다. 첫째는 알데히드로 만드는 –C(=O)H 기능군을 가지고 있고, 둘째는 케톤으로 만드는 C-C(=O)-C 그룹을 가지고 있다.
또 다른 예로는 에탄올 HC-CH-OH32(알코올)와 디메틸에테르 HC-O-CHH32(에테르) 쌍을 들 수 있다. 반대로 1-프로판올과 2-프로판올은 구조용 이소머로, 기능 이소머는 동일한 유의 기능군(히드록실 –OH)을 가지고 있고 둘 다 알코올이기 때문에 기능 이소머는 아니다.
다른 화학 물질 외에도 기능적 등유체는 일반적으로 적외선 스펙트럼이 매우 다르다. 적외선 스펙트럼은 분자의 진동 모드에 의해 크게 결정되며, 히드록실이나 에스테르와 같은 기능 그룹은 진동 모드가 매우 다르다. 따라서 1-프로판올과 2-프로판올은 히드록실 그룹 때문에 상대적으로 적외선 스펙트럼이 유사하며, 이는 메틸에틸에틸에테르와 상당히 다르다.[citation needed]
구조 동위원소 물질
화학에서 사람들은 보통 같은 원소의 동위원소들 사이의 구별을 무시한다. 단, 어떤 상황(예를 들어 Raman, NMR 또는 마이크로파 분광학)에서는 동일한 원소의 서로 다른 동위원소를 다른 원소로 취급할 수 있다. 두 번째 경우, 각 동위원소의 원자 수는 같지만 뚜렷한 결합 방식을 가진 두 개의 분자는 구조적인 동위원소라고 한다.
따라서 예를 들어, ethene은 첫 번째 해석에 따라 구조적인 이산화물이 없지만, 중수소 원자(12H) 중 2개를 중수소 원자(H)로 대체하면 두 개의 구조적인 동위원소 중 1개(1,1-디데루테온 및 1,2-디데루테로메테온)를 산출할 수 있다. 또한, 두 개의 탄소가 서로 다른 동위원소(예: C와 C)인 경우13, 1-C-1,1-디데로테네는 1-C-213,2-디데로테네와는 다르기 때문에 3개의 구별되는 구조 동위원소가 있을 것이다. 그리고 두 경우 모두 1,2-디데로 구조 동위원소 섬광체(cis 및 trans)가 두 개의 스테레오 동위원소 섬광체로 발생할 수 있다.
구조적 등가성 및 대칭성
구조적 등가성
하나는 두 개의 분자(다원자 이온 포함) A와 B는 A의 각 원자를 1대1로 같은 원소의 B의 원자와 쌍을 이룰 수 있다면, 그래서 A의 모든 결합에 대해 해당 원자들 사이에 B의, 같은 유형의, 같은 원자들 사이에 결합이 존재하게 되고, 그 반대의 경우도 마찬가지라고 말한다.[3] 이 요건은 또한 벤젠 분자 및 기타 방향성 화합물의 탈초점 결합과 같이 3개 이상의 원자를 포함하는 복잡한 결합을 적용한다.
문맥에 따라 각 원자를 동일한 원소가 아닌 동일한 동위원소의 원자와 쌍을 이루도록 요구할 수도 있다.
두 개의 분자가 동일한 분자식을 가지지만 구조가 동일하지 않으면 구조 등소체(또는 동위원소가 물질인 경우 구조 등소체)라고 말할 수 있다.
구조 대칭 및 등가 원자
분자의 구조 대칭은 적어도 두 개의 원자를 교환하지만 분자의 구조를 바꾸지 않는 원자의 순열로 수학적으로 정의할 수 있다. 그렇다면 두 원자는 하나를 다른 원자로 가져가는 구조적 대칭성이 있다면 구조적으로 동등하다고 할 수 있다.[11]
따라서 예를 들어, 메탄의 4개의 수소 원자는 모두 구조적으로 동등하다. 왜냐하면 그것들의 순열은 분자의 모든 결합을 보존할 것이기 때문이다.
두 탄소고 있기 때문입니다. 어떠한 수소 다른 진입하여야, 에탄(C2H6)의 모든 6인데 구조적으로 서로에게,; 같다는 스와프 거래는 단지 원자 두개거나 메틸 그룹의 다른 필로폰에 다른 수소 두 탄소와 각 수소 swaps 치환에 의한 치환에 의해.yl. 어느 조작이든 분자의 구조를 보존한다. 수소원자 사이클로펜탄, 알렌, 2부티네, 헥사메틸네테트라민, 프리즈만, 큐베인, 도데카헤드란 등도 그렇다.
반면 프로판의 수소 원자는 모두 구조적으로 동등하지는 않다. 제1탄소와 제3탄소에 부착된 6개의 탄화수소는 에탄과 같이 등가성이며, 중간탄소에 부착된 2개의 탄화수소는 서로 등가성이 있으나, 이 두 동등성 등급 사이에는 등가성이 없다.
대칭성 및 위치 이성질체론
모분자 원자 사이의 구조적 등가성은 다른 원소나 그룹을 위해 원자를 대체함으로써 얻을 수 있는 위치 등가물의 수를 감소시킨다. 따라서 예를 들어, 에탄 CH의
2
6 6개 수력 사이에 구조적 등가성은 6이 아니라 에탄올CHOH의
5 구조 등가물이 1개뿐이라는 것을 의미한다. 프로판 CH의
3
8 8개의 하이드로겐은 2개의 구조적 동등성 등급(메틸 그룹에 6개, 중앙 탄소 위에 2개)으로 구분되므로 프로판올(1-프로판올과 2-프로판올)의 포지션 이소머는 2개만 있다. 마찬가지로 부탄올의 위치 이소머는 2개, 펜탄올이나 헥산올의 위치 이소머는 3개뿐이다.
대체에 의한 대칭 파괴
일단 모분자에 대체가 이루어지면, 그 구조적인 대칭성이 보통 감소되는데, 이는 이전에 등가였던 원자들이 더 이상 그렇지 않을 수도 있다는 것을 의미한다. 따라서 둘 이상의 등가 원자를 동일한 원소로 대체하면 둘 이상의 위치 이성질체가 발생할 수 있다.
대표적인 예가 벤젠의 파생상품이다. 그것의 6개의 탄화수소는 모두 구조적으로 동등하며, 6개의 탄화수소도 마찬가지인데, 원자가 분자를 뒤집거나 60도의 배수로 회전시키는 것에 해당하는 방식으로 순열된다면 구조가 변하지 않기 때문이다. 따라서 염소로 수소를 대체하면 클로로벤젠은 단 1개만 발생한다. 그러나, 그 교체로, 그 수소를 움직였던 원자 순열은 더 이상 유효하지 않다. 염소를 고정시키면서 분자를 뒤집는 것에 해당하는 순열은 단 한 개만 남아 있는 것은 염소를 고정시키면서 분자를 뒤집는 것과 같다. 그 후 남은 5개의 수력발전소는 3개의 등가 등급으로 분류되는데, 염소와 반대되는 것은 그 자체로 등급(파라 포지션)이며, 염소에 가장 가까운 2개는 다른 등급(정통)을 형성하며, 나머지 2개는 3등급(메타)이다. 따라서 염소에 의한 수소의 두 번째 대체는 세 가지 위치 이성분자, 즉 1,2 또는 정형화, 1,3 또는 메타, 그리고 1,4 또는 파라-디클로로벤젠을 산출할 수 있다.
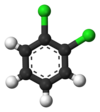 |  | 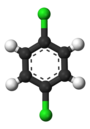 |
| 정형외과디클로로벤젠 | 메타디클로로벤젠 | 파라디클로벤젠 |
| 1,2-디클로로벤젠 | 1,3-디클로로벤젠 | 1,4-디클로로벤젠 |
같은 이유로 페놀(하이드록시벤젠)이 1개뿐인데 벤젠디올이 3개, 톨루엔(메틸벤젠)이 1개, 톨루올이 3개, 자일렌이 3개 있다.
한편, 두 번째 대체물(동일한 대체물에 의한)은 분자의 대칭을 보존하거나 심지어 증가시킬 수 있으며, 따라서 다음 대체물에 대한 동등성 등급의 수를 보존하거나 감소시킬 수 있다. 따라서 메타디클로로벤젠에 남아 있는 4개의 수력갱은 여전히 3개 등급으로 분류되는 반면 정형외과 4개는 2개 등급으로 분류되고, 파라 4개 등급은 모두 다시 동등하다. 그래도 이들 3 + 2 + 1 = 6 대체품 중 일부는 결국 같은 구조를 갖게 되므로 구조적으로 구별되는 3중화합물인 1,2,3-,1,2,4-,1,3,1,3,1,3,5- 세 가지밖에 없다.
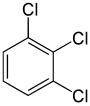 |  |  |
| 1,2,3-트리클로벤젠 | 1,2,4-트리클로벤젠 | 1,3,5-트리클로벤젠 |
각 단계의 대체물이 다르면 대개 구조적인 등가물이 더 많을 것이다. 하이드록실 대체제 1개와 메틸 대체제 2개로 벤젠인 자일레놀은 총 6개의 이소머를 가지고 있다.
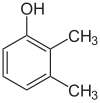 | 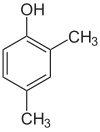 | 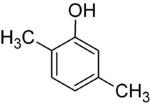 |
| 2,3-실레놀 | 2,4-실레놀 | 2,5-실레놀 |
 |  |  |
| 2,6-실레놀 | 3,4-실레놀 | 3,5-실레놀 |
등각체 열거 및 계수
일반적으로 구조 이등분자를 열거하거나 계수하는 것은 어려운 문제인데, 용맹성이나 기하학적 제약으로 인해 실현 가능성이 없는 여러 종류의 결합형(소산화형 포함), 순환구조, 구조물을 고려해야 하기 때문이다.
예를 들어, 분자식 CHO를36 갖는 9개의 구조 이소머가 서로 다른 결합성을 가지고 있다. 그 중 7개는 상온에서 공기안정성이 있으며, 아래 표에 제시되어 있다.
| 화학 화합물 | 분자구조 | 용융점 (°C) | 비등점 (°C) | 댓글 |
|---|---|---|---|---|
| 앨릴 알코올 | –129 | 97 | ||
| 사이클로프로판올 | 101–102 | |||
| 프로피온알데히드 | –81 | 48 | 프로펠러-1-en-1-ol이 있는 튜토메릭으로, 시스와 트랜스 스테레오 형태를 모두 가지고 있음 | |
| 아세톤 | 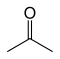 | –94.9 | 56.53 | 프로펜-2-올이 있는 토토메릭 |
| 옥세탄 | –97 | 48 | ||
| 프로필렌산화물 | –112 | 34 | 두 개의 항항성 형태를 가지고 있다. | |
| 메틸비닐에테르 | –122 | 6 |
구조용 이소머 2개는 카보닐 이소머(프로피온알데히드와 아세톤)의 에놀토토머지만 안정성이 떨어진다.[12]
참고 항목
참조
- ^ "Constitutional isomerism". IUPAC Gold Book. IUPAC. Retrieved 19 July 2018.
- ^ 프레더릭 A. 베텔하임, 윌리엄 H. 브라운, 메리 K. 캠벨, 숀 오 Farrell(2009) 유기화학과 생화학에 대한 소개. 752쪽 ISBN 9780495391166
- ^ a b 피터 P. Mumba(2018): 농업 및 간호학과 학생을 위한 화학의 유용한 원리, 제2판 281쪽. ISBN 9781618965288
- ^ a b 윌리엄 F. Bynum, E. Janet Browne, Roy Porter(2014): 과학사 사전. 530쪽. ISBN 9781400853410
- ^ 짐 클라크(2000). N.L. Chemguide의 "구조적 이성질체주의"
- ^ Poppe, Laszlo; Nagy, Jozsef; Hornyanszky, Gabor; Boros, Zoltan; Mihaly, Nogradi (2016). Stereochemistry and Stereoselective Synthesis: An Introduction. Weinheim, Germany: Wiley-VCH. pp. 26–27. ISBN 978-3-527-33901-3.
- ^ D. Bryn Hibbert, A.M. James(1987): 맥밀런 화학사전 532쪽 ISBN 9781349188178
- ^ 즈데넥 슬라니나(1986): 현대 화학 이성질체론 254쪽 ISBN 9789027717078
- ^ H. Stephen Stoker(2015): General, Organic, Biological Chemistry, 7판 1232쪽 ISBN 9781305686182
- ^ 배리 G. 힌우드 (1997년): 건강직종을 위한 과학 교과서. 489쪽. ISBN 9780748733774
- ^ 장루프 파울론, 안드레아스 벤더(2010): 화학정보학 알고리즘 핸드북 454쪽 ISBN 9781420082999
- ^ CRC 화학 및 물리학 지침서 제65차 개정.


