오르가노셀레늄 화학
Organoselenium chemistry오르가노셀레늄 화합물(또는 셀레노-유기농)은 탄소-셀레늄 화학 결합을 포함하는 화학 화합물이다. 오르가노셀레늄 화학은 그들의 성질과 반응성을 탐구하는 상응하는 과학이다.[1][2][3] 셀레늄은 그룹 16 원소나 찰코균에 산소와 황과 함께 속하며 화학의 유사성이 기대된다. 오르가노셀레늄 화합물은 주변 수역, 토양, 퇴적물에서 미량 수준에서 발견된다.[4]
셀레늄은 산화상태 -2, +2, +4, +6과 함께 존재할 수 있다. 세(II)는 오르가노셀레늄 화학에서 지배적인 형태다. 그룹 16 열 아래에서는 결합 강도가 점점 약해지고(C-Se 본드의 경우 234 kJ/mol, C-S 본드의 경우 272 kJ/mol), 결합 길이가 길어진다(C-Se 198pm, C-S 181 pm, C-O 141 pm). 셀레늄 화합물은 해당 유황 화합물보다 핵소독성이 높고 산성도 높다. XH의2 pKa 값은 산소의 경우 16, 황의 경우 7, 셀레늄의 경우 3.8이다. 해당 셀레녹시드는 황산화물과 대조적으로 β-프로톤이 존재하여 불안정하며 셀레늄의 많은 유기 반응, 특히 셀레늄 산화와 셀레옥시드 제거에 활용된다.
처음으로 격리된 오르간오세레늄 화합물은 1836년 디에틸셀레니드였다.[5][6]
오르가노셀레늄 화합물의 구조분류
- 셀레놀(RSEH)은 알코올과 티올의 셀레늄 등가물이다. 이러한 화합물은 비교적 불안정하며 일반적으로 불쾌한 냄새가 난다. 벤제네셀레놀(셀레나페놀 또는 PhSeH라고도 함)은 티오페놀(pKa 6.5)보다 산성(pKa 5.9)이 높고 이설화(diselenide)에도 더 쉽게 산화된다. 셀레나페놀은 디페닐디젤리드를 감소시켜 준비한다.[7]
- 이델레니데스(R-Se-Se-R)는 과산화물과 이황화물의 셀레늄 등가물이다. 그것들은 셀레놀과 셀라닐 할로겐화물과 같은 보다 반응성이 높은 오르가노셀렌늄 시약에 대한 유용한 선반 고정형 전구체다. 유기화학에서 가장 잘 알려진 것은 페닐마그네슘 브롬화물과 셀레늄에서 제조된 디페닐디젤리네이드로, PhSeMgBr 제품의 산화에 따른 것이다.[8]
- 셀라닐 할로겐화(R-Se-Cl, R-Se-Br)는 디젤화물의 할로겐화(halogenization)에 의해 준비된다. 디페닐디젤리세니드의 브로민화는 페닐셀라닐브로미드(PhSeBr)를 제공한다. 이 화합물들은 "PhSe+"의 원천이다.
- 셀레니데스(Selenides, R-Se-R)는 셀레늄 등가물로, 셀레늄은 에테르와 황화물의 등가물이다. 디메틸셀레네이드(CH3)2Se)가 대표적이다. 이것들은 가장 보편적인 오르가노셀레늄 화합물이다. 대칭 셀레니드는 보통 셀레니드 나트륨과 같은 알칼리 금속 셀레니드 염의 알킬화에 의해 준비된다. 비대칭 셀레니드는 셀레노아이트의 알키플레이션에 의해 준비된다. 이러한 화합물은 셀레노늄 염 R'RRSeX를+− 주기 위해 알킬 할로겐화물(R'-X)과 같은 핵물질로 반응한다. 분열성 셀레늄은 또한 부드러운 이질성과 상호 작용하여 고밸류 셀레늄 중심을 형성할 수 있다.[6] 또한 일부 환경에서는 전기영양체로서 반응한다. 예를 들어, 먹는 복합체 R'RSeLi에−+ 대한 유기석 시약(R'Li)으로 반응한다.
- 셀레녹시드(Selenoxide, R-Se(O)-R)는 황산화물의 셀레늄 등가물이다. 그것들은 추가로 셀레논의 셀레늄 아날로그인 셀레논 R-Se(O)2R로 산화될 수 있다.
- SEO-Selenoperoxols(RSE-OH, 이전의 셀렌산)는 셀레놀 산화의 매개체다. 그것들은 글루타티온 과산화효소와 같은 몇몇 셀레노엔자임에서 발생한다.
- 셀레닌산(RSE(O)OH)는 설핀산의 유사점이다.
- 페록시셀렌산(RSE(O)OOh)은 에폭시디 반응과 배이어-빌라이거 산화를 촉진한다.
- 셀레누란(Selenuranes)은 Secl과4 같은 테트라할리드로부터 공식적으로 파생된 고밸런트 오르가노셀레늄 화합물이다. 예로는 ArSecCl3 타입이 있다.[9] 염화물은 염화 셀레닐의 염소화를 통해 얻는다.
- 셀레니레인은 티아레인과 관련된 3-엠베드 고리(상위: CHSe24)이지만, 셀레니레인은 티아레네와는 달리 키네틱적으로 불안정하여 (산화 없이) 셀레늄을 직접 돌출시켜 알케인을 형성한다. 이 성질은 합성 유기 화학에 이용되어 왔다.[10]
- 셀론(RC2=Se)은 케톤(ketone)의 셀레늄 아날로그다. 그들은 과점화 경향 때문에 드물다.[11] 디셀레노벤조퀴논은 금속복합체로서 안정적이다.[12] Selenourea는 C=Se 결합을 함유한 안정적인 화합물의 예다.
- 셀레노티오페록시데스(R-Se-S-R)는 이황화물과 유사한 셀레늄-술푸르 결합을 가진 화합물이다.
자연 속의 오르가노셀레늄 화합물
셀레늄은 유기농 화합물의 형태로 심장 근육과 골격 기능 장애를 일으키는 필수 미생물이다. 오르가노셀렌늄 화합물은 산화성 손상에 대한 세포 방어와 면역체계의 정확한 기능을 위해 필요하다. 그들은 또한 조기 노화와 암을 예방하는 역할도 할 수 있다. 생합성에 사용되는 세의 근원은 셀렌인산염이다.
글루타티온 산화물(Glutathione oxidase)은 활성 부위에 셀레놀을 가진 효소다. 오르가노세레늄 화합물은 더 높은 식물에서 발견되었다. 예를 들어, 유도결합플라즈마 질량분석법(HPLC-ICP-MS)과 결합된 고성능 액체 크로마토그래피 기법을 이용한 마늘을 분석한 결과, met-글루타밀-세-메틸셀렌로시스테인은 세메틸셀렌로시스테인의 적은 양과 함께 주요 세 함유 성분으로 밝혀졌다. 디메틸셀렌화물과 아릴메틸셀렌화물의 미량량은 생마늘을 섭취한 후 사람의 입김에서 발견된다.[13]
셀레노시스테인과 셀레노메티오닌
21번째 아미노산으로 불리는 셀레노시스테인은 일부 유기체에서 리보솜이 이끄는 단백질 합성에 필수적이다.[14] 현재 25개 이상의 셀레늄 함유 단백질(셀레노프로테인)이 알려져 있다.[15] 대부분의 셀레늄 의존 효소는 셀레노시스테인을 함유하고 있는데, 셀레늄은 시스틴 아날로그와 관련이 있지만 유황을 대체하는 셀레늄과 관련이 있다. 이 아미노산은 DNA에 의해 특별한 방식으로 암호화된다.
셀레노메티오닌은 셀레니드가 함유된 아미노산으로, 역시 자연적으로 발생하지만, 전치 후 수정으로 생성된다.
유기합성에 있어서 오르간오글레늄
오르가노셀렌늄 화합물은 일반적으로 규제 이슈로 인해 의약품에 유용한 공정에서 제외되지만 유기합성에 유용한 시약의 전문적이지만 유용한 수집품이다. 이들의 유용성은 (i) C-Se 결합의 약점 및 (ii) 이분 셀레늄 화합물의 쉬운 산화를 포함한 특정 속성에 달려 있다.
비닐릭셀레니데스
비닐릭셀레니드는 유기합성에 역할을 하는 유기농 화합물이며, 특히 기능화된 알케인에 대한 편리한 입체적 경로의 개발에서 더욱 그러하다.[16] 빈혈 셀레니드의 조제에는 다양한 방법이 언급되지만, 보다 유용한 절차는 단자 또는 내부 알키네스에 첨가된 핵포질 또는 전기영양 유기농에 초점을 맞추었다.[17][18][19][20] 예를 들어, 알키네스에 셀레노페놀을 첨가하는 핵포화물은 상온에서 긴 반응 시간 후에 우선적으로 Z-비닐릭셀레니드를 제공한다. 높은 온도에서 반응이 더 빠르지만, Z-와 E-vinylic selenides의 혼합은 거의 1:1 비율로 얻어졌다.[21] 반면, 인덕트는 3중 결합에서 대체물의 성질에 따라 달라진다. 반대로, Vinylic selenide는 좋은 수확량으로 마르코브니코프 유도체를 공급할 수 있도록 팔라듐 분석 알키네스의 하이드로셀렌화에 의해 준비될 수 있다. 위에 설명된 빈니클 셀레니드를 준비하기 위한 방법론에는 몇 가지 한계가 있다; 기술된 절차들은 휘발성이 있고 불안정하며 불쾌한 냄새를 가진 시작 재료로 디오르고일 이질화 또는 셀레노페놀을 채택한다. 또한 이러한 화합물의 준비는 복잡하다.
셀레노산화
이산화 셀레늄은 유기 산화에 유용하다. 구체적으로, SeO는2 동맹인 메틸렌 그룹을 해당 알코올로 변환할 것이다. 많은 다른 시약들이 이런 반응을 일으킨다.
반응 메커니즘 측면에서 SeO와2 아군 기질은 C-H 결합을 활성화하는 ene 반응으로 시작하는 순환 과정을 통해 반응한다. 두 번째 단계는 [2,3] 시그마방성 반응이다. 셀레늄 이산화물과 관련된 산화는 셀레늄 화합물의 촉매 양과 과산화수소와 같은 희생 촉매나 공동 산화제가 있는 곳에서 종종 수행된다.
SeO 기반2 산화는 때때로 1,2-사이클로헥사네디온에 케톤, [22]β-피넨[23], 사이클로헥사논 산화와 같은 카보닐 화합물을 제공한다.[24] α-메틸렌 그룹이 있는 케톤은 디케톤을 함유하고 있다. 셀레늄 산화물과의 이런 종류의 산화를 라일리 산화로 부른다.[25]
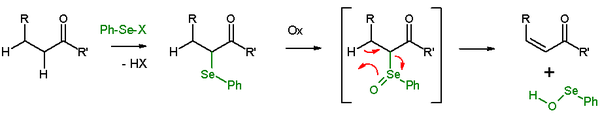
셀레노산화 제거
β-수소 존재에서는 셀레니드가 산화 후 제거 반응을 일으켜 알켄과 SeO-셀레노페로콜을 남긴다. SEO-selenoperoxol은 반응성이 매우 높으며 그렇게 고립되지 않는다. 제거반응에서는 참여 반응센터 5개 모두 코플라(coplanar)이므로 반응 입체화학이 일치한다. 사용되는 산화제는 과산화수소, 오존 또는 MCPBA이다. 이 반응형은 에논으로 이어지는 케톤과 함께 자주 사용된다. 벤젠젤레닐염염소이드와 하이드라이드 나트륨을 이용한 아세틸사이클로헥사논 제거가 그 예다.[26]
그리코 제거는 o-니트로페닐셀레노시아네이트와 트리뷰틸인산염을 사용하여 HO의2 원소를 제거하는 유사한 셀렌산화 제거다.
참조
- ^ A. Krief, L. Hebesi, Organoselenium Chemical I. 기능 그룹 변환, 스프링거, 베를린, 1988 ISBN3-540-18629-8
- ^ S. 파타이, Z. 라포포트 (Eds.) 유기농 셀레늄과 텔루륨 화합물의 화학, 존. 와일리 앤 선즈, 치체스터 1986년 ISBN 0-471-90425-2
- ^ Paulmier, C. 셀레늄 시약 및 유기합성 매개체; 볼드윈, J. E. Ed.; 페르가몬 북스 Ltd.: 뉴욕, 1986 ISBN 0-08-032484-3
- ^ Wallschläger, D.; Feldmann, F. (2010). Formation, Occurrence, Significance, and Analysis of Organoselenium and Organotellurium Compounds in the Environment. Metal Ions in Life Sciences. Vol. 7, Organometallics in Environment and Toxicology. RSC Publishing. pp. 319–364. ISBN 978-1-84755-177-1.
- ^ Löwig, C. J. (1836). "Ueber schwefelwasserstoff—und selenwasserstoffäther" [About hydrogen sulfide and selenium hydrogen ether]. Annalen der Physik. 37 (3): 550–553. Bibcode:1836AnP...113..550L. doi:10.1002/andp.18361130315.
- ^ a b Mukherjee, Anna J.; Zade, Sanjio S.; Singh, Harkesh B.; Sunoj, Raghavan B. (2010). "Organoselenium Chemistry: Role of Intramolecular Interactions". Chemical Reviews. 110 (7): 4357–4416. doi:10.1021/cr900352j. PMID 20384363.
- ^ 유기합성체, 콜. 제3권, 제771권(1955); 제24권, 제89권(1944) 온라인 기사.
- ^ 유기합성체, 콜. 제6권, 페이지 533 (1988); 제59권, 페이지 141 (1979) 조항
- ^ 고밸런트 화합물의 화학적 특성 연구
- ^ 합성 및 의약생물학에서 실용적 중요성을 갖는 셀레나체크로시크 화합물의 화학적 연관성 개발 2006년 제이스크 음워초스키, 크리스티안 클록, 라파우 리시아크, 피오트르 포타체크, 할리나 보우토비치
- ^ Okazaki, R.; Tokitoh, N. (2000). "Heavy ketones, the heavier element congeners of a ketone". Accounts of Chemical Research. 33 (9): 625–630. doi:10.1021/ar980073b. PMID 10995200.
- ^ Amouri, H.; Moussa, J.; Renfrew, A. K.; Dyson, P. J.; Rager, M. N.; Chamoreau, L.-M. (2010). "Discovery, Structure, and Anticancer Activity of an Iridium Complex of Diselenobenzoquinone". Angewandte Chemie International Edition. 49 (41): 7530–7533. doi:10.1002/anie.201002532. PMID 20602399.
- ^ Block, E. (2010). Garlic and Other Alliums: The Lore and the Science. Royal Society of Chemistry. ISBN 978-0-85404-190-9.
- ^ Axley, M.J.; Böck, A.; Stadtman, T.C. (1991). "Catalytic properties of an Escherichia coli formate dehydrogenase mutant in which sulfur replaces selenium". Proc. Natl. Acad. Sci. U.S.A. 88 (19): 8450–8454. Bibcode:1991PNAS...88.8450A. doi:10.1073/pnas.88.19.8450. PMC 52526. PMID 1924303.
- ^ Papp, L.V.; Lu, J.; Holmgren, A.; Khanna, K.K. (2007). "From selenium to selenoproteins: synthesis, identity, and their role in human health". Antioxidants & Redox Signaling. 9 (7): 775–806. doi:10.1089/ars.2007.1528. PMID 17508906.
- ^ Comasseto, João Valdir; Ling, Lo Wai; Petragnani, Nicola; Stefani, Helio Alexandre (1997). "Vinylic Selenides and Tellurides - Preparation, Reactivity and Synthetic Applications". Synthesis. 1997 (4): 373. doi:10.1055/s-1997-1210.
- ^ Comasseto, J (1983). "Vinylic selenides". Journal of Organometallic Chemistry. 253 (2): 131–181. doi:10.1016/0022-328X(83)80118-1.
- ^ Zeni, Gilson; Stracke, Marcelo P.; Nogueira, Cristina W.; Braga, Antonio L.; Menezes, Paulo H.; Stefani, Helio A. (2004). "Hydroselenation of Alkynes by Lithium Butylselenolate: an Approach in the Synthesis of Vinylic Selenides". Organic Letters. 6 (7): 1135–8. doi:10.1021/ol0498904. PMID 15040741.
- ^ Dabdoub, M (2001). "Synthesis of (Z)-1-phenylseleno-1,4-diorganyl-1-buten-3-ynes: hydroselenation of symmetrical and unsymmetrical 1,4-diorganyl-1,3-butadiynes". Tetrahedron. 57 (20): 4271–4276. doi:10.1016/S0040-4020(01)00337-4.
- ^ Doregobarros, O; Lang, E; Deoliveira, C; Peppe, C; Zeni, G (2002). "Indium(I) iodide-mediated chemio-, regio-, and stereoselective hydroselenation of 2-alkyn-1-ol derivatives". Tetrahedron Letters. 43 (44): 7921. doi:10.1016/S0040-4039(02)01904-4.
- ^ Comasseto, J (1981). "Stereoselective synthesis of vinylic selenides". Journal of Organometallic Chemistry. 216 (3): 287–294. doi:10.1016/S0022-328X(00)85812-X.
- ^ 유기 합성 콜. 제9권, 페이지 396 (1998); 제7권, 페이지 181 (1993) 온라인 기사 웨이백 기계에 2005-10-24 보관
- ^ 유기 합성 콜. 제6권, 페이지 946 (1988); 제56권, 페이지 25 (1977) 온라인 기사 Wayback Machine에 2005-11-01 보관
- ^ 유기합성체, 콜. 제4권, 제229권(1963년), 제32권, 제35권(1952년). 온라인 기사 Wayback Machine에 2005-11-27 보관
- ^ Riley, Harry Lister; Morley, John Frederick; Friend, Norman Alfred Child (1932). "255. Selenium dioxide, a new oxidising agent. Part I. Its reaction with aldehydes and ketones". Journal of the Chemical Society (Resumed): 1875. doi:10.1039/JR9320001875.
- ^ 유기 합성 콜. 제6권, 페이지 23 (1988); 제59권, 페이지 58 (1979) 온라인 기사