불소화 스칸듐
Scandium fluoride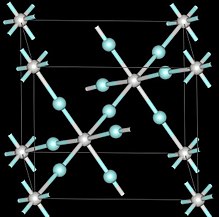 | |
| 이름 | |
|---|---|
| IUPAC 이름 스칸듐(III) 불소화 | |
| 기타 이름 삼불화 스칸디움 | |
| 식별자 | |
3D 모델(JSmol) | |
| ECHA InfoCard | 100.033.854 |
| EC 번호 |
|
펍켐 CID | |
| RTECS 번호 |
|
CompTox 대시보드 (EPA) | |
| |
| |
| 특성. | |
| SCF3 | |
| 어금질량 | 101.95112 g/190 |
| 외관 | 밝은 백색 가루 |
| 밀도 | 2.53 g/cm3 |
| 녹는점 | 1,552 °C(2,826 °F, 1,825 K)[2] |
| 비등점 | 1,607°C(2,925°F, 1,880K)[2] |
용해성 제품(Ksp) | 5.81×10−24[1] |
| 구조 | |
| 큐빅, Pm3m | |
| 221번 Pm3m | |
| 위험 | |
| NFPA 704(화재 다이아몬드) | |
| 관련 화합물 | |
기타 음이온 | 염화 스칸듐(III) 스칸듐(III)브로마이드 스칸듐(III) 요오드화합물 |
기타 양이온 | 이트리움(III) 불소화 란타넘(III)불소화효소 루테튬()III) 플루오르화 |
관련 화합물 | 질산 스칸듐(III) |
달리 명시된 경우를 제외하고, 표준 상태(25°C [77°F], 100 kPa)의 재료에 대한 데이터가 제공된다. | |
| Infobox 참조 자료 | |
스칸듐(III) 플루오르화, ScF는3 이온 화합물이다.이 소금은 물에 약간 용해되지만 과도한 불소가 있는 곳에서 용해되어 ScF63− 음이온이 형성된다.[2]
생산
ScF는3 스칸듐과 불소를 반응시켜 만들 수 있다.[3]또한 높은 온도에서 분플루오린화 암모늄과 ScO의23 반응에 의해 토르트베이트 광석에서 추출하는 동안 형성된다.[4]
- Sc2O3 + 6 NH4HF2 → 2 ScF3 + 6 NH4F + 3 H2O
그 결과로 생긴 혼합물은 많은 양의 금속 불소를 함유하고 있으며 이것은 고온에서 칼슘 금속과 반응하여 감소한다.[4]사용 가능한 금속 스칸듐을 생산하려면 추가적인 정화 단계가 필요하다.[4]
특성.
스칸듐 삼불화물은 음의 열팽창이라는 특이한 성질을 보이는데, 이는 열을 가하면 수축한다는 것을 의미한다.이 현상은 불소 이온의 사중진동에 의해 설명된다.불소이온의 휨 변형률에 저장된 에너지는 변위의 제곱에 비례하는 대부분의 다른 물질과 달리 변위 각도의 4번째 힘에 비례한다.불소 원자는 두 개의 스칸듐 원자에 결합되어 있으며, 온도가 증가함에 따라 불소는 그것의 결합에 더 수직으로 진동한다.이 동작은 스칸듐 원자를 벌크 물질 전체에 함께 끌어들이고, 이것은 수축한다.[5]ScF는3 최소 10K에서 최소 1100K까지 이 특성을 보이며, 이 성질은 정상적인 양의 열팽창을 보여준다. 더욱이 재료는 이 전체 온도 범위에서 입방 대칭이며, 주변 압력에서는 최소 1600K까지이다.매우 낮은 온도에서 음의 열팽창은 상당히 강하다(60~110K 사이 -14ppm/K 부근의 열팽창 효율).[6]
외부 압력에서 삼불화산 스칸듐은 하나의 금속 위치가 비어 있는 페로브스카이트 구조를 사용하여 입방 결정 시스템을 채택한다.[7]단위 세포 치수는 4.01 å이다.[7] 압력 하의 스칸듐 3플루오라이드 또한 림보헤드랄과 3 GPA 사면체 이상의 서로 다른 결정 구조를 형성한다.[7]
참조
- ^ John Rumble (June 18, 2018). CRC Handbook of Chemistry and Physics (99 ed.). CRC Press. pp. 5–189. ISBN 1138561630.
- ^ a b c 에곤 위버그, 아놀드 프레데릭 홀레만(2001) 무기화학, 엘스비에, ISBN 0-12-352651-5.
- ^ S.A.Cotton, Scandium, Yttrium 및 Lantanides:무기화학, 무기화학 백과사전, 1994, 존 와일리 & 선스, ISBN 0-471-93620-0.
- ^ a b c Pradyot Patnaik, 2003, McGraw-Hill Professional, ISBN 0-07-049439-8.
- ^ Woo, Marcus (7 November 2011). "An incredible shrinking material: Engineers reveal how scandium trifluoride contracts with heat". Physorg. Retrieved 8 November 2011.
- ^ Greve, Benjamin K.; Kenneth L. Martin; Peter L. Lee; Peter J. Chupas; Karena W. Chapman; Angus P. Wilkinson (19 October 2010). "Pronounced Negative Thermal Expansion from a Simple Structure: Cubic ScF3". Journal of the American Chemical Society. 132 (44): 15496–15498. doi:10.1021/ja106711v. PMID 20958035.
- ^ a b c Aleksandrov, K. S.; V. N. Voronov; A. N. Vtyurin; A. S. Krylov; M. S. Molokeev; M. S. Pavlovskiĭ; S. V. Goryaĭnov; A. Yu. Likhacheva; A. I. Ancharov (2009). "Pressure-induced phase transition in the cubic ScF3 crystal". Physics of the Solid State. 51 (4): 810–816. doi:10.1134/S1063783409040295. ISSN 1063-7834. S2CID 119874020.