폴리티오페인
Polythiophene
폴리시오페네스(PT)는 중합된 티오페네스, 즉 유황 이성질체다.상위 PT는 공식(CHS42)과 함께 불용성 컬러 고형분이다.n[2][3][4]그 고리들은 2-와 5-포즈로 연결되어 있다.폴리(alkylthiophene)는 3-4 위치에 알킬 대체물을 가지고 있다.또한 색깔의 고체지만 유기 용매에 용해되는 경향이 있다.
PT는 산화되면 전도성이 된다.전기 전도성은 폴리머 백본을 따라 전자의 소산화에 기인한다.그러나 전도성만이 전자 소산화에 기인하는 흥미로운 성질은 아니다.이러한 물질의 광학적 특성은 용매, 온도, 도포 전위, 다른 분자에 대한 결합의 변화에 반응하여 극적인 색 이동과 함께 환경 자극에 반응한다.색과 전도성 모두의 변화는 동일한 메커니즘에 의해 유도되며, 폴리머 백본의 비틀림과 결합을 방해하여 결합 폴리머가 광학 및 전자적 반응의 범위를 제공할 수 있는 센서로서 매력을 느끼게 한다.[5][6][7]
폴리시오페네스와 관련 전도성 유기성 고분자의 개발은 2000년 노벨 화학상을 앨런 J에게 수여함으로써 인정받았다. 히거, 앨런 맥디아미드, 시라카와 히데키 「전도성 폴리머의 발견·개발을 위해서」.
전도성과 도핑의 메커니즘
PT는 일반적인 유기 중합체로 대부분의 용매에서 용해성이 떨어지는 적색 고형분이다.[8]그러나 산화제(전기-수용체)로 처리하면 소재가 어두운 색을 띠어 전기 전도성이 된다.산화는 "도핑"이라고 불린다.PT(및 다른 전도성 폴리머)를 최적으로 전도성 상태로 변환하기 위해 약 0.2의 산화제가 사용된다.[citation needed]따라서 고리 5개당 1개 정도가 산화된다.많은 다양한 산화제가 사용된다.리독스 반응 때문에 폴리티오페네의 전도성 형태는 소금이다.이상적인 스토이치측정법은 산화제[A]를 사용하여 보여진다.PF6:
- (CHS42)n + 1/5n [A]PF6 → (CHS42)(nPF)60.2n + 1/5nA
원칙적으로 PT는 환원제를 사용해 n-도핑할 수 있지만 이런 방식은 거의 실천되지 않는다.[9]
"p-doping"에 따라, bipolaron이라고 불리는 충전된 유닛이 형성된다.비폴라론은 폴리머 체인을 따라 하나의 단위로 움직이며 물질의 거시적으로 관측된 전도성을 담당한다.전도도는 1000 S/cm에 이를 수 있다.[10]이에 비해 구리의 전도도는 약 5×105 S/cm이다.일반적으로 PT의 전도도는 1000S/cm 미만이지만, 항정제 필름처럼 많은 용도에 높은 전도도가 필요하지 않다.
산화제
PT를 복용하기 위해 다양한 시약이 사용되어 왔다.요오드와 브롬은 전도성이 높은 물질을 생성하는데 [10]할로겐의 느린 증발 때문에 불안정하다.[11]3불화탄산, 프로피온산, 설폰산을 포함한 유기산은 요오드보다 전도성은 낮지만 환경 안정성은 높은 PT를 생산한다.[11][12]매트릭스 보조 레이저 탈착/이온화 질량분석(MALDI-MS) 연구에 따르면 폴리(3-헥실티오페네)도 잔류 산화제에 의해 부분적으로 할로겐화된다.[13][14]톨루엔에 용해된 폴리(3-옥틸thiophene)는 아세토나이트릴에 용해된 철염화 6수화물 용액에 의해 도핑될 수 있으며, 1 S/cm에 이르는 전도성을 가진 필름에 주조될 수 있다.[15]다른, 덜 흔한 p-dopant로는 금 3ichloride와[16] trifluoromethanesulfonic acid를 포함한다.[17]
구조 및 광학 특성
결합 길이
결합된 PT의 확장된 π 시스템은 이러한 재료의 가장 흥미로운 특성들 중 몇 가지, 즉 광학적 특성을 생산한다.근사치로서, 결합 백본은 슈뢰딩거 방정식에 대한 "전자-인-a-box" 솔루션의 실제 사례로 간주할 수 있지만, 잘 정의된 올리고(티오페인) 시스템의 흡수 및 형광 스펙트럼을 정확하게 예측하기 위한 정제된 모델의 개발이 진행 중이다.[18]결합은 방향족 고리의 π-orbitals의 겹침에 의존하며, 이는 다시 티오페인 고리가 공동행렬이어야 함을 요구한다.
동시 발생 링의 수는 결합 길이를 결정한다. 결합 길이가 길수록 인접 에너지 수준 사이의 분리가 낮고 흡수 파장이 길다.동일 평면성으로부터의 편차는 합성 중 잘못 연결되거나 특히 부피가 큰 사이드 체인에서 기인하는 영구적인 것일 수 있으며, 환경 변화나 결합에 기인하는 일시적일 수 있다.등뼈의 이 비틀림은 결합 길이를 줄이고 에너지 수준 사이의 분리를 증가시킨다.이렇게 되면 흡수 파장이 짧아진다.
최대 유효 결합 길이를 결정하려면 정의된 길이의 레지오그래픽 PT 합성이 필요하다.가시 영역의 흡수 밴드는 결합 길이가 증가함에 따라 점점 적색 변형이 되며, 최대 유효 결합 길이는 적색 변형의 포화점으로 계산된다.10개의 Hoeve 외 연구진들에 의한 초기 연구는 유효 결합이 11개의 반복 단위로 확장되었다고 추정했고,[19] 이후 연구들은 이 추정치를 20개로 증가시켰다.[20]로렌스 외 연구진은 중합과 분리를 통해 준비된 이산결합올리고(3-헥실티오페네)의 흡광도와 방출 프로파일을 이용하여 폴리(3-헥실티오페네)의 유효 결합 길이를 14단위로 결정했다.[21]폴리시오페네 유도체의 유효 결합 길이는 사이드 체인,[22] 티오페네 등뼈의 화학 구조에 따라 달라진다.[23]
다양한 환경 요인으로 인해 결합 백본의 비틀림이 일어나 결합 길이를 줄이고 용매, 온도, 전기장 도포, 용해 이온을 포함한 흡수 밴드 이동을 유발할 수 있다.[citation needed]PVA(폴리닐 알코올) 수용액에서 폴리(3-티오페인 아세트산)의 흡수 밴드는 pH 7에서 480 nm에서 pH 4에서 415 nm로 변화한다.이는 아세트산 그룹의 부분 디프로톤화 시 PVA로 수소 결합을 형성할 수 있는 콤팩트 코일 구조가 형성됐기 때문으로 풀이된다.[24]
낮은 온도에서 로드와 같은 공동선 구조에서 높은 온도에서 비 평면 코일 구조로 일관적인 전환으로 인한 온도 변화로 인한 PT 흡수 대역의 이동.예를 들어 폴리(3-(옥티록시)-4-메틸티오페네)는 25°C에서 150°C에서 옅은 노란색으로 색 변화가 일어난다.등축 지점(모든 온도에서 흡광도 곡선이 겹치는 지점)은 동일한 체인 또는 다른 체인에 존재할 수 있는 두 단계 사이의 공존을 나타낸다.[25]모든 열색 PT가 이등변성 포인트를 나타내는 것은 아니다: 높은 섭색성 폴리(3-alkylthiophene) (PATs)는 사이드 체인이 충분히 짧아서 낮은 온도에서 녹지 않고 결정과 불순 위상 사이에 상호 변환되지 않을 경우 온도가 증가하면서 연속적인 청색 이동을 나타낸다.[citation needed]
광학 효과
PT의 광학적 특성은 많은 요인에 민감할 수 있다.PT는 전위(전위색증)[26]의 적용이나 알칼리 이온(이온색증)의 도입에 의한 흡수 이동을 나타낸다.[27]수용성 PAT는 클로로포름과 2,5-디메틸트릴트라하이드로푸란에서 열색소와 솔바토크롬(위 참조)을 모두 나타낸다.[28]
대체 폴리시오페네스
폴리시오페인과 그 산화 유도체는 처리 특성이 좋지 않다.그것들은 일반 용매에서 용해되지 않고 쉽게 녹지 않는다.예를 들어 도핑되지 않은 PT는 비소 3불화합물, 비소 5불화합물과 같은 이국적인 용제만 사용할 수 있다.[29]비록 처리가 서툴지만, "예상된 고온의 안정성과 잠재적으로 매우 높은 PT필름의 전기 전도성이 (만들었을 경우) 여전히 매우 바람직한 소재가 되고 있다."[30]그럼에도 불구하고, 강한 관심은 용해성 폴리티오페네스에 집중되어 왔는데, 이것은 보통 소위 폴리알킬티오페네(PATs)를 주는 3알킬키릴티오페네에서 파생된 폴리머로 번역된다.
3-알킬티오페네스
가용성 폴리머는 3-대체 티오페네에서 파생되며, 여기서 3-대체제가 부틸 또는 그 이상이다.복합체는 폴리(3-메틸티오페네-'co'-3'-옥틸티오페네)[30]와 같은 용해성 물질도 있다.
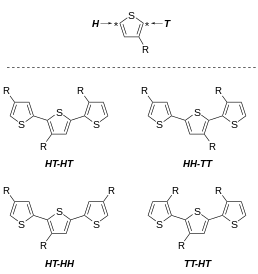
3-알킬티오페네스의 바람직하지 않은 특징 중 하나는 폴리머의 가변 레지오레규얼리티다.다이애드 레벨의 중합체 마이크로 구조에 초점을 맞춰 3대체 티오페네스는 세 다이애드 중 하나를 결합할 수 있다.
- 2,5' 또는 머리-꼬리(HT), 커플링
- 2,2' 또는 헤드 헤드(HH), 커플링
- 5,5' 또는 테일테일(TT), 커플링
이 세 개의 디아드는 네 개의 뚜렷한 트라이애드로 결합될 수 있다.3종류는 NMR 분광법으로 구별할 수 있다.[31][32]
레지오레규얼리티는 PT의 특성에 영향을 미친다.3-메틸티오페인과 3-부틸티오페인의 레지오랜덤 복합체는 50S/cm의 전도성을 가지고 있는 반면, HT 대 HH 커플링의 2:1 비율의 레지오렐라 복합체는 140S/cm의 전도성을 가지고 있었다.[33]정규 POPT의 경우 0.4 S/cm에 비해 HT 함량이 94% 이상인 레지오레겔 폴리(3-(4-옥틸페닐) 티오페네) 필름(POPT)은 4 S/cm의 전도성을 가지고 있었다.[34] 리에케 아연을 사용하여 준비한 PAT는 "크리스탈린, 신축성, 청동색 필름"을 형성했다.반면 해당 레지오란돔 폴리머는 '아모르퍼스, 오렌지색 필름'[35]을 제작했다.리케 PATs의 열색소 특성을 비교한 결과, 레지오그래픽 폴리머는 강한 열색소 효과를 보였지만 레지오그래픽 폴리머의 흡광도 스펙트럼은 상승된 온도에서 크게 변화하지 않았다.마지막으로, 폴리(3-헥실티오페네)의 형광 흡수 및 방출 최대치는 HH 다이오드 함량이 증가하면서 점점 더 낮은 파장(높은 에너지)에서 발생한다.흡수율과 방출량 최대값의 차이인 스톡스 시프트도 HH 다이나드 함량에 따라 증가하는데, 이는 첫 흥분 상태에서 순응적인 변형으로부터 더 큰 완화가 이루어졌기 때문이다.[36]
특수 대체품
수용성 PT는 폴리 나트륨(3-thiophenealkanesulfonate)으로 표현된다.[37]물 용해성을 부여할 뿐만 아니라, 펜던트 설폰산염 그룹이 대항 작용을 하여 자가 도핑 전도성 폴리머를 생성한다.테더로 연결된 카르복실산으로 대체된 PT도 용해성을 나타낸다.[38][39][40]요도[41] 및 요도
3개 위치에 치랄 대체물이 있는 티오페네들이 중합되었다.그러한 치랄 PT는 원칙적으로 치랄 분석물의 검출 또는 분리에 사용할 수 있다.[42]
폴리(3-(perfluoroctyl)thiophene)는 용액에서 필름으로 발열성 알킬 에스테르와 함께 양끝에 덮인 초임계[43][44] 이산화탄소 올리고티오페네스에 용해된다.원자력 현미경(AFM) 영상은 가열 후 장거리 순서가 크게 증가하는 것으로 나타났다.[45]
불소 폴리시오페인은 폴리머풀렌 태양전지에서 7%의 효율을 낸다.[46]
페도트
에틸렌디옥시티오페인(EDOT)이라 불리는 3,4분산 티오페인은 폴리머 PEDOT의 전구체다.이 모노머는 대칭적이기 때문에 레지화학은 문제가 되지 않는다.PEDOT는 전자크롬 디스플레이, 태양광, 전기 발광 디스플레이, 인쇄 배선 및 센서에서 찾을 수 있다.[47]
합성
전기화학합성
전기화학 중합에서 티오페인과 전해질을 함유한 용액은 양극에 전도성 PT 필름을 생성한다.[30]전기화학 중합은 폴리머를 분리·정화시킬 필요가 없어 편리하지만 바람직하지 않은 알파-베타 연계와 다양한 수준의 레지오르겔러리를 가진 폴리머를 생산할 수 있다.전기집합화의 정지계측법은 다음과 같다.
- n CHS44 → (CHS42)n + 2n H+ + 2n− e
중합성의 정도와 결과 고분자의 품질은 전극 물질, 전류 밀도, 온도, 용제, 전해질, 물의 존재, 단량체 농도에 따라 달라진다.[48]
전자 기부 대체물은 산화 전위를 낮추는 반면 전자 밀기 그룹은 산화 전위를 증가시킨다.Thus, 3-methylthiophene polymerizes in acetonitrile and tetrabutylammonium tetrafluoroborate at a potential of about 1.5 V vs. SCE, whereas unsubstituted thiophene requires an additional 0.2 V. Steric hindrance resulting from branching at the α-carbon of a 3-substituted thiophene inhibits polymerization.[49]
메커니즘 면에서 티오페인 단층체의 산화는 급진적인 양이온을 생성하며, 그 후 다른 단층체와 결합하여 급진적인 양이온 다이머를 생성한다.
브로모티오페네스로부터
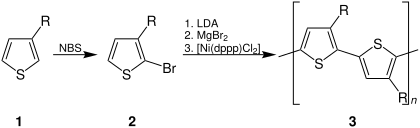
화학 합성은 PT의 전기화학 합성에 비해 두 가지 장점을 제공한다. 즉, 모노머의 선택 범위가 넓어지고 적절한 촉매제를 사용하여 완벽하게 레지오그래픽 대체 PT를 합성할 수 있다.PT는 한 세기 전에 우연히 화학적으로 합성되었다.[50]쿠마다 커플링과 관련 반응을[51][52] 이용한 2,5디브로모티오페네의 화학합성
레지오레굴러 PT는 쿠마다 크로스커플링을 이용해 2-브로모-3-알킬티오페네스를 석션해 준비했다.[53]이 방법은 약 100% HT–를 산출한다.HT 커플링은, 다이애드의 NMR 분광 분석법에 따르면, 고반응성 "리케 아연"으로 처리했을 때 2,5-디브로모-3-알킬티오펜이 대안적인 방법이다.[54][55]
화학 산화제를 사용하는 경로
브롬화 모노머를 필요로 하는 방법과는 대조적으로 철염화물을 이용한 티오페네스의 산화 중합은 상온에서 진행된다.이 접근방식은 1986년 스기모토 외 연구진에 의해 보고되었다.[56]스토이치측정법은 전기합성화법과 유사하다.
이 방법은 매우 인기 있는 것으로 입증되었다; 항정제 코팅은 철 염화물을 이용하여 상업적인 규모로 준비된다.철염화제 외에 다른 산화제가 보고된 바 있다.[30]H–T 함량이 약 94%인 폴리(3-(4-옥틸페닐)티오페네)를 모노머 용액에 천천히 첨가했다.[34](촉매의 표면적을 최대화하기 위해) 현장에서 철 염화물의 강수는 결정 촉매에 모노머를 직접 추가하는 것보다 훨씬 더 높은 수율과 단량 변환을 생성했다.[57][58]중합 과정에서 건조한 공기가 반응 혼합물을 통해 거품이 일 때 더 높은 분자량이 보고되었다.[30]극성용매로 중합한 후의 배기삭슬릿 추출은 NMR 분광 전에 폴리머를 효과적으로 분할하고 잔류 촉매를 제거하는 것으로 조사되었다.[31]촉매 대 모노머의 낮은 비율(4:1)을 사용하면 폴리(3-dodecylthiophene)의 레지오르겔도를 증가시킬 수 있다.[59]안드레이니 외 연구진은 클로로포름보다 카본 테트라클로라이드에서 용해성 폴리(대칭성 폴리)의 생산량이 더 높다고 보고했는데, 이는 카본 테트라클로라이드에서 급진적인 종의 안정성에 기인했다.[60]저속 및 저온에서 첨가된 고품질 촉매는 불용성 고분자 잔류물이 없는 고분자중량 PAT를 생성하는 것으로 나타났다.[61]요인 실험은 촉매/모노머 비율이 폴리(3-옥틸티오페인)의 수율 증가와 상관관계가 있음을 나타낸다.중합 시간이 길어진 것도 수율을 높였다.[62]
메카니즘 측면에서 철염화물을 이용한 산화중합화, 즉 급진적인 경로가 제시되었다.니에미(알. 그 중합만을 그 촉매 또는 일부 완전히 해결할 수 없는(클로로포름, 톨루엔, 사염화 탄소, 펜탄, 헥산은 아니며, 디에틸 에테르, 자일렌, 아세톤, 또는 개미의 산성)솔벤트에서 관찰되었다, 중합 고체 염화제 이철의 표면에서 발생할 것으로 추측했다 보도했다.[63]그러나 FeCl이3 수용성 있는 아세토나이트릴에서도 반응이 진행된다는 점에서 이 점은 도전적이다.[64]양자역학적 계산도 급진적인 메커니즘을 가리킨다.이 메커니즘은 [3-메틸티오페인]+의 C2가 스핀 밀도가 가장 높기 때문에 3-메틸티오페인의 조광화의 레지화학에서도 유추할 수 있다.
탄수화물 메커니즘은 철 염화물로부터 제조된 3-(4-옥틸페닐)thiophene의 구조로부터 유추된다.[34]
티오페인의 중합은 아세토나이트릴에 있는 철염화 용액에 의해 영향을 받을 수 있다.티오페네 중합체의 운동학도 급진적 중합 메커니즘의 예측과 모순되는 것처럼 보였다.[64]바르바렐라 외 연구진은 3-(alkylsulfanyl)thiophenes의 과점화를 연구했고, 양자역학적 계산과 평면 결합의 올리고머에 대해 분석했을 때 급진적 양이온의 안정성 향상에 대한 고려로부터 결론을 내렸는데, 이는 전기화학 폴리머에 일반적으로 수용되는 것과 유사한 급진적 양이온 메커니즘이다.침식이 더 가능했다.[65]강성 로드 폴리머의 특성화가 어려운 이질적이고 강한 산화 촉매를 가진 시스템을 연구해야 하는 어려움을 감안할 때 산화 중합체의 메커니즘은 결코 결정되지 않는다.과격한 양이온 메커니즘은 일반적으로 받아들여진다.
적용들
정적 도포 예로서 헤레이우스의 폴리(3,4-ethylenedioxythiophene)-폴리(styrene sulfonate) 제품(PEDOT-PSS) 제품("Clevios P")이 항정성 코팅(예를 들면 전자부품의 포장재로)으로 널리 사용되어 왔다.AGFA는 연간 200m × 10m의 사진 필름을 PEDOT로 코팅한다.PSS는 그것의 반정체적 특성 때문이다.PEDOT의 얇은 층:PSS는 사실상 투명하고 무색이며, 필름 재결합 시 정전기 방전을 방지하고, 처리 후 음극의 먼지 축적을 감소시킨다.[47]
제안된 애플리케이션
PEDOT는 또한 폴리머 필름에 전위가 적용되는 동적 용도에 대해 제안되었다.PEDOT 코팅된 창과 거울은 불투명해지거나 전자크롬 성질의 표시인 전위 도포에 반사된다.[26]전자크롬 창문을 널리 채택함으로써 에어컨 비용을 크게 절감할 수 있다.[66]
또 다른 잠재적 적용 분야로는 현장 효과 트랜지스터, [67]전기 발광 장치, 태양 전지, 광화학 저항기, 비선형 광학 장치,[68] 배터리, 다이오드 및 화학 센서가 있다.[69]일반적으로 중합체 전도에는 두 가지 범주의 용도가 제안된다.정적 용도는 중합체 재료에 공통되는 재료의 가공 및 재료 특성과 결합하여 재료의 내적 전도성에 의존한다.동적 애플리케이션은 전도성 및 광학적 성질의 변화를 활용하는데, 이는 전위적 적용이나 환경 자극에서 기인한다.
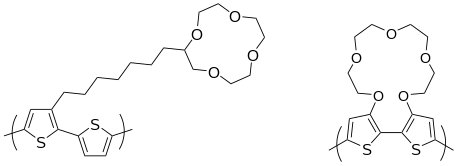
PT는 센서 요소로 선전되어 왔다.PT는 바이오센서 응용 외에도 금속 이온이나 치랄 분자를 검출하기 위한 수용기로도 기능화할 수 있다.펜던트 크라운 에테르 기능이 있는 PT는 알칼리 금속에 따라 다른 특성을 보인다.[70]그리고 메인 체인.[27]
폴리시오페네스는 프리온 질환 치료에 잠재력을 보인다.[71]
추가 읽기
- 전도성 폴리머 핸드북(Eds: T. A. Skotheim, R. L. Elsenbaumer, J. R. R. Reynolds), Marcel Dekker, 1998년 뉴욕. ISBN0-8247-0050-3
- G. Schopf, G. Koßmehl, Polythiophenes: 전기 전도성 폴리머, 1997년 베를린 스프링거, ISBN 3-540-61483-4; ISBN 0-387-61483-4
- 합성 금속(저널).ISSN 0379-6779
- Street, G. B.; Clarke, T. C. (1981). "Conducting Polymers: A Review of Recent Work". IBM J. Res. Dev. 25: 51–57. doi:10.1147/rd.251.0051.
- Roncali, Jean (1992). "Conjugated poly(thiophenes): synthesis, functionalization, and applications". Chemical Reviews. 92 (4): 711–738. doi:10.1021/cr00012a009.
- Roncali, Jean (1997). "Synthetic Principles for Bandgap Control in Linear π-Conjugated Systems". Chemical Reviews. 97 (1): 173–206. doi:10.1021/cr950257t. PMID 11848868.
- Reddinger, J. L.; Reynolds, J. R. (1999). Molecular Engineering of p-Conjugated Polymers. Adv. Polym. Sci. Advances in Polymer Science. Vol. 145. pp. 57–122. doi:10.1007/3-540-70733-6_2. ISBN 978-3-540-65210-6.
참조
- ^ Arosio, Paolo; Moreno, Margherita; Famulari, Antonino; Raos, Guido; Catellani, Marinella; Valdo Meille, Stefano (2009). "Ordered Stacking of Regioregular Head-to-Tail Polyalkylthiophenes: Insights from the Crystal Structure of Form I′ Poly(3-n-butylthiophene)". Chem. Mater. 21 (1): 78–87. doi:10.1021/cm802168e.
- ^ 엄밀히 말하면, 폴리티오페인은 오노머로, 폴리머는 티에닐렌(2,5-CHS42) 반복 단위로 구성되기 때문이다.마찬가지로 티오페네는 그런 단조로운 존재가 아니다.
- ^ Tourillon, G.; Garnier, F. (April 1982). "New electrochemically generated organic conducting polymers". Journal of Electroanalytical Chemistry and Interfacial Electrochemistry. 135 (1): 173–178. doi:10.1016/0022-0728(82)90015-8.
- ^ Österholm, J.-E.; Passiniemi, P.; Isotalo, H.; Stubb, H. (February 1987). "Synthesis and properties of FeCl4-doped polythiophene". Synthetic Metals. 18 (1–3): 213–218. doi:10.1016/0379-6779(87)90881-2.
- ^ Nielsen, Christian B.; McCulloch, Iain (2013). "Recent advances in transistor performance of polythiophenes". Progress in Polymer Science. 38 (12): 2053–2069. doi:10.1016/j.progpolymsci.2013.05.003. hdl:10044/1/14442.
{{cite journal}}: CS1 maint: 작성자 매개변수 사용(링크) - ^ McQuade, D. Tyler; Pullen, Anthony E.; Swager, Timothy M. (2000). "Conjugated Polymer-Based Chemical Sensors". Chemical Reviews. 100 (7): 2537–74. doi:10.1021/cr9801014. PMID 11749295.
- ^ Mehmood, Umer; Al-Ahmed, Amir; Hussein, Ibnelwaleed A. (2016). "Review on recent advances in polythiophene based photovoltaic devices". Renewable & Sustainable Energy Reviews. 57: 550–561. doi:10.1016/j.rser.2015.12.177.
{{cite journal}}: CS1 maint: 작성자 매개변수 사용(링크) - ^ Kobayashi, M.; Chen, J.; Chung, T.-C.; Moraes, F.; Heeger, A.J.; Wudl, F. (January 1984). "Synthesis and properties of chemically coupled poly(thiophene)". Synthetic Metals. 9 (1): 77–86. doi:10.1016/0379-6779(84)90044-4.
- ^ Mastragostino, M.; Soddu, L. (1990). "Electrochemical characterization of "n" doped polyheterocyclic conducting polymers—I. Polybithiophene". Electrochimica Acta. 35 (2): 463. doi:10.1016/0013-4686(90)87029-2.
- ^ a b McCullough, Richard D.; Tristram-Nagle, Stephanie; Williams, Shawn P.; Lowe, Renae D.; Jayaraman, Manikandan (1993). "Self-orienting head-to-tail poly(3-alkylthiophenes): new insights on structure-property relationships in conducting polymers". Journal of the American Chemical Society. 115 (11): 4910. doi:10.1021/ja00064a070.
- ^ a b Loponen, M.; Taka, T.; Laakso, J.; Vakiparta, K.; Suuronen, K.; Valkeinen, P.; Osterholm, J. (1991). "Doping and dedoping processes in poly (3-alkylthiophenes)". Synthetic Metals. 41 (1–2): 479–484. doi:10.1016/0379-6779(91)91111-M.
- ^ Bartuš, Ján (1991). "Electrically Conducting Thiophene Polymers". Journal of Macromolecular Science, Part A. 28 (9): 917–924. doi:10.1080/00222339108054069.
- ^ Qiao, X.; Wang, Xianhong; Mo, Zhishen (2001). "The FeCl3-doped poly(3-alkyithiophenes) in solid state". Synthetic Metals. 122 (2): 449. doi:10.1016/S0379-6779(00)00587-7.
- ^ McCarley, Tracy Donovan; Noble; Dubois, C. J.; McCarley, Robin L. (2001). "MALDI-MS Evaluation of Poly(3-hexylthiophene) Synthesized by Chemical Oxidation with FeCl3". Macromolecules. 34 (23): 7999. doi:10.1021/ma002140z.
- ^ Heffner, G.; Pearson, D. (1991). "Solution processing of a doped conducting polymer". Synthetic Metals. 44 (3): 341. doi:10.1016/0379-6779(91)91821-Q.
- ^ S.a. Abdou, M.; Holdcroft, Steven (1993). "Oxidation of π-conjugated polymers with gold trichloride: enhanced stability of the electronically conducting state and electroless deposition of Au0". Synthetic Metals. 60 (2): 93. doi:10.1016/0379-6779(93)91226-R.
- ^ Rudge, Andy; Raistrick, Ian; Gottesfeld, Shimshon; Ferraris, John P. (1994). "A study of the electrochemical properties of conducting polymers for application in electrochemical capacitors". Electrochimica Acta. 39 (2): 273. doi:10.1016/0013-4686(94)80063-4.
- ^ 베슬러, H. "전자 흥분"전자 재료의 경우 올리고머 접근법; 뮐렌, K.; 웨그너, G. 에드;Wiley-VCH: 1998년 독일 웨인하임, ISBN 3-527-29438-4
- ^ Ten Hoeve, W.; Wynberg, H.; Havinga, E. E.; Meijer, E. W. (1991). "Substituted .. – undecithiophenes, the longest characterized oligothiophenes". Journal of the American Chemical Society. 113 (15): 5887. doi:10.1021/ja00015a067.
- ^ Meier, H.; Stalmach, U.; Kolshorn, H (September 1997). "Effective conjugation length and UV/vis spectra of oligomers". Acta Polymerica. 48 (9): 379–384. doi:10.1002/actp.1997.010480905.
- ^ Lawrence, Jimmy; Goto, Eisuke; Ren, Jing M.; McDearmon, Brenden; Kim, Dong Sub; Ochiai, Yuto; Clark, Paul G.; Laitar, David; Higashihara, Tomoya (2017-10-04). "A Versatile and Efficient Strategy to Discrete Conjugated Oligomers". Journal of the American Chemical Society. 139 (39): 13735–13739. doi:10.1021/jacs.7b05299. ISSN 0002-7863. PMID 28872865.
- ^ Nakanishi, Hidetaka; Sumi, Naoto; Aso, Yoshio; Otsubo, Tetsuo (1998). "Synthesis and Properties of the Longest Oligothiophenes: the Icosamer and Heptacosamer". The Journal of Organic Chemistry. 63 (24): 8632. doi:10.1021/jo981541y.
- ^ Izumi, Tsuyoshi; Kobashi, Seiji; Takimiya, Kazuo; Aso, Yoshio; Otsubo, Tetsuo (2003). "Synthesis and Spectroscopic Properties of a Series of β-Blocked Long Oligothiophenes up to the 96-mer: Revaluation of Effective Conjugation Length". Journal of the American Chemical Society. 125 (18): 5286–7. doi:10.1021/ja034333i. PMID 12720435.
- ^ De Souza, J.; Pereira, Ernesto C. (2001). "Luminescence of poly(3-thiopheneacetic acid) in alcohols and aqueous solutions of poly(vinyl alcohol)". Synthetic Metals. 118 (1–3): 167–170. doi:10.1016/S0379-6779(00)00453-7.
- ^ Roux, Claudine; Leclerc, Mario (1992). "Rod-to-coil transition in alkoxy-substituted polythiophenes". Macromolecules. 25 (8): 2141. doi:10.1021/ma00034a012.
- ^ a b H. W. Heuer; R. Wehrmann; S. Kirchmeyer (2002). "Electrochromic Window Based on Conducting Poly(3,4-ethylenedioxythiophene)-Poly(styrene sulfonate)". Advanced Functional Materials. 12 (2): 89. doi:10.1002/1616-3028(20020201)12:2<89::AID-ADFM89>3.0.CO;2-1.
- ^ a b Marsella, Michael J.; Swager, Timothy M. (1993). "Designing conducting polymer-based sensors: selective ionochromic response in crown ether-containing polythiophenes". Journal of the American Chemical Society. 115 (25): 12214. doi:10.1021/ja00078a090.
- ^ Rughooputh, S. D. D. V.; Hotta, S.; Heeger, A. J.; Wudl, F. (May 1987). "Chromism of soluble polythienylenes". Journal of Polymer Science B. 25 (5): 1071–1078. doi:10.1002/polb.1987.090250508.
- ^ Frommer, Jane E. (1986). "Conducting polymer solutions". Accounts of Chemical Research. 19: 2–9. doi:10.1021/ar00121a001.
- ^ a b c d e McCullough, Richard D. (1998). "The Chemistry of Conducting Polythiophenes". Advanced Materials. 10 (2): 93–116. doi:10.1002/(SICI)1521-4095(199801)10:2<93::AID-ADMA93>3.0.CO;2-F.
- ^ a b Barbarella, Giovanna; Bongini, Alessandro; Zambianchi, Massimo (1994). "Regiochemistry and Conformation of Poly(3-hexylthiophene) via the Synthesis and the Spectroscopic Characterization of the Model Configurational Triads". Macromolecules. 27 (11): 3039. doi:10.1021/ma00089a022.
- ^ Diaz-Quijada, G. A.; et al. (1996). "Regiochemical Analysis of Water Soluble Conductive Polymers: Sodium Poly(ω-(3-thienyl)alkanesulfonates)". Macromolecules. 29 (16): 5416. doi:10.1021/ma960126+.
- ^ 엘센바우머, R. L.; 젠, K.-Y.; 밀러, G.; 에크하르트, H.; 섀클렛, L. W.; 조우, R. "폴리(알킬시오페네스)와 폴리(대체 이질성비닐렌):다용도, 높은 전도성, 처리 가능한 폴리머(Tunable Properties)"결합 폴리머의 전자적 특성(Eds: Kuzmany, H.; Mehring, M.; Roth, S.), 스프링거, 1987, ISBN 0-387-18582-8
- ^ a b c Andersson, M. R.; Selse, D.; Berggren, M.; Jaervinen, H.; Hjertberg, T.; Inganaes, O.; Wennerstroem, O.; Oesterholm, J.-E. (1994). "Regioselective polymerization of 3-(4-octylphenyl)thiophene with FeCl3". Macromolecules. 27 (22): 6503. doi:10.1021/ma00100a039.
- ^ Chen, Tian-An; Wu, Xiaoming; Rieke, Reuben D. (1995). "Regiocontrolled Synthesis of Poly(3-alkylthiophenes) Mediated by Rieke Zinc: Their Characterization and Solid-State Properties". Journal of the American Chemical Society. 117: 233–244. doi:10.1021/ja00106a027.
- ^ Xu, Bai; Holdcroft, Steven (1993). "Molecular control of luminescence from poly(3-hexylthiophenes)". Macromolecules. 26 (17): 4457. doi:10.1021/ma00069a009.
- ^ Patil, A. O.; Ikenoue, Y.; Wudl, Fred; Heeger, A. J. (1987). "Water soluble conducting polymers". Journal of the American Chemical Society. 109 (6): 1858. doi:10.1021/ja00240a044.
- ^ Englebienne, Patrick; Weiland, Mich le (1996). "Synthesis of water-soluble carboxylic and acetic acid-substituted poly(thiophenes) and the application of their photochemical properties in homogeneous competitive immunoassays". Chemical Communications (14): 1651. doi:10.1039/cc9960001651.
- ^ Kim; Chen, Li; Gong; Osada, Yoshihito (1999). "Titration Behavior and Spectral Transitions of Water-Soluble Polythiophene Carboxylic Acids". Macromolecules. 32 (12): 3964. doi:10.1021/ma981848z.
- ^ Andersson, M.; Ekeblad, P. O.; Hjertberg, T.; Wennerström, O.; Inganäs, O. (1991). "Polythiophene with a free amino-acid side-chain". Polym. Commun. 32: 546–548.
- ^ Jung, S.; Hwang, D.-H.; Zyung, T.; Kim, W. H.; Chittibabu, K. G.; Tripathy, S. K. (1998). "Temperature dependent photoluminescence and electroluminescence properties of polythiophene with hydrogen bonding side chain". Synthetic Metals. 98 (2): 107. doi:10.1016/S0379-6779(98)00161-1.
- ^ a b Kane-Maguire, Leon A. P.; Wallace, Gordon G. (2010). "Chiral conducting polymers". Chemical Society Reviews. 39 (7): 2545–2576. doi:10.1039/b908001p. PMID 20567781.
{{cite journal}}: CS1 maint: 작성자 매개변수 사용(링크) - ^ Desimone, J. M.; Guan, Z.; Elsbernd, C. S. (1992). "Synthesis of Fluoropolymers in Supercritical Carbon Dioxide". Science. 257 (5072): 945–7. doi:10.1126/science.257.5072.945. PMID 17789638.
- ^ Li, L.; Counts, K. E.; Kurosawa, S.; Teja, A. S.; Collard, D. M. (2004). "Tuning the Electronic Structure and Solubility of Conjugated Polymers with Perfluoroalkyl Substituents: Poly(3-perfluorooctylthiophene), the First Supercritical CO2-soluble Conjugated Polymer". Advanced Materials. 16 (2): 180. doi:10.1002/adma.200305333.
- ^ Murphy, Amanda R.; Fréchet, Jean M. J.; Chang, Paul; Lee, Josephine; Subramanian, Vivek (2004). "Organic Thin Film Transistors from a Soluble Oligothiophene Derivative Containing Thermally Removable Solubilizing Groups". Journal of the American Chemical Society. 126 (6): 1596–7. doi:10.1021/ja039529x. PMID 14871066.
- ^ Price, Samuel C.; Stuart, Andrew C.; Yang, Liqiang; Zhou, Huaxing; You, Wei (2011). "Fluorine Substituted Conjugated Polymer of Medium Band Gap Yields 7% Efficiency in Polymer−Fullerene Solar Cells". Journal of the American Chemical Society. 133 (12): 4625–4631. doi:10.1021/ja1112595. PMID 21375339.
- ^ a b Groenendaal, L. B.; Jonas, F.; Freitag, D.; Pielartzik, H.; Reynolds, J. R. (2000). "Poly(3,4-Ethylenedioxythiophene) and Its Derivatives: Past, Present, and Future". Adv. Mater. 12 (7): 481–494. doi:10.1002/(SICI)1521-4095(200004)12:7<481::AID-ADMA481>3.0.CO;2-C.
{{cite journal}}: CS1 maint: 작성자 매개변수 사용(링크) - ^ Schopf, G.; Koßmehl, G. (1997). Polythiophenes—Electrically Conducting Polymers. Adv. Polym. Sci. Advances in Polymer Science. Vol. 129. pp. 1–166. doi:10.1007/BFb0008700. ISBN 978-3-540-61857-7.
- ^ Roncali, J.; Garreau, R.; Yassar, A.; Marque, P.; Garnier, F.; Lemaire, M. (1987). "Effects of steric factors on the electrosynthesis and properties of conducting poly(3-alkylthiophenes)". The Journal of Physical Chemistry. 91 (27): 6706. doi:10.1021/j100311a030.
- ^ Meyer, Victor (January–June 1883). "Ueber den Begleiter des Benzols im Steinkohlentheer" [On the companion of benzene in stone coal]. Berichte der deutschen chemischen Gesellschaft (in German). 16 (1): 1465–1478. doi:10.1002/cber.188301601324.
- ^ Yamamoto, Takakazu; Sanechika, Kenichi; Yamamoto, Akio (January 1980). "Preparation of thermostable and electric-conducting poly(2,5-thienylene)". Journal of Polymer Science: Polymer Letters Edition. 18 (1): 9–12. Bibcode:1980JPoSL..18....9Y. doi:10.1002/pol.1980.130180103.
- ^ Lin, John W-P.; Dudek, Lesley P. (September 1980). "Synthesis and properties of poly(2,5-thienylene)". Journal of Polymer Science A. 18 (9): 2869–2873. Bibcode:1980JPoSA..18.2869L. doi:10.1002/pol.1980.170180910.
- ^ Chen, Tian An; O'Brien, Richard A.; Rieke, Reuben D. (1993). "Use of highly reactive zinc leads to a new, facile synthesis for polyarylenes". Macromolecules. 26 (13): 3462. Bibcode:1993MaMol..26.3462C. doi:10.1021/ma00065a036.
- ^ Zhu, Lishan; Wehmeyer, Richard M.; Rieke, Reuben D. (1991). "The direct formation of functionalized alkyl(aryl)zinc halides by oxidative addition of highly reactive zinc with organic halides and their reactions with acid chlorides, α,β-unsaturated ketones, and allylic, aryl, and vinyl halides". The Journal of Organic Chemistry. 56 (4): 1445. doi:10.1021/jo00004a021.
- ^ Chen, Tian An; Rieke, Reuben D. (1992). "The first regioregular head-to-tail poly(3-hexylthiophene-2,5-diyl) and a regiorandom isopolymer: nickel versus palladium catalysis of 2(5)-bromo-5(2)-(bromozincio)-3-hexylthiophene polymerization". Journal of the American Chemical Society. 114 (25): 10087. doi:10.1021/ja00051a066.
- ^ Sugimoto, R.; Taketa, S.; Gu, H. B.; Yoshino, K (1986). "Preparation of soluble polythiophene derivatives utilizing transition metal halides as catalysts and their property". Chemistry Express. 1 (11): 635–638.
- ^ Costa Bizzarri, P.; Andreani, Franco; Della Casa, Carlo; Lanzi, Massimiliano; Salatelli, Elisabetta (1995). "Ester-functionalized poly(3-alkylthienylene)s: substituent effects on the polymerization with FeCl3". Synthetic Metals. 75 (2): 141. doi:10.1016/0379-6779(95)03401-5.
- ^ Fraleoni-Morgera, Alessandro; Della-Casa, Carlo; Lanzi, Massimiliano; Costa-Bizzarri, Paolo (2003). "Investigation on Different Procedures in the Oxidative Copolymerization of a Dye-Functionalized Thiophene with 3-Hexylthiophene". Macromolecules. 36 (23): 8617. doi:10.1021/ma0348730.
- ^ Qiao, X.; Wang, Xianhong; Zhao, Xiaojiang; Liu, Jian; Mo, Zhishen (2000). "Poly(3-dodecylthiophenes) polymerized with different amounts of catalyst". Synthetic Metals. 114 (3): 261. doi:10.1016/S0379-6779(00)00233-2.
- ^ Andreani, F.; Salatelli, E.; Lanzi, M. (February 1996). "Novel poly(3,3 – and 3',4'-dialkyl- 2,2':5',2 – terthiophene)s by chemical oxidative synthesis: evidence for a new step towards the optimization of this process". Polymer. 37 (4): 661–665. doi:10.1016/0032-3861(96)83153-3.
- ^ Gallazzi, M.; Bertarelli, C.; Montoneri, E. (2002). "Critical parameters for product quality and yield in the polymerisation of 3,3"-didodecyl-2,2′:5′,2"-terthiophene". Synthetic Metals. 128: 91–95. doi:10.1016/S0379-6779(01)00665-8.
- ^ Laakso, J.; Jarvinen, H.; Skagerberg, B. (1993). "Recent developments in the polymerization of 3-alkylthiophenes". Synthetic Metals. 55 (2–3): 1204. doi:10.1016/0379-6779(93)90225-L.
- ^ Niemi, V. M.; Knuuttila, P.; Österholm, J. E.; Korvola, J. (1992). "Polymerization of 3-alkylthiophenes with ferric chloride". Polymer. 33 (7): 1559–1562. doi:10.1016/0032-3861(92)90138-M..
- ^ a b Olinga, T.; François, B. (1995). "Kinetics of polymerization of thiophene by FeCl3 in choloroform and acetonitrile". Synthetic Metals. 69 (1–3): 297–298. doi:10.1016/0379-6779(94)02457-A.
- ^ Barbarella, Giovanna; Zambianchi, Massimo; Di Toro, Rosanna; Colonna, Martino; Iarossi, Dario; Goldoni, Francesca; Bongini, Alessandro (1996). "Regioselective Oligomerization of 3-(Alkylsulfanyl)thiophenes with Ferric Chloride". The Journal of Organic Chemistry. 61 (23): 8285–8292. doi:10.1021/jo960982j. PMID 11667817.
- ^ Rosseinsky, D. R.; Mortimer, R. J. (2001). "Electrochromic Systems and the Prospects for Devices". Advanced Materials. 13 (11): 783. doi:10.1002/1521-4095(200106)13:11<783::AID-ADMA783>3.0.CO;2-D.
- ^ 가니에, F. "결합 물질에 기초한 현장 효과 트랜지스터"전자 재료의 경우 올리고머 접근법(Eds: Müllen, K.; Wegner, G.) Wiley-VCH, Weinheim, 1998, ISBN 3-527-29438-4
- ^ 해리슨, M. G.; 친구, R. H. "광학적 응용 프로그램".전자 재료의 경우 올리고머 접근법(Eds: Müllen, K.; Wegner, G.) Wiley-VCH, Weinheim, 1998, ISBN 3-527-29438-4
- ^ Martina, V; Ionescu, K.; Pigani, L; Terzi, F; Ulrici, A.; Zanardi, C.; Seeber, R (March 2007). "Development of an electronic tongue based on a PEDOT-modified voltammetric sensor". Analytical and Bioanalytical Chemistry. 387 (6): 2101–2110. doi:10.1007/s00216-006-1102-1. PMID 17235499.
- ^ Bäuerle, Peter; Scheib, Stefan (1993). "Molecular recognition of alkali-ions by crown-ether-functionalized poly(alkylthiophenes)". Advanced Materials. 5 (11): 848. doi:10.1002/adma.19930051113.
- ^ Margalith, Ilan; Suter, Carlo; Ballmer, Boris; Schwarz, Petra (2012). "Polythiophenes Inhibit Prion Propagation by Stabilizing Prion Protein (PrP) Aggregates". The Journal of Biological Chemistry. 287 (23): 18872–87. doi:10.1074/jbc.M112.355958. PMC 3365923. PMID 22493452.