전송전자현미경
Transmission electron microscopy전송전자현미경(TEM)은 전자빔이 시료를 통해 전달돼 이미지를 형성하는 현미경 기법이다.표본은 대부분 100nm 두께 이하의 울트라틴 부분 또는 격자 위의 현수막이다.빔이 시료를 통해 전달될 때 전자와 샘플의 상호 작용으로 영상이 형성된다.그런 다음 이미지를 확대하여 형광 스크린, 사진 필름 층 또는 충전 커플링 장치에 부착된 섬광기와 같은 센서와 같은 영상 장치에 초점을 맞춘다.
전송 전자현미경은 전자의 더 작은 드 브로글리 파장 때문에 가벼운 현미경보다 훨씬 높은 분해능으로 영상을 촬영할 수 있다.이를 통해 기기는 미세한 디테일을 포착할 수 있다. 단 한 열의 원자라도, 이것은 가벼운 현미경으로 볼 수 있는 분해 가능한 물체보다 수천 배 작은 것이다.전송전자현미경은 물리, 화학, 생물과학에서 주요한 분석 방법이다.TEMs는 암 연구, 바이러스학, 재료 과학뿐만 아니라 오염, 나노테크놀로지, 반도체 연구에도 응용할 수 있지만 고생물학, 팔린학 같은 다른 분야에도 응용할 수 있다.
TEM 기기는 기존의 영상촬영, 스캐닝 TEM 영상촬영(STEM), 회절, 분광법, 이들의 조합 등 복수의 작동 모드를 가지고 있다.기존의 영상 내부에서조차 대조가 생성되는 방법에는 근본적으로 여러 가지가 있는데, 이를 "이미지 대비 메커니즘"이라고 한다.대조도는 두께나 밀도의 위치 대 위치 차이("질량-두께 대조"), 원자 번호("Z 대조"), 결정 구조 또는 방향("결정학적 대조" 또는 "분해 대조"), 개별적인 약간의 양자-기계 위상 변화에서 발생할 수 있다.l 원자는 자신을 통과하는 전자("위상 대비"), 샘플 통과 시 전자에 의해 손실된 에너지("상상 영상") 등을 생산한다.각 메커니즘은 사용자에게 대조 메커니즘뿐만 아니라 현미경이 사용되는 방법, 즉 렌즈, 조리개 및 검출기의 설정에 따라 다른 종류의 정보를 알려준다.이것이 의미하는 바는 TEM이 모든 원자가 어디에 있는지뿐만 아니라 원자가 어떤 종류인지 그리고 어떻게 서로 결합되는지를 밝히는 이상적인 경우에서, 매우 다양한 나노미터와 원자 분해능 정보를 반환할 수 있다는 것이다.이러한 이유로 TEM은 생물학 분야와 재료 분야 모두에서 나노 과학에 필수적인 도구로 간주된다.
최초의 TEM은 1931년 막스 크놀과 에른스트 러스카에 의해 시연되었는데, 이 그룹은 1933년 광선보다 해상도가 높은 최초의 TEM과 1939년 최초의 상용 TEM을 개발하였다.1986년, 루스카는 전송 전자 현미경 개발로 노벨 물리학상을 받았다.[2]
역사
초기개발
1873년 에른스트 아베는 물체의 세부 사항을 해결하는 능력은 이미징에 사용되는 빛의 파장이나 가시광선 현미경을 위한 수백 나노미터에 의해 대략적으로 제한된다고 제안했다.쾰러와 뢰르가 이끄는 자외선(UV) 현미경의 개발은 해결력을 2배 증가시켰다.[3]그러나 이것은 유리에 의한 UV의 흡수 때문에 값비싼 석영광학을 필요로 했다.이 파장 제약으로 인해 서브마이크로미터 정보로 영상을 획득하는 것은 불가능하다고 판단되었다.[4]
1858년, 플뤼커는 자기장에 의한 "음극선" (전자)의 편향을 관찰했다.[5]이 효과는 1897년 페르디난드 브라운이 간단한 음극선 오실로스코프(CRO) 측정 장치를 만드는 데 사용하였다.[6]1891년, Riecke는 음극선이 자기장에 의해 집중되어 단순한 전자기 렌즈 설계를 가능하게 할 수 있다는 것을 알아차렸다.1926년 한스 부쉬는 이 이론을 확장한 작품을 발표하여 적절한 가정으로 렌즈 제작자의 방정식을 전자에 적용할 수 있음을 보여주었다.[2]
1928년 베를린 공과대학에서 아돌프 마티아스 고전압 기술 및 전기 설비학 교수는 CRO 설계를 진전시키기 위한 연구팀을 이끌기 위해 막스 크놀을 임명했다.이 팀은 에른스트 러스카와 보도 폰 보리스 등 여러 명의 박사 과정 학생들로 구성되었다.연구팀은 더 나은 CRO를 구성하기 위해 파라미터를 최적화하고 전자 광학부품을 만들어 저배율(약 1:1) 이미지를 만들기 위해 렌즈 설계와 CRO 칼럼 배치에 힘썼다.1931년에 이 그룹은 양극 구멍 위에 배치된 메쉬 그리드의 확대된 이미지를 성공적으로 생성했다.이 장치는 더 높은 확대율을 얻기 위해 두 개의 자기 렌즈를 사용했는데, 아마도 최초의 전자 현미경을 만들었다.같은 해, 지멘스 회사의 과학 감독인 라인홀드 루덴버그는 정전식 렌즈 전자현미경에 특허를 얻었다.[4][7]
해상도 향상
당시 전자는 물질의 전하를 띤 입자로 이해되었다; 전자의 파동 성질은 1927년 드 브로글리 가설이 발표되기 전까지는 완전히 실현되지 않았다.[8]Knoll의 연구 그룹은 1932년까지 이 출판물을 알지 못했는데, 그때 그들은 전자의 드 브로글리 파장이 원자 눈금에서 이미징을 가능하게 하는 빛의 파장보다 많은 크기의 순서라는 것을 재빨리 깨달았다. (단 1볼트의 운동 에너지를 가진 전자의 경우에도 파장은 이미 1.23만큼 짧다.nm.) 1932년 4월 러스카는 단순한 메쉬 그리드나 조리개 이미지가 아닌 현미경에 삽입된 시료의 직접 영상화를 위한 새로운 전자현미경의 구축을 제안했다.이 장치를 사용하여 알루미늄 시트의 회절과 정상적인 이미지를 성공적으로 촬영할 수 있었다.그러나 달성 가능한 확률은 가벼운 현미경 검사보다 낮았다.광현미경으로 이용할 수 있는 것보다 더 높은 배율은 1933년 9월에 전자빔에 의해 손상되기 전에 재빨리 획득한 면 섬유의 이미지로 달성되었다.[4]
이때, 전자 현미경에 대한 흥미, 그 폴 앤더슨 그리고 케네스 피츠 시몬스가 워싱턴 주 University[9]의 알버트 Prebus과 제임스 Hillier은 토론토 대학교에서의, 1935년 그리고 1938에, respectively,[10]지속적으로advancin 첫번째 TEMs 북 아메리카에서 건설의 다른 단체들과 함께 증가해 왔다.gTEMdesign을 하다
1936년 지멘스의 전자현미경에 대한 연구는 계속되었는데, 이 연구의 목적은 특히 생물학적 표본에 관한 TEM 영상 성질의 개발과 개선이었다.이 시기에 전자현미경은 영국 국립물리연구소에서 사용되는 "EM1" 장치와 같은 특정 집단을 위해 제작되고 있었다.[11]1939년 IG 파벤-베르케의 물리학부에 최초로 상업용 전자현미경이 설치되었다.전자현미경에 대한 추가 작업은 공습으로 지멘스에 건설된 새로운 실험실이 파괴되고, 제2차 세계 대전 중 하인츠 뮐러와 프리드릭 크라우스라는 두 명의 연구원이 사망하면서 방해를 받았다.[12]
추가 연구
제2차 세계대전이 끝난 후 러스카는 지멘스에서 작업을 재개하여 전자현미경을 계속 개발하여 100k 배율의 최초의 현미경을 제작하였다.[12]다단계의 빔 준비 광학 장치를 갖춘 이 현미경 디자인의 기본 구조는 여전히 현대 현미경에서 사용되고 있다.세계 전자현미경 공동체는 영국 맨체스터, 미국(RCA), 독일(시멘스), 일본(JEOL)에서 전자현미경이 제작되면서 발전했다.전자현미경 검사에서의 첫 번째 국제회의는 1949년 델프트에서 열렸으며, 100명 이상의 참석자가 있었다.[11]이후 회의에는 1950년 파리와 1954년 런던에서 열린 "제1차" 국제회의가 포함되었다.
TEM의 개발로, 송신 전자현미경 검사(STEM)의 관련 기법이 재조사되어 1970년대까지 미개발된 상태로 유지되었는데, 시카고 대학의 앨버트 크레에가 필드 방출포를[13] 개발하고 고품질 목표 렌즈를 추가하여 현대 STEM을 만들었다.크뢰는 이 디자인을 이용하여 환형 암장 이미징을 사용하여 원자를 이미지화하는 능력을 시연했다.시카고 대학의 Crewe와 동료들은 냉장 전자 방출원을 개발했고 얇은 탄소 기판에 무거운 원자 하나를 시각화할 수 있는 STEM을 만들었다.[14]2008년 Jannick Meyer 등에서는 TEM과 깨끗한 단층 그래핀 기질을 이용하여 탄소, 심지어 수소 등 가벼운 원자의 직접 시각화를 기술했다.[15]
배경
전자
이론적으로, 광현미경으로 얻을 수 있는 최대 분해능 d는 샘플 탐사에 사용되는 광자(光子)의 파장과 시스템의 숫자 구멍 NA에 의해 제한되었다.[16]
여기서 n은 렌즈가 작용하고 있는 매체의 굴절률이며 α는 렌즈에 들어갈 수 있는 빛의 원뿔의 최대 반각이다(숫자 구멍 참조).[17]20세기 초 과학자들은 전자를 이용하여 가시광선의 비교적 큰 파장(파장 400~700나노미터)의 한계를 극복하는 방법을 이론화했다.모든 물질과 마찬가지로 전자는 파동과 입자 성질을 모두 가지고 있으며(루이스 빅터 드 브로글리에 의해 이론화 된 바와 같이), 파동 같은 성질은 전자의 한 빔이 빛처럼 집중되어 분산될 수 있다는 것을 의미한다.전자의 파장은 드 브로글리 방정식을 통해 운동 에너지와 관련이 있는데, 이 방정식은 파장이 운동량에 반비례한다는 것이다.상대론적 효과(TEM에서 전자 속도가 빛의 속도의 상당 부분인 것처럼[18], c)를 고려하면 파장은
여기서 h는 플랑크의 상수, m은0 전자의 나머지 질량, E는 가속 전자의 운동 에너지다.전자는 보통 전구와 같은 방식으로, 보통 텅스텐 필라멘트로부터의 열이온 방출로 알려진 과정에 의해 전자 현미경으로 생성되거나, 또는 전자의 전자가 방출하는 방식으로 생성된다.[19]그런 다음 전자는 전위(볼트로 측정)에 의해 가속되고 정전기 및 전자기 렌즈에 의해 샘플에 집중된다.전송된 빔은 전자 밀도, 위상, 주기성에 대한 정보를 포함하고 있다. 이 빔은 이미지를 형성하는데 사용된다.
전자 소스

위에서 아래로 TEM은 텅스텐 필라멘트 또는 바늘일 수 있는 방출원 또는 음극원 또는 란타넘 헥사보라이드(LaB6) 단일 결정원으로 구성된다.[20]총은 고전압 소스(일반적으로 ~100–300 kV)에 연결되어 있으며, 충분한 전류를 주어진 총은 열전자 또는 전계 전자 방출에 의해 진공으로 전자를 방출하기 시작할 것이다.열전자의 경우, 전자원은 일반적으로 베넬트 실린더에 탑재되어 방출된 전자의 예비 포커스를 빔으로 제공하는 동시에 패시브 피드백 회로를 사용하여 전류를 안정화시킨다.전기장 방출원은 대신 추출기, 억제기, 총 렌즈라고 불리는 정전기 전극을 사용하여 날카로운 끝 근처의 전기장 모양과 강도를 조절한다.음극과 이러한 최초의 정전기 렌즈 요소들의 결합은 흔히 집합적으로 "전자기총"이라고 불린다.그것이 총에서 나간 후 빔은 일반적으로 일련의 정전기 판에 의해 최종 전압에 도달하여 현미경의 다음 부분으로 들어갈 때까지 가속된다.콘덴서 렌즈 시스템.TEM의 이러한 상부 렌즈는 전자 빔을 샘플의 원하는 크기와 위치에 더욱 집중시킨다.[21]
전자 빔의 조작은 두 가지 물리적 효과를 사용하여 수행된다.전자와 자기장의 상호작용으로 전자가 왼손 법칙에 따라 움직이게 되어 전자석이 전자빔을 조작할 수 있게 된다.자기장을 사용하면 자속 분포로 인해 발생하는 렌즈 형태인 가변 초점 파워의 자기 렌즈를 형성할 수 있다.또한 정전기장은 일정한 각도를 통해 전자를 비껴가게 할 수 있다.반대 방향의 두 편향과 작은 중간 간격을 결합하면 빔 경로의 이동이 형성되어 STEM에 중요한 TEM에서 빔 이동이 가능하다.전자 영상 시스템의 사용뿐만 아니라 이 두 가지 효과로부터, TEM 작동을 위해 빔 경로를 충분히 제어할 수 있다.광학 현미경의 경우와는 달리, 광학 현미경의 경우, 광학 경로의 렌즈를 활성화하거나 강도를 변화시키거나, 고속 전기 스위칭을 통해 완전히 비활성화할 수 있으며, 그 속도는 렌즈의 자기 이력(Magnetic Hysteresis)과 같은 효과에 의해 제한된다.
광학
TEM의 렌즈는 작동 모드의 유연성과 원자 축척까지 빔의 초점을 맞추고 카메라의 이미지를 얻기 위해 빔을 위로 확대시키는 능력을 제공한다.렌즈는 대개 코일의 자기장을 정밀하고 제한된 모양으로 집중하도록 설계된 강자성 물질로 둘러싸인 솔레노이드 코일로 만들어진다.전자가 이 자기장을 드나들 때, 그것은 일반적인 유리 렌즈가 빛에 대해 하는 것처럼 매우 많이 작용하는 방식으로 곡선 자기장 선을 중심으로 회전한다. 그것은 수렴 렌즈다.그러나, 유리 렌즈와 달리, 자기 렌즈는 코일을 통과하는 전류를 조절하는 것만으로 초점력을 매우 쉽게 바꿀 수 있다.이것은 렌즈를 독립 렌즈 스택으로 조립할 때 더 많은 작동 유연성을 제공하며, 각각의 렌즈는 이전 렌즈에서 나오는 빔에 초점을 맞추고, 디포커스하고, 확대하거나, 또는/또는 콜리메이트할 수 있다.이를 통해 소스와 샘플("콘덴서 렌즈" 시스템) 사이의 단일 렌즈 시스템이 지름 1mm 이상의 평행 빔, 원자보다 작은 촘촘한 집중 빔 또는 그 사이에 있는 어떤 빔을 만들 수 있다.추가 렌즈 스택인 "중간/프로젝터" 렌즈 시스템은 샘플 다음에 있다.그것은 큰 범위에 걸쳐 변화하는 확대와 함께 집중적인 회절 패턴이나 샘플의 이미지를 생성하도록 조정될 수 있다.많은 단일 현미경들은 대략 100배에서 100만배 이상까지 확대 범위를 커버할 수 있다.
렌즈에 똑같이 중요한 것은 구멍이다.이것들은 얇은 헤비메탈 조각에 있는 원형 구멍으로 렌즈 기둥의 잘 다듬어진 지점에 놓여 있다.어떤 것들은 크기와 위치에 고정되어 있고 X선 생성을 제한하고 진공 성능을 향상시키는데 중요한 역할을 한다.그들은 또한 전자가 자기 렌즈의 가장 바깥쪽 부분을 통과하는 것을 방지하는데, 이것은 큰 렌즈 이상 때문에 전자 빔의 초점을 매우 나쁘게 맞춘다.다른 것들은 몇 가지 다른 크기들 사이에서 자유롭게 전환될 수 있고 그들의 위치를 조정할 수 있다.이러한 "변수 구멍"은 표본에 도달하는 빔 전류를 결정하고 빔의 초점을 맞추는 능력을 향상시키는 데 사용된다.샘플 위치 이후의 가변 구멍은 사용자가 이미지 또는 회절 패턴의 형성에 사용할 공간 위치 또는 전자 산란 각도의 범위를 추가로 선택할 수 있도록 한다.능숙하게 사용된 이 조리개들은 결정의 결함에 대한 놀랄 만큼 정밀하고 상세한 연구를 가능하게 한다.
전자 광학 시스템에는 디플렉터와 스티그레이터도 포함되는데, 보통 작은 전자석들로 만들어진다.렌즈와 달리 디플렉터에 의해 생성되는 자기장은 주로 빔을 비껴서 초점을 맞추지 않도록 방향을 잡는다.디플렉터는 샘플 위치에서 빔의 위치와 각도를 독립적으로 제어할 수 있도록 하며(STEM에 필수적임) 또한 빔이 렌즈 스택에 있는 모든 렌즈의 저층촬영 중심 근처에 유지되도록 보장한다.스티그메이터는 난시를 일으키는 약간의 결함과 이상을 보상하는 보조적 미세 초점을 제공한다. 렌즈는 다른 방향으로 초점 강도가 다르다.
일반적으로 TEM은 세 단계의 렌즈로 구성된다.단계는 콘덴서 렌즈, 목표 렌즈, 프로젝터 렌즈다.콘덴서 렌즈는 1차 빔 형성을 담당하는 반면, 객관적인 렌즈는 샘플 자체를 통해 들어오는 빔에 초점을 맞춘다(STEM 스캐닝 모드에서는 입사 전자 빔을 수렴하기 위한 샘플 위에도 객관적인 렌즈가 있다.프로젝터 렌즈는 빔을 인광 스크린이나 필름과 같은 다른 영상 장치로 확장하는데 사용된다.TEM의 확대는 시료와 목표 렌즈의 영상 평면 사이의 거리 비율에 기인한다.[22]추가 지름을 사용하면 난시라고 알려진 비대칭 빔 왜곡을 수정할 수 있다.TEM 광학 구성은 구형 이상 교정 계측기와 같은 사용자 정의 렌즈 구성을 사용하는 제조업체나 [21]전자 색도 이상을 교정하기 위해 에너지 필터링을 사용하는 TEM 등 구현에 따라 크게 다르다는 점에 유의한다.
상호주의
광학적 상호주의 정리 또는 헬름홀츠 상호주의 원리는 표준 TEM 작동 조건에서 흔히 그렇듯이 흡수 매체에서 탄성적으로 산란된 전자에 대해 일반적으로 참이다.[23][24]정리는 전자 포인트 소스 A의 결과로서 어느 지점 B의 파동 진폭은 B에 배치된 등가 포인트 소스로 인해 A의 진폭과 동일하다고 기술하고 있다.[24]간단히 말해, 전자 소스와 관측 지점이 역전되면 스칼라(즉 자기장이 아닌)장만을 포함하는 어떤 일련의 광학적 요소들을 통하여 집중된 전자의 파동 기능은 정확히 동등할 것이다.
TEM에서 전자기 렌즈는 탄성 산란 과정이 표본에서 지배하고 표본이 강한 자성을 띠지 않는 한 상호주의 관찰에 눈에 띄게 간섭하지 않는 것으로 나타났다.[23]상호주의 정리가 유효한 경우에 신중하게 적용하면 TEM 사용자는 영상과 전자 회절 패턴을 취하고 해석하는데 상당한 유연성을 갖게 된다.또한 상호주의는 TEM의 친숙한 맥락에서 전송전자현미경(STEM) 스캔을 이해하고 STEM을 사용하여 이미지를 획득하고 해석하는 데 사용될 수 있다.
디스플레이 및 디텍터
전자 검출 고려 시 핵심 요인은 탐정 양자 효율(DQE), 점 확산 함수(PSF), 변조 전달 함수(MTF), 화소 크기 및 배열 크기, 노이즈, 데이터 판독 속도, 방사선 경도 등이다.[25]
TEM의 영상 시스템은 운영자의 직접 관찰을 위해 미세(10–100 μm) 입자 아연 황화물로 제작될 수 있는 인광 스크린과 선택적으로 사진 필름,[26] 도핑된 YAG 스크린 커플링 CCD [27]또는 기타 디지털 검출기와 같은 영상 기록 시스템으로 구성된다.[25]일반적으로 이러한 장치는 필요에 따라 운용자가 빔 경로에 삽입하거나 제거할 수 있다.사진 필름은 고해상도 정보를 기록할 수 있지만 자동화가 간단하지 않고 결과를 실시간으로 볼 수 없다.TEM용 CCD(Charge-Couplled Device) 검출기를 사용한 첫 보고서는 1982년이었지만,[28] 이 기술은 1990년대 후반/2000년대 초반까지 널리 쓰이지 않았다.[29]CCD보다 방사선 손상에 더 빠르고 내성이 강한 TEM CMOS 검출기에는 2005년부터 TEM에도 일체형 액티브픽셀 센서(MAPS)가 사용됐다.[30][31][32]2010년대 초, CMOS 기술의 추가 개발로 단일 전자 계수("카운팅 모드")[33][34]의 검출이 가능해졌다.이러한 직접 전자 검출기는 Gatan, FEI, Quantum Detectors 및 Direct Electronics에서 사용할 수 있다.[30]
구성 요소들
TEM은 전자가 이동하는 진공 시스템, 전자 스트림 생성을 위한 전자 배출원, 일련의 전자기 렌즈, 정전기 판 등을 포함하는 여러 구성 요소로 구성되어 있다.후자 2개는 작업자가 필요에 따라 빔을 유도하고 조작할 수 있도록 한다.또한 빔 경로에서 시료를 삽입, 이동 및 제거할 수 있는 장치도 필요하다.영상 장치는 이후 시스템을 나가는 전자로부터 이미지를 만드는 데 사용된다.
진공 시스템
전자 가스 상호작용의 평균 자유 경로를 증가시키기 위해 표준 TEM은 일반적으로 10−4 Pa의 순서로 저압으로 대피한다.[35]이것에 대한 필요성은 두 가지다. 첫째, 호를 생성하지 않고 음극과 지면 사이의 전압 차이에 대한 허용치, 둘째, 가스 원자와 전자의 충돌 주파수를 무시할 수 있는 수준으로 줄이는 것이다. 이 효과는 평균 자유 경로로 특징지어진다.시료 홀더 및 필름 카트리지와 같은 TEM 구성품은 정기적으로 삽입하거나 교체해야 하며 정기적으로 재진화 기능이 있는 시스템을 사용해야 한다.이와 같이 TEM은 다중 펌핑 시스템과 에어록이 장착되어 있으며 영구적으로 진공 밀봉되지 않는다.
TEM을 작동 압력 수준으로 대피시키기 위한 진공 시스템은 몇 단계로 구성된다.초기에는 회전식 베인 펌프 또는 다이어프램 펌프가 작동에 필요한 높은 진공 수준을 설정하는 터보 분자 또는 확산 펌프의 작동이 가능하도록 충분히 낮은 압력을 설정하면 저공 또는 거친 진공이 달성된다.터보 분자 펌프를 지속적으로 작동하면서 저진공 펌프가 연속적으로 작동하지 않도록 저압 펌프의 진공 측면을 터보 분자 펌프에서 나오는 배기 가스를 수용하는 챔버에 연결할 수 있다.[36]TEM의 섹션은 고해상도 또는 전계 방출 TEM에서 전자 건에 10−4~10Pa−7 이상의 높은 진공 수준과 같은 특정 영역에서 서로 다른 진공 수준을 허용하기 위해 압력 제한 개구부를 사용하여 격리될 수 있다.
고전압 TEM은 특히 TEM 음극에서 전기 아크의 생성을 방지하기 위해 10−7~10Pa−9 범위에서 초고진공을 필요로 한다.[37]높은 전압의 TEM과 마찬가지로, 게이트 밸브 또는 차동 펌핑 구멍에 의해 총이 메인 챔버로부터 격리된 상태에서 세 번째 진공 시스템이 작동할 수 있다. 즉, 가스 분자가 펌핑할 수 있는 것보다 더 빠른 속도로 더 높은 진공 건 영역으로 확산되는 것을 방지하는 작은 구멍이다.이러한 매우 낮은 압력에는 이온 펌프 또는 게터 자재가 사용된다.
TEM의 진공 상태가 좋지 않으면 전자빔 유도 증착이라고 알려진 공정에서 보는 동안 TEM 내부의 가스가 시료에 축적되는 것에서부터 전기 방전에 의해 야기되는 보다 심각한 음극 손상에 이르기까지 여러 가지 문제를 일으킬 수 있다.[37]콜드 트랩을 사용하여 시료 근처에서 승화된 가스를 흡착하면 시료 승화에 의해 야기되는 진공 문제가 대부분 제거된다.[36]
시료단계

TEM 검체 단계 설계에는 현미경의 다른 영역에서 진공 손실을 최소화하면서 검체 홀더를 진공에 삽입할 수 있는 에어록이 포함된다.시료 홀더에는 표준 크기의 시료 격자 또는 자체 지지 시료를 보관한다.표준 TEM 격자 크기는 3.05mm 직경이며, 두께와 망사 크기는 몇 μm에서 100 μm에 이른다.표본은 약 2.5 mm의 직경을 가진 중간 영역에 배치된다.일반적인 그리드 재료는 구리, 몰리브덴, 금 또는 백금이다.이 그리드는 검체 홀더에 배치되며, 검체 단계와 짝을 이룬다.수행되는 실험의 유형에 따라 단계와 홀더의 설계가 매우 다양하다.3.05mm 그리드와 더불어 2.3mm 그리드를 사용하는 경우도 있다.이러한 그리드는 특히 광물학에서 많이 기울여야 하며 표본 재료가 극히 드물 수 있는 곳에 사용되었다.전자 투명 시료는 보통 100nm 미만의 두께를 가지지만 이 값은 가속 전압에 따라 달라진다.
일단 TEM에 삽입되면, 샘플은 특정한 방향으로 단일 입자 회절에서와 같이 빔에 대한 관심 영역을 찾기 위해 조작되어야 한다.이를 수용하기 위해 TEM 단계는 XY 평면, Z 높이 조정 및 일반적으로 측면 입력 홀더의 축에 평행한 단일 기울기 방향에서 샘플을 이동할 수 있다.샘플 회전은 특수 회절 홀더 및 단계에서 사용할 수 있다.일부 최신 TEM은 이중 틸트 샘플 홀더라고 불리는 특수 홀더 설계로 두 개의 직교 틸트 각도의 이동 능력을 제공한다.고해상도 TEM 연구에 대해 한 번 일반적이면 상단 입력 또는 수직 삽입 단계와 같은 일부 스테이지 설계는 단순히 X-Y 변환만 사용할 수 있다.기계 및 전자 광학 제약의 동시 요구사항으로 인해 TEM 단계의 설계 기준은 복잡하고 다른 방법에 대해 전문화된 모델을 사용할 수 있다.
TEM 단계는 시료를 잡고 관심 영역을 전자빔의 경로로 끌어들이도록 조작할 수 있는 능력을 갖추어야 한다.TEM은 광범위한 배율에서 작동할 수 있으므로, 단계는 기계적 드리프트에 대한 내성이 높아야 하며, 수 μm/분을 이동할 수 있고, 나노미터의 순서로 정확한 위치를 조정할 수 있어야 한다.[38]TEM의 초기 설계는 복잡한 기계식 감속 장치를 사용하여 이를 달성했으며, 운영자는 여러 개의 회전봉으로 스테이지의 움직임을 미세하게 제어할 수 있었다.현대의 장치는 스테퍼 모터와 함께 나사 기어를 사용하여 조작자에게 조이스틱이나 트랙볼과 같은 컴퓨터 기반 스테이지 입력을 제공하는 전기 스테이지 설계를 사용할 수 있다.
TEM의 스테이지에 대한 두 가지 주요 설계, 즉 측면 엔트리 버전과 상단 엔트리 버전이 존재한다.[27]각 설계는 섬세한 TEM 광학을 손상시키거나 진공 상태의 TEM 시스템에 가스를 허용하지 않고 시료를 삽입할 수 있도록 일치 홀더를 수용해야 한다.
가장 일반적인 것은 측면 진입 홀더로, 시료를 긴 금속(브라스 또는 스테인리스강) 봉의 끝 가까이에 놓고, 시료를 작은 보어에 평평하게 배치한다.로드를 따라 여러 개의 폴리머 진공 링이 있어 스테이지에 삽입할 때 충분한 품질의 진공 씰을 형성할 수 있다.따라서 단계는 목표 설계에 따라 목표 렌즈 사이에 또는 근처에 샘플을 배치하여 로드를 수용하도록 설계된다.스테이지에 삽입하면 사이드 엔트리 홀더의 팁이 TEM 진공 내에 포함되며, 베이스는 진공 링에 의해 형성된 에어록인 대기에 제시된다.
측면 입력 TEM 홀더에 대한 삽입 절차에는 일반적으로 샘플을 TEM 칼럼에 삽입하기 전에 에어록의 대피를 시작하는 마이크로 스위치를 트리거하기 위해 샘플의 회전이 포함된다.
두 번째 설계는 상단 입력 홀더가 카트리지 축에 드릴로 뚫은 보어가 있는 수 cm 길이의 카트리지로 구성되어 있다는 것이다.시료는 보어에 적재되며, 시료를 제자리에 고정하기 위해 작은 나사 고리를 사용할 수 있다.이 카트리지는 보어가 TEM 광축에 수직인 에어록으로 삽입된다.밀봉 시 에어록은 카트리지가 제자리에 떨어지도록 카트리지를 밀어서 보어 구멍이 빔 축과 정렬되도록 하여 빔이 카트리지 보어를 따라 내려가 시료 안으로 이동하게 한다.그러한 설계는 일반적으로 빔 경로를 막거나 목표 렌즈를 방해하지 않고 기울일 수 없다.[27]
전자총
전자총은 필라멘트, 바이어싱 회로, 웨넬트 캡, 추출 양극 등 여러 구성 요소로 구성된다.필라멘트를 음의 성분 전원 공급기에 연결하면 전자총에서 양극판, TEM기둥으로 전자를 '펌프'할 수 있어 회로를 완성할 수 있다.이 총은 총이 반각, α를 발산하는 것으로 알려진 일정한 각도로 어셈블리에서 빠져나오는 전자의 빔을 생성하도록 설계되어 있다.필라멘트 자체보다 높은 음전하를 갖도록 베넬트 실린더를 구성함으로써, 적절한 작동 상태에서 필라멘트를 빠져나가는 전자는 최소 크기가 총 크로스오버 직경인 수렴 패턴으로 강제된다.
열전자 방출 전류 밀도 J는 리처드슨의 법칙을 통해 방출 물질의 작업 기능과 관련될 수 있다.
여기서 A는 리처드슨의 상수인 φ은 작업함수, T는 재료의 온도인 것이다.[27]
이 방정식은 충분한 전류 밀도를 달성하기 위해서는 방출체를 가열해야 하며 과도한 열을 가하여 손상을 입히지 않도록 주의해야 함을 보여준다.이러한 이유로 텅스텐과 같이 용해점이 높은 재료나 작업 기능이 낮은 재료(LaB6)가 총기 필라멘트에 필요하다.[39]또한 란타넘 헥사보리드 및 텅스텐 열전원 모두 열전 방출이 가능하도록 가열해야 하며, 이는 작은 저항성 스트립을 사용하여 달성할 수 있다.열충격을 방지하기 위해 종종 팁에 전류를 가하는 데 지연이 발생하며, 열 구배가 필라멘트를 손상시키지 않도록 하기 위해 지연은 보통 LaB의6 경우 몇 초, 텅스텐의[citation needed] 경우 현저히 낮다.
전자렌즈
전자 렌즈는 일정한 초점 거리에 평행 전자를 집중시킴으로써 광학 렌즈를 모방하는 방식으로 작동하도록 설계되었다.전자 렌즈는 정전기 또는 자력으로 작동할 수 있다.TEM용 전자렌즈의 대부분은 전자기 코일을 사용하여 볼록렌즈를 생성한다.마그네틱 렌즈의 방사상 대칭으로부터의 편차가 난시와 같은 이상을 일으키고 구면 및 색도 일탈을 악화시키므로 렌즈를 위해 생성된 장은 방사상 대칭이어야 한다.전자렌즈는 permalloy와 같은 [40]철, 철 코발트 또는 니켈 코발트 합금으로 제조된다.이들은 자기 포화, 이력, 투과성 등 자기 성질을 위해 선택된다.
구성 요소에는 요크, 자기 코일, 폴, 폴피스, 외부 제어 회로가 포함된다.폴 피스는 렌즈를 형성하는 자기장의 경계 조건을 제공하기 때문에 매우 대칭적인 방법으로 제조되어야 한다.폴 피스 제조의 불완전성은 자기장 대칭에 심한 왜곡을 유발할 수 있으며, 이는 궁극적으로 렌즈의 객체 평면 재생 능력을 제한하는 왜곡을 유발할 수 있다.렌즈의 전체적인 설계뿐만 아니라 간격, 폴피스 내경 및 테이퍼의 정확한 치수는 설계의 열적 및 전기적 구속조건을 고려하면서 자기장의 유한요소해석에 의해 수행되는 경우가 많다.[40]
자기장을 생성하는 코일은 렌즈 요크 안에 위치한다.코일은 가변 전류를 포함할 수 있지만 일반적으로 고전압을 사용하므로 렌즈 구성 요소의 단락을 방지하기 위해 상당한 절연이 필요하다.열 분배기를 배치하여 코일 권선의 저항으로 손실된 에너지에 의해 발생하는 열을 추출한다.권선은 고열 듀티 제거를 용이하게 하기 위해 냉각수를 사용하여 수냉할 수 있다.
조리개
개구부는 환형 금속판이며, 이를 통해 광축으로부터 고정 거리보다 더 먼 전자는 제외될 수 있다.이것들은 축전자를 허용하면서 전자가 원반을 통과하지 못하도록 충분히 두꺼운 작은 금속 원반으로 구성되어 있다.TEM에서 중심 전자의 이러한 허용은 두 가지 효과를 동시에 유발한다: 첫째, 개구부는 전자가 빔에서 걸러질 때 빔 강도를 감소시킨다. 이것은 빔에 민감한 샘플의 경우에 원하는 것일 수 있다.둘째, 이 필터링은 고각으로 흩어진 전자를 제거하는데, 이는 구형이나 색채 이상과 같은 원치 않는 과정 때문일 수도 있고, 샘플 내의 상호작용에서 오는 회절 때문일 수도 있다.[41]
개구부는 콘덴서 렌즈와 같이 기둥 내 고정된 개구부 또는 이동 가능한 개구부로 빔 경로에서 삽입 또는 인출하거나 빔 경로에 수직인 평면에서 이동할 수 있다.조리개 조립체는 다른 조리개 크기를 선택할 수 있는 기계적 장치로서, 작동자가 강도 및 조리개 필터링 효과를 절충하기 위해 사용할 수 있다.조리개 조립품에는 광학 교정 중에 필요한 조리개를 이동시키기 위한 마이크로미터가 장착되어 있는 경우가 많다.
이미징 방법
TEM의 영상 방법은 샘플에서 나오는 전자파에 포함된 정보를 사용하여 이미지를 형성한다.프로젝터 렌즈는 이 전자파 분포를 시야 시스템에 정확하게 배치할 수 있도록 한다.이미지의 관측 강도 I는 충분히 높은 화질을 가정한 것으로서 전자파 기능 진폭의 시간 평균 제곱 절대값과 비례하여 대략적으로 추정할 수 있으며, 여기서 출구 빔을 형성하는 파형은 ψ으로 표시된다.[42]
따라서 다른 영상 방법은 샘플 또는 빔 자체에 대한 정보를 제공하는 방식으로 샘플에서 나오는 전자파를 수정하려고 시도한다.이전 방정식으로부터 관측된 영상이 빔의 진폭뿐만 아니라 전자의 위상에 따라 달라지는 것을 추론할 수 있지만,[clarification needed] 위상 효과는 낮은 배율에서 무시될 수 있다.고해상도 영상촬영에는 더 얇은 샘플과 입사전자의 높은 에너지가 필요하며, 이는 샘플이 더 이상 전자(즉, Beer's law effect)를 흡수하는 것으로 간주될 수 없다는 것을 의미한다.대신 샘플은 들어오는 전자파 함수의 진폭을 바꾸지 않고 대신 들어오는 파장의 위상을 수정하는 물체로 모델링할 수 있는데, 이 모델에서는 샘플을 순수 위상 물체라고 한다.충분히 얇은 시료의 경우 위상 효과가 영상을 지배하여 관측된 강도의 분석을 복잡하게 한다.[42]영상의 대비를 개선하기 위해 TEM의 대비 전달 기능에 의한 경련으로 인해 TEM을 약간의 데포쿠스로 작동시킬 수 있으며,[43] 이는 표본이 약한 위상 물체가 아닐 경우 대비를 감소시킬 수 있다.
오른쪽 그림은 TEM-이미징 및 회절모드의 두 가지 기본 운전모드를 보여준다.두 경우 모두에서 시료는 콘덴서 렌즈와 콘덴서 조리개 시스템과 함께 전자 빔 형성에 의해 형성된 평행 빔으로 조명된다.표본과의 상호작용 후, 표본의 출구 표면에는 두 가지 유형의 전자가 존재한다. 즉, 비파괴(회절 패턴의 밝은 중앙 빔에 해당함)와 산란 전자(물질과의 상호작용에 의해 궤적이 변경됨)이다.
Imaging mode(이미징 모드)에서는 목표 렌즈(회절점이 형성된 곳)의 후방 초점 평면(BFP)에 목표 개구부를 삽입한다.목표 개구부를 사용하여 중앙 빔만 선택하면 전송된 전자가 모두 차단된 상태에서 개구부를 통과하여 밝은 필드 이미지(BF 이미지)를 얻는다.확산된 빔에서 신호를 허용하면 다크 필드 이미지(DF 이미지)가 수신된다.선택한 신호는 중급 및 프로젝터 렌즈의 도움으로 확대되어 화면(또는 카메라)에 투사된다.따라서 샘플의 이미지를 얻는다.
회절 모드에서는 신호가 표시될 시료 영역을 보다 정확하게 결정하기 위해 선택된 영역 구경을 사용할 수 있다.전류의 강도를 중간 렌즈로 변경함으로써 회절 패턴을 화면에 투사한다.회절은 세포 재구성과 결정 방향 결정을 위한 매우 강력한 도구다.
대비형성
TEM 영상에서 두 인접 영역 사이의 대조는 영상 평면에서 전자 밀도의 차이로 정의될 수 있다.샘플에 의한 입사 빔의 산란으로 인해 전자파의 진폭과 위상이 변화하여 그에 상응하여 진폭 대비와 위상 대조가 발생한다.대부분의 영상에는 두 가지 대비 성분이 있다.
영상 평면 전에 일부 전자가 제거되어 진폭 대비를 얻는다.시료와 상호작용하는 동안 일부 전자는 흡수되거나 현미경의 물리적 한계를 넘어 매우 높은 각도로 산란되거나 객관적 개구부에 의해 차단되어 손실된다.처음 두 번의 손실은 시료와 현미경 구조로 인한 것이지만, 객관적인 구멍은 조작자가 사용해 대비를 높일 수 있다.
오른쪽 그림은 객관적 개구부 없이 촬영한 Pt 다결정 필름의 TEM 영상(a)과 해당 회절 패턴(b)을 보여준다.TEM 영상의 대비를 강화하려면 회절 패턴에서 볼 수 있는 산란 빔의 수를 줄여야 한다.이는 중앙 빔 또는 특정 확산 빔(각도) 또는 그러한 빔의 조합과 같은 후방 초점 평면에서 특정 영역을 선택하여 수행할 수 있다.비감산 빔이 후방 초점면(및 이미지 평면)을 넘어서만 통과할 수 있는 객관적 개구부를 의도적으로 선택하여 BF(Bright-Field) 영상(c)을 생성하는 반면, 중앙의 비감산 빔이 차단된 경우: (d-e)와 같은 다크 필드(DF) 영상을 얻을 수 있다.DF 영상(d-e)은 후방 초점면의 개구부를 사용하여 원 (b)과 함께 회절 패턴으로 표시된 회절된 빔을 선택하여 얻었다.이 회절점 안으로 전자가 흩어지는 알갱이들은 더 밝게 보인다.회절 대비 형성에 대한 자세한 내용은 더 자세히 설명되어 있다.
진폭 대비에는 질량- 두께와 회절 대비의 두 가지 유형이 있다.첫째, 질량-두께 대조를 생각해 보자.빔이 낮은 질량(또는 두께)과 높은 질량(또는 두께)을 가진 인접 영역 두 곳을 비추면, 무거운 영역이 더 큰 각도로 전자를 산란시킨다.이러한 강하게 산란된 전자는 BF TEM 모드에서 객관적 개구부에 의해 차단된다.그 결과 BF 영상에서 무거운 영역이 더 어둡게 나타난다(강도가 낮다).질량-두께 대비는 비결정성, 비결정성 물질에 가장 중요하다.
회절 대조는 곡물의 특정한 결정학적 방향 때문에 발생한다.그러한 경우에 결정체는 소위 브래그 상태에 있는데, 원자 평면에 의해 산란 가능성이 높은 방향으로 방향을 잡는다.따라서 회절 대비는 다결정 샘플에서 결정의 방향에 대한 정보를 제공한다.회절 대조가 존재하는 경우, 그 대조는 질량 또는 두께의 변화로 해석될 수 없다.
회절 대비

샘플은 회절 대비를 나타낼 수 있으며, 여기서 전자 빔은 Bragg 산란을 겪으며, 결정 샘플의 경우 전자를 후방 초점면의 이산 위치로 분산시킨다.후방 초점 평면에 개구부 배치, 즉 목표 개구부에 의해 원하는 Bragg 반사를 선택(또는 제외)할 수 있으므로 선택된 반사까지 전자가 산란하게 하는 샘플의 일부만 영상 장치에 투영된다.
선택한 반사경에 비파괴 빔(렌즈의 초점에서 위로 나타날)이 포함되지 않은 경우, 선택한 피크까지 산란하는 샘플이 없는 곳이면 어디든 영상이 어둡게 나타나기 때문에 표본이 없는 부위가 어둡게 나타난다.이것은 다크 필드 이미지로 알려져 있다.
현대의 TEM은 사용자가 특정한 회절 조건을 얻기 위해 시료를 각도로 기울일 수 있도록 하는 시료 홀더가 장착되는 경우가 많으며, 시료 위에 놓인 구멍은 시료에 들어가는 특정 방향으로 회절될 전자를 사용자가 선택할 수 있게 한다.
이 방법의 적용은 결정에서 격자 결함의 식별을 포함한다.표본의 방향을 신중하게 선택함으로써 결함의 위치를 결정하는 것뿐만 아니라 존재하는 결함의 유형을 결정하는 것도 가능하다.표본이 특정 평면이 가장 강한 확산각(Bragg Angle)에서 약간만 기울어지도록 방향을 잡는 경우("Bragg Angle"로 국소적으로 평면을 Bragg 각도로 기울이는 결정 평면의 왜곡은 특히 강한 대조 변화를 일으킬 것이다.그러나 결정을 Bragg 각도로 기울이지 않는 원자의 변위(즉, 결정면에 평행한 변위)만 생성하는 결함은 강한 대비를 일으키지 않을 것이다.[44]
위상 대비
결정 구조는 위상 대비라고도 알려진 고해상도 전자현미경 검사(HRTEM)로도 연구될 수 있다.자기장 방출원과 균일한 두께의 시료를 사용할 때 전자파의 위상 차이로 인해 영상이 형성되는데, 이는 시료의 상호작용에 의해 발생한다.[43]이미지 형성은 들어오는 전자 빔의 복잡한 계수에 의해 주어진다.이와 같이 화면과 부딪히는 전자의 수에 따라 이미지가 좌우되는 것이 아니라 위상 대비 영상의 직접 해석이 더욱 복잡해진다.그러나 이 효과는 복잡한 위상 검색 기법에서와 같이 표본에 대한 더 많은 정보를 제공하도록 조작될 수 있기 때문에 유리하게 사용될 수 있다.
회절
앞에서 말한 바와 같이 영상면이 아닌 렌즈의 백초점면이 영상장치에 놓이도록 마그네틱 렌즈를 조정함으로써 회절 패턴을 발생시킬 수 있다.얇은 결정 샘플의 경우, 이것은 단일 결정의 경우 점의 패턴으로 구성되는 이미지를 생성하거나, 다결정 또는 비정형 고체 물질의 경우 일련의 고리로 구성된다.단일 결정 케이스의 경우 회절 패턴은 시료의 방향과 전자 빔에 의해 조명되는 시료의 구조에 따라 달라진다.이 이미지는 조사자에게 결정의 공간 그룹 대칭과 빔 경로에 대한 결정의 방향에 대한 정보를 제공한다.이것은 일반적으로 어떤 정보도 사용하지 않고 회절점이 나타나는 위치와 관찰된 이미지 대칭만 사용한다.
회절 패턴은 큰 동적 범위를 가질 수 있으며, 결정 샘플의 경우 CCD에 의해 기록 가능한 강도보다 더 큰 강도를 가질 수 있다.이와 같이 TEM에는 필름이 일회용 검출기이기 때문에 이러한 이미지를 획득하기 위한 목적으로 필름 카트리지를 여전히 장착할 수 있다.

영상이 시료 두께와 방향, 객관적 렌즈 탈피, 구면 및 색도 이상 등 여러 요인에 민감하기 때문에 점 위치 이상으로 회절 패턴을 분석하는 것은 복잡할 수 있다.격자 영상에 나타난 대조의 정량적 해석은 가능하지만, 본질적으로 복잡하고 전자 다슬라이스 분석과 같은 광범위한 컴퓨터 시뮬레이션과 분석이 필요할 수 있다.[45]
결정 격자 내의 복수 회절에서 기쿠치 선과 같은 현상이 발생하는 회절면에서 보다 복잡한 행동도 가능하다.전자 빔을 샘플 표면의 미세한 프로브에 집중시킴으로써 비병렬, 즉 수렴, 전자 파선이 생성되는 수렴 빔 전자 회절(CBED)에서 수렴 빔의 상호작용은 샘플 두께와 같은 구조적 데이터를 넘어서는 정보를 제공할 수 있다.
전자 에너지 손실 분광학(EELS)
전자 에너지 손실 분광기(EELS)의 첨단 기술을 사용하여, 적절히 장착된 TEM의 경우, 전자들은 EILLE 분광기라고 알려진 자기 부문 기반 장치를 사용하여 속도(운동 에너지, 따라서 빔 에너지로부터의 에너지 손실과 밀접한 관련이 있음)에 근거한 스펙트럼으로 분리될 수 있다.이러한 장치들은 전자가 샘플과 상호작용한 방식과 연관될 수 있는 특정한 에너지 값을 선택할 수 있게 한다.예를 들어, 표본의 다른 원소들은 표본 다음에 빔에 다른 전자 에너지를 발생시킨다.이것은 일반적으로 색채 이상을 초래하지만, 예를 들어, 이 효과는 전자와 전자가 상호작용하는 동안 원자 전환에 기초하여 원소 구성에 대한 정보를 제공하는 이미지를 생성하는 데 사용될 수 있다.[46]
뱀장어 분광기는 분광 모드와 영상 모드 모두에서 작동할 수 있어 탄성적으로 산란된 빔을 분리하거나 제거할 수 있다.많은 비탄성 산란 영상에 대해 조사자가 관심을 갖지 않을 수 있는 정보가 포함되어 관측 가능한 관심 신호를 감소시키므로, 뱀장어 영상을 사용하여 원하지 않는 구성 요소를 거부함으로써 밝은 장과 회절 모두를 포함하여 관찰된 영상의 대비를 향상시킬 수 있다.
3차원 영상
TEM 시료 홀더는 일반적으로 원하는 각도로 시료의 회전을 허용하므로 빔에 수직인 축을 따라 시료의 각도를 회전시켜 동일한 시료의 다중 뷰를 얻을 수 있다.일반적으로 1° 단위로 다른 각도에서 단일 TEM 샘플의 여러 영상을 촬영함으로써 "틸트 영상 시리즈"로 알려진 일련의 영상을 수집할 수 있다.이 방법론은 1970년대에 월터 호페에 의해 제안되었다.순수하게 흡수 대비 조건에서 이 영상 세트를 사용하여 샘플의 3차원 표현을 구성할 수 있다.[48]
재구성은 2단계 프로세스에 의해 수행되며, 첫 번째 영상은 샘플 위치의 오류를 설명하기 위해 정렬된다. 이러한 오류는 진동이나 기계적 이동으로 인해 발생할 수 있다.[49]정렬 방법은 이러한 오류를 수정하기 위해 자기 상관 방법과 같은 영상 등록 알고리즘을 사용한다.둘째로, 필터링된 백 투영과 같은 재구성 알고리즘을 사용하여 정렬된 영상 슬라이스를 2차원 영상 집합j I(x, y)에서 단일 3차원 영상 I'(jx, y, z)로 변환할 수 있다.이 3차원 이미지는 형태학적 정보가 필요할 때 특히 관심이 있으며, 데이터를 분석하기 위해 이소서페이스와 데이터 슬라이싱과 같은 컴퓨터 알고리즘을 사용하여 추가 연구를 수행할 수 있다.
TEM 샘플은 일반적으로 180° 회전할 때 볼 수 없기 때문에 관측된 영상은 일반적으로 데이터의 "결측 쐐기 누락"에 시달리며, 푸리에 기반한 백 투영 방법을 사용할 경우 3차원 재구성에서 확인 가능한 주파수 범위가 감소한다.[48]다축 기울기(직교 방향으로 만들어진 동일한 시료의 두 기울기 시리즈)와 원뿔 단층촬영(시료를 먼저 주어진 고정 각도로 기울인 다음 시료 격자 평면에서 한 번의 완전한 회전을 통해 동일한 각도 회전 증분으로 영상촬영)과 같은 기계적 다듬기를 사용하여 시료를 제한할 수 있다.관측된 표본 형태학에 대한 결측 데이터의 결합.초집중 이온빔 밀링(milling)을 사용하여 TEM에서 표적렌즈의 폴 피스 안에서 180° 회전하는 시료와 전용 축 단층촬영 홀더를 사용하는 새로운 기법이[50] 제안되었다.이러한 배열을 사용하면 쐐기 누락 없이 정량적인 전자 단층촬영이 가능하다.[51]또한 수집된 데이터를 개선할 수 있는 수치적 기법이 존재한다.
위에서 언급한 모든 방법에는 주어진 시료장의 기울기 시리즈를 기록하는 것이 포함된다.이것은 불가피하게 샘플을 통한 반응성 전자들의 높은 선량의 합과 기록 중 미세한 디테일이 동반 파괴되는 결과를 초래한다.따라서 저선량(최소선량) 이미징 기술은 이러한 효과를 완화하기 위해 정기적으로 적용된다.저선량 이미징은 광학 축에서 멀리 떨어진 조명과 영상 영역을 동시에 꺾어 기록할 영역(고선량 영역)에 인접한 영역을 영상화하는 방식으로 수행된다.이 영역은 기울기 동안 중심에 유지되고 녹화 전에 다시 집중된다.녹화 중에는 관심 영역이 영상 촬영에 필요한 기간 동안만 전자 빔에 노출되도록 편향된 부분을 제거한다.이 기법의 개선(경사진 기질 필름에 놓여 있는 물체의 경우)은 포커스를 위해 두 개의 대칭적인 오프축 영역을 가진 다음, 저선량 관심 영역을 기록하기 전에 두 개의 고선량 포커스 값의 평균으로 포커스를 설정하는 것이다.
단일 입자 분석이라고 하는 이 방법의 비토모그래픽 변형은 서로 다른 방향에서 복수의 (희망적으로) 동일한 물체의 영상을 사용하여 3차원 재구성에 필요한 영상 데이터를 생성한다.객체에 유의한 선호 방향이 없는 경우, 이 방법은 단층 촬영 방법에 수반되는 데이터 웨지(또는 원뿔) 누락이나 과도한 방사선 투약으로 고통받지는 않지만, 이미징된 다른 객체를 하나의 안정적인 오비제에서 생성된 3D 데이터가 발생한 것처럼 처리할 수 있다고 가정한다.t
시료준비
TEM의 샘플 준비는 복잡한 절차가 될 수 있다.[52]TEM 시료는 기존 TEM의 두께가 100나노미터 미만이어야 한다.중성자나 X-Ray 방사선과 달리 빔의 전자는 샘플과 쉽게 상호작용하는데, 이는 원자 번호 제곱(Z2)과 함께 대략적으로 증가하는 효과다.[16]고품질 샘플은 샘플을 통해 이동하는 전자의 평균 자유 경로에 버금가는 두께를 가질 것이며, 이는 수십 나노미터에 불과할 수 있다.TEM 시료의 준비는 분석 대상 재료와 시료에서 얻을 정보의 유형에 한정된다.
분말 물질, 작은 유기체, 바이러스 또는 나노튜브와 같이 전자에 투명할 만큼 작은 치수를 가진 물질은 시료를 함유한 희석 시료를 지지 그리드의 필름에 적층함으로써 빠르게 준비할 수 있다.생물학적 시료는 검체실의 높은 진공 상태를 견디고 전자 투명 얇은 부분으로 조직을 절단할 수 있도록 수지에 내장할 수 있다.생물학적 샘플은 박테리아와 바이러스에 대한 천왕라일 아세테이트와 같은 음극성 물질을 사용하여 얼룩질 수 있거나, 내장된 섹션의 경우 시료가 오스뮴 테트록시드를 포함한 중금속으로 얼룩질 수 있다.표본을 유리 얼음 속에 넣은 후 액체 질소 온도에서 번갈아 보관할 수 있다.[53]재료 과학과 야금학에서 시료는 보통 높은 진공 상태를 견딜 수 있지만, 여전히 얇은 호일로 준비하거나 시료의 일부가 빔이 침투할 수 있을 정도로 얇게 식각되어야 한다.재료 두께의 제약은 재료가 구성되는 원자의 산란 단면에 의해 제한될 수 있다.
티슈 단면화
생물학적 조직은 종종 수지 블록에 박혀 있다가 극초단파에서 100nm 미만으로 얇아진다.수지 블록은 유리나 다이아몬드 칼 가장자리를 지나갈 때 골절된다.[54]이 방법은 조직 초저구조를 관찰할 수 있는 얇고 최소한 변형된 샘플을 얻기 위해 사용된다.알루미늄과 같은 무기체 검체는 코팅 유리, 사파이어 또는 더 큰 앵글 다이아몬드 칼을 사용하여 이러한 방식으로 분할된 레진과 울트라틴에 삽입될 수 있다.[55]TEM에서 볼 때 샘플 표면에서 충전물이 쌓이지 않도록 조직 샘플은 탄소 등 전도성 물질의 얇은 층으로 코팅해야 한다.
검체 얼룩
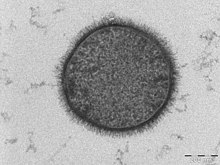
생물조직의 TEM 샘플은 대비를 강화하기 위해 높은 원자 번호 얼룩이 필요하다.얼룩은 빔 전자를 흡수하거나 전자 빔의 일부를 산란시키고 그렇지 않으면 영상 시스템에 투사된다.Osmium, 납, 우라늄 또는 금(면역골드 라벨 표시)과 같은 중금속의 화합물을 TEM 관측 전에 원하는 세포나 단백질 영역에서 전자 밀도 원자를 선택적으로 표본에 침전시키는 데 사용할 수 있다.이 과정은 중금속이 특정 생물조직과 세포구조에 어떻게 결합하는지에 대한 이해를 필요로 한다.[56]
기계식 밀링
기계적인 광택은 TEM에서 이미징을 위한 샘플을 준비하는 데도 사용된다.관심 영역에 걸쳐 지속적인 샘플 두께를 보장하려면 고품질로 연마해야 한다.다이아몬드 또는 입방 보론 니트리드 광택화 화합물을 광택 최종 단계에서 검체 두께의 변화로 인해 대조 변동을 일으킬 수 있는 스크래치를 제거하기 위해 사용할 수 있다.기계식 밀링 작업을 주의 깊게 한 후에도 최종 단계 박리를 수행하기 위해서는 이온 에칭과 같은 추가적인 미세한 방법이 필요할 수 있다.
케미컬 에칭
특정 시료는 화학 식각, 특히 금속 시료를 사용하여 준비할 수 있다.이러한 샘플은 TEM 관측을 위해 샘플을 준비하기 위해 산과 같은 화학적 식각제를 사용하여 얇게 만든다.얇아지는 과정을 제어하는 장치는 운영자가 시료를 통과하는 전압이나 전류를 제어할 수 있으며, 시료가 충분한 광학적 투명도 수준으로 얇아졌을 때를 감지하는 시스템을 포함할 수 있다.
이온 에칭
이온 에칭은 매우 미세한 양의 물질을 제거할 수 있는 스퍼터링 공정이다.이것은 다른 방법으로 닦은 시료의 마감 광택을 수행하는 데 사용된다.이온 에칭은 전기장을 통과하는 불활성 가스를 사용해 샘플 표면으로 향하는 플라즈마 스트림을 생성한다.아르곤과 같은 가스의 가속 에너지는 일반적으로 몇 킬로볼트다.표본 표면의 고른 광택을 촉진하기 위해 표본을 회전시킬 수 있다.그러한 방법의 스퍼터링 속도는 시간당 수십 마이크로미터의 순서에 따라, 그 방법은 극히 미세한 광택만으로 제한된다.
아르곤 가스에 의한 이온 에칭은 MTJ 스택 구조를 특정 레이어로 철할 수 있다는 것이 최근에 증명되었고, 이 구조물은 원자적으로 해결되었다.단면이 아닌 평면뷰로 촬영한 TEM 이미지는 MTJ 내의 MgO 레이어가 장치의 특성을 감소시킬 수 있는 많은 수의 곡물 경계를 포함하고 있음을 보여준다.[57]
이온 밀링
보다 최근에 집중된 이온 빔 방법이 샘플을 준비하는 데 사용되었다.FIB는 대형 시료에서 TEM 검사를 위해 얇은 시료를 준비하는 비교적 새로운 기법이다.FIB는 마이크로 머신 샘플에 매우 정밀하게 사용될 수 있기 때문에 반도체나 금속과 같은 샘플의 특정 관심 영역에서 매우 얇은 막을 밀링할 수 있다.비활성 기체 이온 스퍼터링과 달리, FIB는 훨씬 더 에너지 넘치는 갈륨 이온을 사용하고 갈륨 이식을 통해 물질의 구성이나 구조를 바꿀 수 있다.[58]
나노와이어 어시스턴트 트랜스퍼
전자현미경(TEM) 검체(라멜레, 박막 및 기타 기계적으로 민감한 검체)에 대한 응력과 벤딩의 최소 도입을 위해 초점식 이온빔(FIB) 내부에서 이송할 때, 유연 금속 나노와이어를 전형적으로 단단한 마이크로모니플레이터에 부착할 수 있다.
이 방법의 주요 장점은 샘플 준비 시간을 크게 단축(저보 전류에서 나노와이어의 빠른 용접 및 절단), 응력 유발 휨, Pt 오염, 이온 빔 손상 최소화 등이다.[59]이 기법은 특히 현장 전자 현미경 샘플 준비에 적합하다.
복제
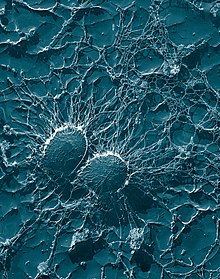
샘플은 또한 셀룰로오스 아세테이트 필름을 사용하여 복제될 수 있으며, 이후 백금과 같은 헤비메탈로 코팅된 필름, 원래 필름의 용해 및 TEM에 이미징된 복제 필름을 사용할 수 있다.복제 기법의 변형들은 재료와 생물학적 샘플 모두에 사용된다.재료 과학에서 일반적인 용도는 금속 합금의 신선한 파단 표면을 검사하는 것이다.
수정
TEM의 기능은 추가 단계와 검출기에 의해 더욱 확장될 수 있으며, 때로는 동일한 현미경에 통합될 수 있다.
스캐닝 TEM
TEM은 적절한 검출기와 결합되었을 때, 영상을 형성하기 위해 샘플 전체에 수렴 빔을 발사하는 시스템을 추가함으로써 스캐닝 전송 전자현미경(STEM)으로 수정될 수 있다.스캐닝 코일은 빔의 정전기 이동과 같이 빔을 비껴가기 위해 사용되며, 여기서 빔은 직접 전자 계수기의 역할을 하는 패러데이 컵과 같은 전류 검출기를 사용하여 수집된다.전자 카운트를 스캐닝 빔의 위치("프로브"로 알려져 있음)와 상관시켜 빔의 전송된 성분을 측정할 수 있다.비전송 구성부품은 빔 기울기 또는 환형 암흑장 검출기를 사용하여 얻을 수 있다.
기본적으로 TEM과 STEM은 헬름홀츠 상호주의를 통해 연결된다.STEM은 전자 빔의 이동 방향에 따라 전자 소스와 관측 지점이 전환된 TEM이다.오른쪽 그림의 레이 다이어그램을 참조하십시오.STEM 기기는 TEM과 같은 광학 설정에 효과적으로 의존하지만, TEM 작동 중 전자의 이동 방향(또는 후진 시간)을 플립하여 작동한다.STEM은 TEM에서와 같이 탐지된 전자를 제어하기 위해 개구부를 사용하는 대신 사용자가 포착하고자 하는 전자에 따라 조절될 수 있는 수집 각도를 가진 다양한 검출기를 사용한다.
저전압 전자현미경
저전압 전자현미경(LVEM)은 5~25kV 사이의 비교적 낮은 전자 가속 전압에서 작동된다.이들 중 일부는 SEM, TEM, STEM을 하나의 소형 기기로 조합한 것이 될 수 있다.저전압은 특히 생물 검체에 중요한 영상 대비를 증가시킨다.이와 같은 대비의 증가는 얼룩을 제거하거나 현저하게 감소시킨다.TEM, SEM 및 STEM 모드에서 몇 nm의 분해능이 가능하다.전자빔의 낮은 에너지는 영구 자석을 렌즈로 사용할 수 있어 냉각이 필요 없는 미니어처 기둥을 사용할 수 있다는 것을 의미한다.[60][61]
크라이오템
극저온전송전자현미경(Cryo-TEM)은 액체 질소나 액체 헬륨 온도에서 시료를 유지할 수 있는 시료 홀더가 있는 TEM을 사용한다.이를 통해 개별 분자나 고분자 조립체를 이미징하기 위해 선호되는 준비 기술인 유리 얼음에서 준비된 영상 시료,[62] 유리화된 고체-전자 인터페이스 영상,[63] 유황 등 상온에서 고진공에서 휘발성이 있는 물질의 영상촬영이 가능하다.[64]
환경/현장 TEM
현장 실험도 TEM에서 차등 펌프된 샘플 챔버 또는 특수 홀더를 사용하여 수행할 수 있다.[65]현장실험의 종류로는 액체상 전자현미경을 이용한 나노소재,[66] 생물학적 시료, 화학반응 연구,[67][68] 재료변형시험 등이 있다.[69]
고온 현장 TEM
난방을 하는 동안 많은 위상 변환이 일어난다.또한 다른 확산 관련 프로세스와 함께 응고 및 곡물 증가는 상승된 온도에서 더 빠르게 발생하며, 운동학적 특성이 개선되어 합리적인 시간 범위 내에서 전송 전자 현미경 검사에 따른 관련 현상을 관측할 수 있다.이는 또한 상승된 온도에서 발생하여 사라지거나 이전 시료에서 균일하게 보존되지 않는 현상을 관측할 수 있게 한다.
고온 TEM은 고온 홀더의 역학에서 다루어야 하는 다양한 추가 과제를 도입하는데 여기에는 표류 보정, 온도 측정, 더 복잡한 홀더의 비용으로 공간 분해능 감소 등이 포함된다.[70][71]
TEM에서 샘플 드리프트는 룸과 홀더 사이의 온도 차이에 선형 비례한다.현대 홀더에서 1500C의 높은 온도에서 표본은 상당한 표류 및 수직 변위(거품)를 경험할 수 있으며, 지속적인 초점 또는 단계 조정이 필요하며 분해능 손실과 기계적 표류를 유발할 수 있다.[72][73]개별 실험실과 제조업체는 검체실의[70][73][74] 예측 온도에 기초한 열 드리프트를 교정하기 위해 첨단 냉각 시스템과 결합된 소프트웨어를 개발했다. 이러한 시스템은 검체 이동이 안정화되는 데 종종 30분에서 여러 시간이 걸린다.상당한 진전이 있었지만, 상승된 온도에서 표류를 설명하기 위한 범용 TEM 부착은 이루어지지 않았다.[71][72][74]
이러한 전문화된 홀더들 중 많은 이들이 추가로 해결해야 할 과제는 국소 샘플 온도를 아는 것이다.많은 고온 홀더는 텅스텐 필라멘트를 사용하여 샘플을 국소적으로 가열한다.[70][73]열전대를 가진 용해로 히터(W 와이어)의 온도 모호성은 용해로와 TEM 그리드 사이의 열 접촉에서 발생한다. 용해로와 TEM 그리드의 온도 구배는 다른 표본과 그리드 재료의 열 전도도 변화에 의해 야기된다.[71]상업용과 실험실용 홀더 모두 다른 홀더로 온도 교정을 만드는 다른 방법을 사용할 수 있다.가탄과 같은 제조업체는 IR 화로메트리를 사용하여 전체 샘플에 대한 온도 구배를 측정한다.보다 나은 보정 방법은 전자 투명 윈도우에서 Si 분말의 국소 온도를 측정하고 IR 화염을 정량적으로 보정하는 라만 분광법이다.이러한 측정은 5% 이내의 정확도를 보장한다.연구소는 또한 상업용 보유자에 대한 자체 교정을 수행했다.NIST의 연구원들은 Raman 분광법을 활용하여 TEM 그리드에 있는 샘플의 온도 프로파일을 매핑하고 연구를 강화하기 위해 매우 정밀한 측정을 달성했다.[75]이와 유사하게 독일의 한 연구 단체는 X선 회절을 이용하여 온도 변화에 따른 격자 간격의 약간의 이동을 측정하여 홀더의 정확한 온도를 역산하였다.이 과정에는 세심한 교정과 정확한 TEM 광학장치가 필요했다.[76]기타 예로는 가스 밀도의 변화를 이용하여 국부 온도를 측정하기 위한 장어의 사용,[77] 저항성 변화 등이 있다.[71]
구면 이상을 객관적 렌즈로 보정할 때 TEM의 최적 분해능이 달성된다.그러나 대부분의 TEM의 기하학적 구조로 인해 대형 현장 홀더를 삽입하려면 사용자가 목표 렌즈를 절충하고 구형 이상을 견뎌야 한다.따라서 폴피스 간격의 폭과 0.1nm 이하의 공간 분해능 사이에 절충이 있다.여러 기관의 연구 단체들은 5mm 극 조각 간격의 0.05nm 해상도를 달성하기 위해 단색화기를 사용함으로써 구면 이상을 극복하려고 노력해왔다.[78]
In-Situ Mechanical TEM
TEM 기둥 내부의 기계적 시험은 목걸이와 같이 샘플을 질질 끌면서 발생하는 현상을 이해하는 데 도움이 될 수 있다.여러 가지 기계적 시험 방법은 TEM 내부에서 수행할 수 있다.현재 기기는 장력, 압축, 깎기 및 굽힘 상태에서 샘플을 배치할 수 있다.[79]이 기술의 선구자 중 하나는 닥터였다.1958년 TEM 내부에서 장력 시험을 실시한 하인츠 G.F. Wilsdorf.[80]그들은 샘플을 작동시키고 스트레스를 받기 위해 나사를 사용했지만, 이 첫 번째 테스트는 아직 물질을 압축하거나 구부릴 수 없었다.현대적인 TEM 샘플 홀더는 상황 연구에서 단순한 장력을 넘어 다중 기계적 테스트를 수행하도록 개발되었다.[79]마이크로 전자기계 시스템(MEM)은 샘플 홀더의 기계적 실험 수행 능력을 더욱 강화했다.[81]TEM 샘플 취급 시 높은 분해능을 제공하여 더 나은 결과를 도출한다.한 박사는 2017년 샘플에 대한 단순한 질적 이해를 넘어 MEMs 홀더를 이용해 기계적 스트레스 하에서 질적 조사를 하는 방법을 개발했다.[82]시스텍 TEM은 또한 샘플 구조에 대한 더 많은 정보를 얻기 위해 뱀장어, XEDS와 같은 다른 표준 TEM 관행과 결합될 수 있다.[83]
일탈 보정 TEM
현대 연구 TEM은 이미지 왜곡을 줄이기 위해 일탈 보정기를 포함할 수 있다.[21]입사 전자빔의 에너지 확산량을 0.15 eV 미만으로 감소시키는 입사 빔 단색화기도 사용할 수 있다.[21]일탈 보정 TEM 제조사로는 JEOL, 히타치 하이테크놀로지, FEI 컴퍼니, NION 등이 있다.
초고속 다이내믹 TEM
펄스 전자를 사용하면 전자 검출기의 판독 속도를 훨씬 넘어 시간 분해능에 도달할 수 있다.펄스는 레이저 트리거 광 방출이[84] 가능하도록 전자 소스를 수정하거나 초고속 빔 블랭커를 설치하여 생성할 수 있다.[85]이 접근방식은 스트로보시 펌프-프로브 조명을 사용할 때 초고속 전송 전자현미경이라고 불린다: 이미지는 전자 펄스의 도착과 샘플의 흥분 사이에 일정한 시간 지연을 갖는 많은 전자 펄스의 축적에 의해 형성된다.한편, 각각의 펄스로부터 하나의 이미지를 형성하기 위해 충분한 수의 전자를 가진 전자 펄스의 단일 또는 짧은 시퀀스의 사용을 동적 전송 전자 현미경이라고 한다.수백 펨토초까지의 시간적 분해능과 쇼트키 필드 방출원에서 이용할 수 있는 것과 유사한 공간 분해능은 초고속 TEM에서 가능하지만,[86] 이 기술은 수백만 번 재현될 수 있는 가역적 프로세스만 이미지화할 수 있다.동적 TEM은 되돌릴 수 없는 프로세스를 수십 나노초, 수십 나노미터까지 해결할 수 있다.[87]
제한 사항
TEM 기법에는 여러 가지 단점이 있다.많은 재료들이 전자 투명할 정도로 얇은 샘플을 생산하기 위해 광범위한 샘플 준비를 필요로 하는데, 이것은 TEM 분석을 상대적으로 시간이 많이 걸리는 과정으로 샘플 처리량이 낮다.표본의 구조는 또한 준비 과정에서 변경될 수 있다.또한 시야가 상대적으로 좁아 분석된 지역이 전체 표본의 특성이 아닐 가능성도 제기된다.특히 생물학적 물질의 경우 샘플이 전자빔에 의해 손상될 가능성이 있다.
분해능 한계

TEM에서 얻을 수 있는 분해능의 한계는 여러 가지 방법으로 설명할 수 있으며, 일반적으로 현미경의 정보 한계라고 한다.일반적으로 사용되는 한 가지 값은[citation needed] 조영 전달 함수의 컷오프 값이며, 현미경 광학으로 물체 평면에 있는 물체의 공간 주파수 재현을 정의하기 위해 보통 주파수 영역에서 인용되는 함수다.전달함수에 대한 컷오프 주파수 q는max 다음과 같은 방정식으로 근사할 수 있다. 여기서 C는s 구형 이상 계수, λ은 전자 파장이다.[41]
200 kV 현미경의 경우 부분 보정된 구형 이상("3차 순서"까지)과 C 값이s 1µm인 경우 이론적 컷오프 값은 오후 1/qmax = 42pm일 수 있다.[89][41]교정기가 없는 동일한 현미경은 Cs = 0.5 mm이며 따라서 200-pm 컷오프를 가질 수 있다.[89]구면 이상은 "거부-수정" 현미경에서 세 번째 또는 다섯 번째 순서로 억제된다.그러나 이들의 분해능은 목표 렌즈 시스템에서 전자 소스 기하학 및 밝기 및 색도 이상에 의해 제한된다.[21][90]
대비 전달 함수의 주파수 영역 표현은 종종 진동 특성을 가질 수 있으며,[91] 이는 목표 렌즈의 초점 값을 조정하여 조정할 수 있다.이 진동성은 어떤 공간 주파수는 현미경에 의해 충실하게 이미징되는 반면 다른 공간 주파수는 억제된다는 것을 암시한다.공간 주파수가 다른 복수의 영상을 조합해 초점 직렬 재구성 등의 기법을 활용해 TEM의 해상도를 제한적으로 개선할 수 있다.[41]대비 전달 함수는 어느 정도까지는 무정형 탄소 같은 무정형 물질의 영상을 푸리에가 변환하는 기법과 같은 기법을 통해 실험적으로 근사하게 추정될 수 있다.
보다 최근에, 이상 교정기 설계의 발전은 구면 이상을[92] 줄일 수 있었고 5,000만 배 이상의 배율에서 0.5 Engströms(50pm)[90] 미만의 분해능을 달성할 수 있었다.[93]향상된 분해능으로 리튬배터리 소재에서 리튬원자와 같이 전자를 덜 효율적으로 산란시키는 가벼운 원자의 영상촬영이 가능하다.[94]물질 내 원자의 위치를 결정할 수 있는 능력은 HRTEM을 이기종 촉매와 전자 및 광전자용 반도체 소자 개발 등 여러 분야에서 나노기술 연구개발에 없어서는 안 될 도구로 만들었다.[95]
참고 항목
- 극저온 현미경 검사
- 전자 회절
- 전자 에너지 손실 분광학(EELS)
- 에너지 필터링 전송 전자 현미경(EFTEM)
- 고해상도 전송전자현미경(HRTEM)
- 저전압 전자 현미경(LVEM)
- 전자의 회절
- 콘코컬 전자현미경 검사
참조
- ^ "Viruses". users.rcn.com.
- ^ a b "The Nobel Prize in Physics 1986, Perspectives – Life through a Lens". nobelprize.org.
- ^ 자외선 현미경(2010).브리태니커 백과사전.2010년 11월 20일 브리태니커 백과사전 온라인에서 검색
- ^ a b c Ernst Ruska (January 1980). The Early Development of Electron Lenses and Electron Microscopy. Applied Optics. Vol. 25. Translated by T. Mulvey. p. 820. Bibcode:1986ApOpt..25..820R. ISBN 978-3-7776-0364-3.
- ^ Plücker, J. (1858). "Über die Einwirkung des Magneten auf die elektrischen Entladungen in verdünnten Gasen" [On the effect of a magnet on the electric discharge in rarified gases]. Poggendorffs Annalen der Physik und Chemie. 103 (1): 88–106. Bibcode:1858AnP...179...88P. doi:10.1002/andp.18581790106.
- ^ "Ferdinand Braun, The Nobel Prize in Physics 1909, Biography". nobelprize.org.
- ^ Rudenberg, Reinhold (May 30, 1931). "Configuration for the enlarged imaging of objects by electron beams". Patent DE906737.
- ^ Broglie, L. (1928). "La nouvelle dynamique des quanta". Électrons et Photons: Rapports et Discussions du Cinquième Conseil de Physique. Solvay.
- ^ "A Brief History of the Microscopy Society of America". microscopy.org.
- ^ "Dr. James Hillier, Biography". comdir.bfree.on.ca. Archived from the original on 2008-06-19. Retrieved 2008-09-09.
- ^ a b Hawkes, P., ed. (1985). The beginnings of Electron Microscopy. Academic Press. ISBN 978-0120145782.
- ^ a b "Ernst Ruska, Nobel Prize Lecture". nobelprize.org.
- ^ Crewe, Albert V; Isaacson, M.; Johnson, D. (1969). "A Simple Scanning Electron Microscope". Rev. Sci. Instrum. 40 (2): 241–246. Bibcode:1969RScI...40..241C. doi:10.1063/1.1683910.
- ^ Crewe, Albert V.; Wall, J.; Langmore, J. (1970). "Visibility of a single atom". Science. 168 (3937): 1338–1340. Bibcode:1970Sci...168.1338C. doi:10.1126/science.168.3937.1338. PMID 17731040. S2CID 31952480.
- ^ Meyer, Jannik C.; Girit, C. O.; Crommie, M. F.; Zettl, A. (2008). "Imaging and dynamics of light atoms and molecules on graphene" (PDF). Nature. 454 (7202): 319–22. arXiv:0805.3857. Bibcode:2008Natur.454..319M. doi:10.1038/nature07094. PMID 18633414. S2CID 205213936. Retrieved 3 June 2012.
- ^ a b Fultz, B & Howe, J (2007). Transmission Electron Microscopy and Diffractometry of Materials. Springer. ISBN 978-3-540-73885-5.
- ^ Murphy, Douglas B. (2002). Fundamentals of Light Microscopy and Electronic Imaging. New York: John Wiley & Sons. ISBN 9780471234296.
- ^ Champness, P. E. (2001). Electron Diffraction in the Transmission Electron Microscope. Garland Science. ISBN 978-1859961476.
- ^ Hubbard, A (1995). The Handbook of surface imaging and visualization. CRC Press. ISBN 978-0-8493-8911-5.
- ^ Egerton, R (2005). Physical principles of electron microscopy. Springer. ISBN 978-0-387-25800-3.
- ^ a b c d e Rose, H H (2008). "Optics of high-performance electron Microscopes". Science and Technology of Advanced Materials. 9 (1): 014107. Bibcode:2008STAdM...9a4107R. doi:10.1088/0031-8949/9/1/014107. PMC 5099802. PMID 27877933.
- ^ "The objective lens of a TEM, the heart of the electron microscope". rodenburg.org.
- ^ a b Pogany, A. P.; Turner, P. S. (1968-01-23). "Reciprocity in electron diffraction and microscopy". Acta Crystallographica Section A. 24 (1): 103–109. Bibcode:1968AcCrA..24..103P. doi:10.1107/S0567739468000136. ISSN 1600-5724.
- ^ a b c Hren, John J; Goldstein, Joseph I; Joy, David C, eds. (1979). Introduction to Analytical Electron Microscopy (PDF). doi:10.1007/978-1-4757-5581-7. ISBN 978-1-4757-5583-1 – via SpringerLink.
- ^ a b Faruqi, A. R; Henderson, R. (2007-10-01). "Electronic detectors for electron microscopy". Current Opinion in Structural Biology. Carbohydrates and glycoconjugates / Biophysical methods. 17 (5): 549–555. doi:10.1016/j.sbi.2007.08.014. ISSN 0959-440X. PMID 17913494.
- ^ Henderson, R.; Cattermole, D.; McMullan, G.; Scotcher, S.; Fordham, M.; Amos, W. B.; Faruqi, A. R. (2007-02-01). "Digitisation of electron microscope films: Six useful tests applied to three film scanners". Ultramicroscopy. 107 (2): 73–80. doi:10.1016/j.ultramic.2006.05.003. ISSN 0304-3991. PMID 16872749.
- ^ a b c d Williams, D. & Carter, C. B. (1996). Transmission Electron Microscopy, Vol. 1 – Basics. Plenum Press. ISBN 978-0-306-45324-3.
- ^ Roberts, P. T. E.; Chapman, J. N.; MacLeod, A. M. (1982-01-01). "A CCD-based image recording system for the CTEM". Ultramicroscopy. 8 (4): 385–396. doi:10.1016/0304-3991(82)90061-4. ISSN 0304-3991.
- ^ Fan, G. Y.; Ellisman, M. H. (24 December 2001). "Digital imaging in transmission electron microscopy". Journal of Microscopy. 200 (1): 1–13. doi:10.1046/j.1365-2818.2000.00737.x. ISSN 0022-2720. PMID 11012823. S2CID 2034467.
- ^ a b McMullan, G.; Faruqi, A.R.; Henderson, R. (2016). "Direct Electron Detectors". Methods in Enzymology. Elsevier. 579: 1–17. doi:10.1016/bs.mie.2016.05.056. ISBN 978-0-12-805382-9. PMID 27572721.
- ^ Faruqi, A.R.; Henderson, R.; Pryddetch, M.; Allport, P.; Evans, A. (October 2006). "Erratum to: "Direct single electron detection with a CMOS detector for electron microscopy"". Nuclear Instruments and Methods in Physics Research Section A: Accelerators, Spectrometers, Detectors and Associated Equipment. 566 (2): 770. doi:10.1016/j.nima.2006.07.013. ISSN 0168-9002.
- ^ Ercius, P.; Caswell, T.; Tate, M.W.; Ercan, A.; Gruner, S.M.; Muller, D. (September 2005). "A Pixel Array Detector for Scanning Transmission Electron Microscopy". Microscopy and Microanalysis. 14 (S2): 806–807. doi:10.1017/s1431927608085711. ISSN 1431-9276. S2CID 137491811.
- ^ McMullan, G.; Faruqi, A.R.; Henderson, R.; Guerrini, N.; Turchetta, R.; Jacobs, A.; van Hoften, G. (18 May 2009). "Experimental observation of the improvement in MTF from backthinning a CMOS direct electron detector". Ultramicroscopy. 109 (9): 1144–1147. doi:10.1016/j.ultramic.2009.05.005. PMC 2937214. PMID 19541421.
- ^ Ruskin, Rachel S.; Yu, Zhiheng; Grigorieff, Nikolaus (1 November 2013). "Quantitative characterization of electron detectors for transmission electron microscopy". Journal of Structural Biology. 184 (3): 385–393. doi:10.1016/j.jsb.2013.10.016. PMC 3876735. PMID 24189638.
- ^ Rodenburg, J M. "The Vacuum System". rodenburg.org.
- ^ a b Ross, L. E, Dykstra, M (2003). Biological Electron Microscopy: Theory, techniques and troubleshooting. Springer. ISBN 978-0306477492.
- ^ a b Chapman, S. K. (1986). Maintaining and Monitoring the Transmission Electron Microscope. Royal Microscopical Society Microscopy Handbooks. Vol. 08. Oxford University Press. ISBN 978-0-19-856407-2.
- ^ Pulokas, James; Green, Carmen; Kisseberth, Nick; Potter, Clinton S.; Carragher, Bridget (1999). "Improving the Positional Accuracy of the Goniometer on the Philips CM Series TEM". Journal of Structural Biology. 128 (3): 250–256. doi:10.1006/jsbi.1999.4181. PMID 10633064.
- ^ Buckingham, J (1965). "Thermionic emission properties of a lanthanum hexaboride/rhenium cathode". British Journal of Applied Physics. 16 (12): 1821. Bibcode:1965BJAP...16.1821B. doi:10.1088/0508-3443/16/12/306.
- ^ a b Orloff, J, ed. (1997). Handbook of Electron Optics. CRC-press. ISBN 978-0-8493-2513-7.
- ^ a b c d Reimer, L; Kohl, H (2008). Transmission Electron Microscopy: Physics of Image Formation. Springer. ISBN 978-0-387-34758-5.
- ^ a b Cowley, J. M (1995). Diffraction physics. Elsevier Science B. V. ISBN 978-0-444-82218-5.
- ^ a b Kirkland, E (1998). Advanced computing in Electron Microscopy. Springer. ISBN 978-0-306-45936-8.
- ^ Hull, D. & Bacon, J (2001). Introduction to dislocations (4th ed.). Butterworth-Heinemann. ISBN 978-0-7506-4681-9.
- ^ Cowley, J. M.; Moodie, A. F. (1957). "The Scattering of Electrons by Atoms and Crystals. I. A New Theoretical Approach" (PDF). Acta Crystallographica. 199 (3): 609–619. doi:10.1107/S0365110X57002194.
- ^ Egerton, R. F. (1996). Electron Energy-loss Spectroscopy in the Electron Microscope. Springer. ISBN 978-0-306-45223-9.
- ^ Mast, Jan; Demeestere, Lien (2009). "Electron tomography of negatively stained complex viruses: application in their diagnosis". Diagnostic Pathology. 4: 5. doi:10.1186/1746-1596-4-5. PMC 2649040. PMID 19208223.
- ^ a b Frank, J, ed. (2006). Electron tomography: methods for three-dimensional visualization of structures in the cell. Springer. ISBN 978-0-387-31234-7.
- ^ Levin, B. D. A.; et al. (2016). "Nanomaterial datasets to advance tomography in scanning transmission electron microscopy". Scientific Data. 3: 160041. arXiv:1606.02938. Bibcode:2016NatSD...360041L. doi:10.1038/sdata.2016.41. PMC 4896123. PMID 27272459.
- ^ Kawase, Noboru; Kato, Mitsuro; Jinnai, Hiroshi; Jinnai, H (2007). "Transmission electron microtomography without the 'missing wedge' for quantitative structural analysis". Ultramicroscopy. 107 (1): 8–15. doi:10.1016/j.ultramic.2006.04.007. PMID 16730409.
- ^ Heidari, Hamed; Van den Broek, Wouter; Bals, Sara (2013). "Quantitative electron tomography: The effect of the three-dimensional point spread function". Ultramicroscopy. 135: 1–5. doi:10.1016/j.ultramic.2013.06.005. hdl:10067/1113970151162165141. PMID 23872036.
- ^ Cheville, NF; Stasko J (2014). "Techniques in Electron Microscopy of Animal Tissue". Veterinary Pathology. 51 (1): 28–41. doi:10.1177/0300985813505114. PMID 24114311.
- ^ Amzallag, Arnaud; Vaillant, Cédric; Jacob, Mathews; Unser, Michael; Bednar, Jan; Kahn, Jason D.; Dubochet, Jacques; Stasiak, Andrzej; Maddocks, John H. (2006). "3D reconstruction and comparison of shapes of DNA minicircles observed by cryo-electron microscopy". Nucleic Acids Research. 34 (18): e125. doi:10.1093/nar/gkl675. PMC 1635295. PMID 17012274.
- ^ Porter, K & Blum, J (1953). "A study in Microtomy for Electron Microscopy". The Anatomical Record. 117 (4): 685–710. doi:10.1002/ar.1091170403. PMID 13124776. S2CID 37311577.
- ^ Phillips (1961). "Diamond knife ultra microtomy of metals and the structure of microtomed sections". British Journal of Applied Physics. 12 (10): 554. Bibcode:1961BJAP...12..554P. doi:10.1088/0508-3443/12/10/308.
- ^ Alberts, Bruce (2008). Molecular biology of the cell (5th ed.). New York: Garland Science. ISBN 978-0815341116.
- ^ Bean, J. J.; Saito, M.; Fukami, S.; Sato, H.; Ikeda, S.; Ohno, H.; Ikuhara, Y.; Mckenna, K. P. (2017). "Atomic structure and electronic properties of MgO grain boundaries in tunnelling magnetoresistive devices". Scientific Reports. doi:10.1038/srep45594. ISSN 2045-2322.
- ^ Baram, M. & Kaplan W. D. (2008). "Quantitative HRTEM analysis of FIB prepared specimens". Journal of Microscopy. 232 (3): 395–405. doi:10.1111/j.1365-2818.2008.02134.x. PMID 19094016. S2CID 6487344.
- ^ Gorji, Saleh; Kashiwar, Ankush; Mantha, Lakshmi S; Kruk, Robert; Witte, Ralf; Marek, Peter; Hahn, Horst; Kübel, Christian; Scherer, Torsten (December 2020). "Nanowire facilitated transfer of sensitive TEM samples in a FIB". Ultramicroscopy. 219: 113075. doi:10.1016/j.ultramic.2020.113075. PMID 33035837. S2CID 222255773.
- ^ Nebesářová1, Jana; Vancová, Marie (2007). "How to Observe Small Biological Objects in Low-Voltage Electron Microscope". Microscopy and Microanalysis. 13 (3): 248–249. Bibcode:2007MiMic..13S.248N. doi:10.1017/S143192760708124X. S2CID 138891812. Retrieved 8 August 2016.
- ^ Drummy, Lawrence, F.; Yang, Junyan; Martin, David C. (2004). "Low-voltage electron microscopy of polymer and organic molecular thin films". Ultramicroscopy. 99 (4): 247–256. doi:10.1016/j.ultramic.2004.01.011. PMID 15149719.
- ^ Li, Z; Baker, ML; Jiang, W; Estes, MK; Prasad, BV (2009). "Rotavirus Architecture at Subnanometer Resolution". Journal of Virology. 83 (4): 1754–1766. doi:10.1128/JVI.01855-08. PMC 2643745. PMID 19036817.
- ^ M.J. Zachman; et al. (2016). "Site-Specific Preparation of Intact Solid–Liquid Interfaces by Label-Free In Situ Localization and Cryo-Focused Ion Beam Lift-Out". Microscopy and Microanalysis. 22 (6): 1338–1349. Bibcode:2016MiMic..22.1338Z. doi:10.1017/S1431927616011892. PMID 27869059.
- ^ Levin, B. D. A.; et al. (2017). "Characterization of Sulfur and Nanostructured Sulfur Battery Cathodes in Electron Microscopy Without Sublimation Artifacts". Microscopy and Microanalysis. 23 (1): 155–162. Bibcode:2017MiMic..23..155L. doi:10.1017/S1431927617000058. PMID 28228169. S2CID 6801783.
- ^ P.A. Crozier; T.W. Hansen (2014). "In situ and operando transmission electron microscopy of catalytic materials". MRS Bulletin. 40: 38–45. doi:10.1557/mrs.2014.304. hdl:2286/R.I.35693.
- ^ Kosasih, Felix Utama; Ducati, Caterina (May 2018). "Characterising degradation of perovskite solar cells through in-situ and operando electron microscopy". Nano Energy. 47: 243–256. doi:10.1016/j.nanoen.2018.02.055.
- ^ de Jonge, N.; Ross, F.M. (2011). "Electron microscopy of specimens in liquid". Nature Nanotechnology. 6 (8): 695–704. Bibcode:2003NatMa...2..532W. doi:10.1038/nmat944. PMID 12872162. S2CID 21379512.
- ^ F. M. Ross (2015). "Opportunities and challenges in liquid cell electron microscopy". Science. 350 (6267): 1490–1501. doi:10.1126/science.aaa9886. PMID 26680204.
- ^ Haque, M. A. & Saif, M. T. A. (2001). "In-situ tensile testing of nano-scale specimens in SEM and TEM". Experimental Mechanics. 42: 123. doi:10.1007/BF02411059. S2CID 136678366.
- ^ a b c Yaguchi, T.; Suzuki, M.; Watabe, A.; Nagakubo, Y.; Ueda, K.; Kamino, T. (2011-03-22). "Development of a high temperature-atmospheric pressure environmental cell for high-resolution TEM". Journal of Electron Microscopy. 60 (3): 217–225. doi:10.1093/jmicro/dfr011. ISSN 0022-0744.
- ^ a b c d Taheri, Mitra L.; Stach, Eric A.; Arslan, Ilke; Crozier, P.A.; Kabius, Bernd C.; LaGrange, Thomas; Minor, Andrew M.; Takeda, Seiji; Tanase, Mihaela; Wagner, Jakob B.; Sharma, Renu (November 2016). "Current status and future directions for in situ transmission electron microscopy". Ultramicroscopy. 170: 86–95. doi:10.1016/j.ultramic.2016.08.007. PMC 5100813. PMID 27566048.
- ^ a b van Omme, J. Tijn; Zakhozheva, Marina; Spruit, Ronald G.; Sholkina, Mariya; Pérez Garza, H. Hugo (September 2018). "Advanced microheater for in situ transmission electron microscopy; enabling unexplored analytical studies and extreme spatial stability". Ultramicroscopy. 192: 14–20. doi:10.1016/j.ultramic.2018.05.005.
- ^ a b c Saka, Hiroyasu; Kamino, Takeo; Ara, Shigeo; Sasaki, Katsuhiro (2008-02-01). "In Situ Heating Transmission Electron Microscopy". MRS Bulletin. 33 (2): 93–100. doi:10.1557/mrs2008.21. ISSN 1938-1425.
- ^ a b Zhang, Chao; Firestein, Konstantin L.; Fernando, Joseph F. S.; Siriwardena, Dumindu; Treifeldt, Joel E.; Golberg, Dmitri (2019-09-30). "Recent Progress of In Situ Transmission Electron Microscopy for Energy Materials". Advanced Materials. 32 (18): 1904094. doi:10.1002/adma.201904094. ISSN 0935-9648.
- ^ Picher, Matthieu; Mazzucco, Stefano; Blankenship, Steve; Sharma, Renu (2015-03-01). "Vibrational and optical spectroscopies integrated with environmental transmission electron microscopy". Ultramicroscopy. 150: 10–15. doi:10.1016/j.ultramic.2014.11.023. ISSN 0304-3991.
- ^ Niekiel, Florian; Kraschewski, Simon M.; Müller, Julian; Butz, Benjamin; Spiecker, Erdmann (2017-05-01). "Local temperature measurement in TEM by parallel beam electron diffraction". Ultramicroscopy. 70th Birthday of Robert Sinclair and 65th Birthday of Nestor J. Zaluzec PICO 2017 – Fourth Conference on Frontiers of Aberration Corrected Electron Microscopy. 176: 161–169. doi:10.1016/j.ultramic.2016.11.028. ISSN 0304-3991.
- ^ Vendelbo, S. B.; Kooyman, P. J.; Creemer, J. F.; Morana, B.; Mele, L.; Dona, P.; Nelissen, B. J.; Helveg, S. (2013-10-01). "Method for local temperature measurement in a nanoreactor for in situ high-resolution electron microscopy". Ultramicroscopy. 133: 72–79. doi:10.1016/j.ultramic.2013.04.004. ISSN 0304-3991.
- ^ "TEAM 0.5". foundry.lbl.gov. Retrieved 2022-03-15.
- ^ a b Filleter, Tobin; Beese, Allison M. (2016), Bhushan, Bharat (ed.), "In Situ Transmission Electron Microscopy: Mechanical Testing", Encyclopedia of Nanotechnology, Dordrecht: Springer Netherlands, pp. 1543–1554, doi:10.1007/978-94-017-9780-1_100990, ISBN 978-94-017-9780-1
- ^ Wilsdorf, H. G. F. (2004-12-29). "Apparatus for the Deformation of Foils in an Electron Microscope". Review of Scientific Instruments. 29 (4): 323. doi:10.1063/1.1716192. ISSN 0034-6748.
- ^ Haque, M. A.; Espinosa, H. D.; Lee, H. J. (May 2010). "MEMS for In Situ Testing—Handling, Actuation, Loading, and Displacement Measurements". MRS Bulletin. 35 (5): 375–381. doi:10.1557/mrs2010.570. ISSN 1938-1425.
- ^ Wang, Xiaodong; Mao, Shengcheng; Zhang, Jianfei; Li, Zhipeng; Deng, Qingsong; Ning, Jin; Yang, Xudong; Wang, Li; Ji, Yuan; Li, Xiaochen; Liu, Yinong; Zhang, Ze; Han, Xiaodong (24 January 2017). "MEMS Device for Quantitative In Situ Mechanical Testing in Electron Microscope". Micromachines. 8 (2): 31. doi:10.3390/mi8020031.
- ^ Williams, David B.; Carter, C. Barry (1996), Williams, David B.; Carter, C. Barry (eds.), "The Transmission Electron Microscope", Transmission Electron Microscopy: A Textbook for Materials Science, Boston, MA: Springer US, pp. 3–17, doi:10.1007/978-1-4757-2519-3_1, ISBN 978-1-4757-2519-3
- ^ Dömer, H.; Bostanjoglo, O. (2003-09-25). "High-speed transmission electron microscope". Review of Scientific Instruments. 74 (10): 4369–4372. Bibcode:2003RScI...74.4369D. doi:10.1063/1.1611612. ISSN 0034-6748.
- ^ Oldfield, L. C. (June 1976). "A rotationally symmetric electron beam chopper for picosecond pulses". Journal of Physics E: Scientific Instruments. 9 (6): 455–463. Bibcode:1976JPhE....9..455O. doi:10.1088/0022-3735/9/6/011. ISSN 0022-3735.
- ^ Feist, Armin; Bach, Nora; Rubiano da Silva, Nara; Danz, Thomas; Möller, Marcel; Priebe, Katharina E.; Domröse, Till; Gatzmann, J. Gregor; Rost, Stefan; Schauss, Jakob; Strauch, Stefanie; Bormann, Reiner; Sivis, Murat; Schäfer, Sascha; Ropers, Claus (2017-05-01). "Ultrafast Transmission Electron Microscopy Using a Laser-Driven Field Emitter: Femtosecond Resolution with a High Coherence Electron Beam". Ultramicroscopy. 70th Birthday of Robert Sinclair and 65th Birthday of Nestor J. Zaluzec PICO 2017 – Fourth Conference on Frontiers of Aberration Corrected Electron Microscopy. 176: 63–73. arXiv:1611.05022. doi:10.1016/j.ultramic.2016.12.005. PMID 28139341. S2CID 31779409.
- ^ Campbell, Geoffrey H.; McKeown, Joseph T.; Santala, Melissa K. (2014-11-03). "Time resolved electron microscopy for in situ experiments". Applied Physics Reviews. 1 (4): 041101. Bibcode:2014ApPRv...1d1101C. doi:10.1063/1.4900509. OSTI 1186765.
- ^ Pennycook, S.J.; Varela, M.; Hetherington, C.J.D.; Kirkland, A.I. (2011). "Materials Advances through Aberration-Corrected Electron Microscopy" (PDF). MRS Bulletin. 31: 36–43. doi:10.1557/mrs2006.4.
- ^ a b Furuya, Kazuo (2008). "Nanofabrication by advanced electron microscopy using intense and focused beam". Science and Technology of Advanced Materials. 9 (1). 014110. Bibcode:2008STAdM...9a4110F. doi:10.1088/1468-6996/9/1/014110. PMC 5099805. PMID 27877936.
- ^ a b Erni R, Rossell MD, Kisielowski C, Dahmen U (2009). "Atomic-Resolution Imaging with a Sub-50-pm Electron Probe". Physical Review Letters. 102 (9). 096101. Bibcode:2009PhRvL.102i6101E. doi:10.1103/PhysRevLett.102.096101. PMID 19392535.
- ^ Stahlberg, Henning (September 6, 2012). "Contrast Transfer Functions". 2dx.unibas.ch.
- ^ Tanaka, Nobuo (2008). "Present status and future prospects of spherical aberration corrected TEM/STEM for study of nanomaterials". Sci. Technol. Adv. Mater. 9 (1): 014111. Bibcode:2008STAdM...9a4111T. doi:10.1088/1468-6996/9/1/014111. PMC 5099806. PMID 27877937.
- ^ 사물 척도 차트.Science.energy.gov
- ^ O’Keefe, Michael A.; Shao-Horn, Yang (2004). Imaging lithium atoms at sub-Ångström resolution (Report). Lawrence Berkeley National Laboratory. LBNL-56646.
- ^ O’Keefe, Michael A.; Allard, Lawrence F. (2004-01-18). Sub-Ångstrom Electron Microscopy for Sub-Ångstrom Nano-Metrology (PDF). National Nanotechnology Initiative Workshop on Instrumentation and Metrology for Nanotechnology, Gaithersburg, MD (2004). osti.gov.
외부 링크
| 라이브러리 리소스 정보 전송전자현미경 |
| 위키미디어 커먼스는 트랜스미션 전자현미경과 관련된 미디어를 가지고 있다. |
| 위키북 나노테크놀로지에는 '전송 전자현미경 검사(TEM)'라는 주제의 페이지가 있다. |
- 미국 버클리 캘리포니아의 국립 전자 현미경 센터
- 미국 휴스턴 국립 고분자영상센터
- 미국 뉴욕 자동 분자 현미경 국가 자원
- 트랜스미션 전자 현미경의 튜토리얼 과정
- 케임브리지 대학교 TEM에 대한 교육 및 학습 패키지
- 전송 전자 현미경 및 결정 결함에 대한 온라인 과정 Eric Stach(2008).
- 전송 전자 현미경 시뮬레이터(Teaching tool)
- 전자현미경을 포함한 다양한 유형의 현미경에 대한 애니메이션 및 설명(Université Paris Sud)



























