화살표 밀기
Arrow pushing화살표 밀기 또는 전자 밀기는 유기화학 반응 [1]메커니즘의 진행을 설명하는 기술입니다.이것은 로버트 로빈슨 경에 의해 처음 개발되었습니다.화살표 밀기를 사용할 때 반응 메커니즘을 보여주기 위해 화학 방정식에서 반응물의 구조 공식에 "곡선 화살표" 또는 "곡선 화살표"를 그립니다.화살표들은 원자들 사이의 결합이 깨지고 형성됨에 따라 전자들의 움직임을 보여줍니다.화살표를 누르는 것은 원자의 움직임을 직접적으로 보여주는 것이 아니라, 전자 밀도의 움직임을 보여주는 데 사용되며, 이는 원자 자체의 움직임을 간접적으로 보여줍니다.화살표 밀기는 또한 공명을 통해 유기 분자 주위에 양전하와 음전하가 어떻게 분포하는지를 설명하는 데 사용됩니다.그러나 화살표를 누르는 것은 형식주의이며 전자(또는 전자 밀도)는 현실에서 그렇게 깔끔하고 개별적으로 이동하지 않는다는 것을 기억하는 것이 중요합니다.
화살표 밀림은 무기 화학, 특히 s- 및 p-블록 원소의 화학으로 확장되었습니다.그것은 [2]고가 화합물에 잘 작용하는 것으로 나타났습니다.
표기법

전자의 흐름을 나타내기 위해 휘어진 화살표를 사용하는 반응 메커니즘의 표현은 [3][4][5]1922년 로버트 로빈슨 경에 의해 개발되었습니다.유기 화학자들은 전자의 움직임을 묘사하기 위해 분자 구조 안에 두 종류의 화살을 사용합니다.단일 전자의 궤적은 단일 철조망 화살표로 지정된 반면 이중 막대 화살표는 전자 쌍의 움직임을 보여줍니다.화살표의 꼬리는 원자 위에 있는 전자의 외쌍이나 원자 사이의 결합, 전자원 또는 상대적으로 높은 전자 밀도가 있는 영역에 그려집니다.그것의 머리는 전자 싱크대, 혹은 상대적으로 전자 [6]밀도가 낮은 지역을 가리키고 있습니다.


결합이 끊어지면 전자는 결합이 있던 자리를 떠납니다. 전자는 결합에서 떨어진 곳을 가리키는 곡선 화살표로 표시되고 다음 비어 있는 분자 궤도를 가리키는 화살표로 끝납니다.전자는 특정 원자로 전달되거나 단일(시그마) 결합으로 전달되어 이중(pi) 결합이 될 수 있지만, 전자가 "밀릴" 때마다 항상 새로운 원자로 이동하기 때문에 화살표는 항상 특정 원자를 가리키고 있습니다.유기 화학자들은 두 [7]종 사이를 가리키는 곡선 모양의 화살표로 결합의 형성을 나타냅니다.
명확한 설명을 위해 화살표를 누를 때는 한 쌍의 전자 또는 π 또는 π 결합에서 시작하여 한 쌍의 전자를 수용할 수 있는 위치로 끝나는 것이 가장 좋습니다. 이를 통해 독자는 어떤 전자가 움직이고 있고 어디에서 끝나는지 정확히 알 수 있습니다.결합은 해당하는 반결합 오비탈이 채워진 곳에서 깨집니다.일부 기관에서는[1] 화살표가 단독 쌍에 해당하는 공식적인 음전하에서 발생할 수 있다는 단순화를 허용합니다.그러나 모든 공식적인 음전하가 단독 쌍(예: FB의4− B)의 존재에 해당하는 것은 아니며, 이러한 사용에는 주의가 필요합니다.
채권파기
유기 분자에서 원자를 결합하는 공유 결합은 두 개의 전자 그룹으로 구성됩니다.이러한 그룹을 전자쌍이라고 합니다.유기화학에서의 반응은 그러한 결합의 순차적인 파괴와 형성을 통해 진행됩니다.유기화학자들은 화학적 결합이 깨지는 두 가지 과정을 인식합니다.이러한 과정들은 균질 분해와 [8]이종 분해로 알려져 있습니다.
균질결합개열
균질 결합 절단은 결합을 구성하는 전자쌍이 분열되어 결합이 끊어지는 과정입니다.이것은 두 개의 철조망 곡선 화살표가 결박된 곳을 가리키고 있는 것으로 표시됩니다.이 과정의 결과는 이전에 결합되어 있던 각각의 원자에 점으로 표시된 하나의 짝을 이루지 않은 전자의 보유입니다.단일 전자 운동은 일반적으로 물고기 [9]고리라고 불리는 곡선 화살표로 나타낼 수 있습니다.이러한 단일 전자 종은 자유 라디칼(free radical)로 알려져 있습니다.이 과정이 [10]발생하기에 충분한 에너지를 공급하기 위해서는 열이나 빛이 필요합니다.
예를 들어, 자외선은 염소-염소 결합이 균질하게 깨지게 합니다.전자의 쌍은 분열되고, 염소 원자를 가리키는 양쪽 원자 사이의 두 개의 물고기 고리 화살표로 표시됩니다.반응이 일어난 후, 그것은 하나의 짝을 이루지 않은 전자와 함께 남겨진 염소 분자로 이어집니다.이것은 자유 라디칼 할로겐화의 개시 단계입니다.
이종결합절개술
헤테로 분해 결합 절단은 결합을 구성하는 전자쌍이 결합에 의해 이전에 결합되었던 원자들 중 하나로 이동하는 과정입니다.결합이 깨지면서 음전하를 띤 종(음이온)과 양전하를 띤 종(양이온)이 형성됩니다.음이온은 양이온이 결합으로부터 전자를 빼앗기는 동안 결합으로부터 전자를 유지하는 종입니다.음이온은 일반적으로 가장 전기 음성적인 원자, 이 예에서 원자 A에 형성됩니다.이것은 가장 음의 원자가 자연스럽게 전자를 더 강하게 자기 자신 쪽으로 끌어당겨 음전하로 이어지기 때문입니다.
산염기 반응
루이스 산-염기 반응은 홀로 전자쌍, 즉 염기를 가진 분자가 전자쌍 수용체,[11] 즉 산으로 알려진 전자쌍 수용체에 전자를 기부할 때 발생합니다.이는 비결합 전자쌍에서 전자수용체를 가리키는 곡선 화살표의 반응에서 나타날 수 있습니다.브뢴스테드-로우리산과 염기를 포함한 반응에서 화살표는 동일한 방식으로 사용되며, 공격하는 [12]양성자를 나타내는데 도움이 됩니다.브뢴스테드-로우리 산-염기 반응에서 화살표는 양성자 수용체인 산에서 양성자 [13]공여체인 염기로 시작됩니다.
에스원반응N
S1N 반응은 분자가 양전하를 띤 성분과 음전하를 띤 성분으로 분리될 때 발생합니다.이것은 일반적으로 용매 분해라고 불리는 과정을 통해 극성이 높은 용매에서 발생합니다.양전하를 띤 성분은 새로운 화합물을 형성하는 친핵체와 반응합니다.S1N 반응은 할로알칸 농도에만 의존하는 반응입니다.

이 반응의 첫 번째 단계(용해)에서 C-L 결합이 깨지고 그 결합에서 나온 두 전자가 L(떠나는 그룹)에 결합하여 L과 RC3+ 이온을 형성합니다−.이는 C-L 결합에서 L 방향으로 향하는 곡선 화살표로 표시됩니다.친핵성− Nu는 RC에3+ 이끌려 새로운 C-Nu 결합을 형성하는 한 쌍의 전자를 기증합니다.
S1N 반응은 이탈하는 그룹이 뉴클레오파일로 대체되어 진행되기 때문에 S 지정이N 사용됩니다.이 반응의 초기 용매 분해 단계는 이탈 그룹으로부터 해리되는 단일 분자를 포함하기 때문에, 이 과정의 초기 단계는 단분자 반응으로 간주됩니다.반응의 초기 단계에 단 1종의 관여는 S1에 대한 기계적N [14]지정을 향상시킵니다.S1N 반응에는 두 단계가 있습니다.
S2반응N
S2N 반응은 핵우체가 이탈 그룹의 뒤에서 분자에 존재하는 이탈 그룹을 대체할 때 발생합니다.이러한 변위 또는 치환은 입체화학적 구성의 반전을 갖는 치환 생성물의 형성으로 이어집니다.친핵자는 전자원으로서 자신의 외쌍과 결합을 형성합니다.최종적으로 전자 밀도를 수용하는 전자 싱크는 핵융합(이탈 그룹)이며, 전이 상태에서 결합 형성과 결합 파괴가 동시에 발생합니다(이중 단검으로 표시됨).S2N 반응의 속도는 할로알칸과 친핵성의 농도에 따라 달라집니다.

S2N 반응은 이탈 그룹이 친핵체로 치환되어 진행되기 때문에 S 지정이N 사용됩니다.이 메커니즘은 전이 상태에서 두 종의 상호작용으로 진행되기 때문에, 그것은 이중 분자 프로세스라고 불리며, 결과적으로 S2N [15]지정입니다.S2N 반응은 결합된 과정으로, 결합이 깨지고 동시에 형성된다는 것을 의미합니다.따라서 화살표가 밀어내는 전자의 움직임이 [16]동시에 일어나고 있습니다.S2N 반응에는 한 단계가 있습니다.
E1 탈락
E1 제거는 양전하에 인접한 양성자가 이탈하여 이중 결합을 생성할 때 발생합니다.

E1 반응이 일어나기 위해서는 양이온의 초기 형성이 필요하기 때문에, E1 반응은 종종 S1 메커니즘에 대한N 부반응으로 관찰됩니다.
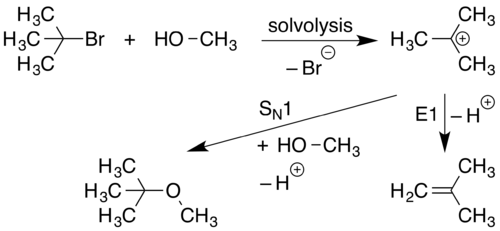
E1 탈락은 E 지정으로 이어지는 이탈 그룹의 탈락으로 진행됩니다.이 메커니즘은 탄소 위치를 형성하는 단일 출발 물질의 초기 해리로 진행되기 때문에, 이 프로세스는 단분자 반응으로 간주됩니다.반응의 초기 단계에 단 1종의 관여는 E1에 대한 기계적 지정을 향상시킵니다.
E2 탈락
이탈기에 인접한 양성자가 이탈기의 제거와 이중결합의 생성이 동시에 있는 염기에 의해 추출될 때 E2 제거가 발생합니다.

E1 제거와 S1N 메커니즘 사이의 관계와 유사하게, E2 제거는 종종 S2N 반응과의 경쟁에서 발생합니다.이러한 관찰은 염기가 또한 친핵체일 때 가장 자주 나타납니다.이러한 경쟁을 최소화하기 위해, 비핵성 염기는 일반적으로 E2 제거에 영향을 미치기 위해 사용됩니다.

E2 제거는 염기 또는 친핵체에 의한 양성자의 초기 추출을 통해 E 지정을 정당화하는 이탈 그룹의 제거로 진행됩니다.이 메커니즘은 두 종(기질 및 염기/핵생물)의 상호작용을 통해 진행되기 때문에, E2 반응은 이중 분자로 인식됩니다.따라서 반응의 초기 단계에서 2종의 관여는 E2에 대한 기계적 지정을 강화합니다.
부가반응
추가 반응은 친핵체가 카보닐과 반응할 때 발생합니다.친핵자가 단순한 알데히드나 케톤에 첨가하면 결과적으로 1,2-가산이 됩니다.핵우체가 결합 카보닐 시스템에 첨가되면 결과는 1,4-가산입니다.1, 2 및 1, 4는 산소에 "1"이라는 라벨이 붙어 있고 산소에 인접한 각 원자가 친핵성 첨가 부위에 순차적으로 번호가 매겨져 있는 시작 화합물의 원자에 번호를 부여한 것에서 유래되었습니다.1,2-가산은 2번 위치에 친핵성 첨가와 함께 발생하는 반면, 1,4-가산은 4번 위치에 친핵성 첨가와 함께 발생합니다.
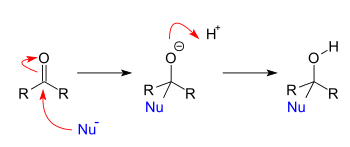

첨가-제거 반응
부가-제거 반응은 부가 반응 직후에 나타나는 제거 반응입니다.일반적으로 이러한 반응은 에스테르(또는 관련 작용기)가 친핵체와 반응할 때 발생합니다.사실, 추가-제거 반응이 진행되기 위한 유일한 요건은 제거되는 그룹이 들어오는 친핵체보다 더 나은 이탈 그룹이라는 것입니다.

참고 항목
메모들
- ^ a b Clayden, Jonathan; Greeves, Nick; Warren, Stuart; Wothers, Peter (2001). Organic Chemistry (1st ed.). Oxford University Press. pp. 123–133. ISBN 978-0-19-850346-0.
- ^ Abhik Gosh, Steffen Berg, Arrow Pushing in Innorganic Chemistry: 주요 그룹 요소의 화학에 대한 논리적 접근, (John Wiley & Sons, 2014).
- ^ Kermack, William Ogilvy; Robinson, Robert (1922). "An explanation of the property of induced polarity of atoms and an interpretation of the theory of partial valencies on an electronic basis". Journal of the Chemical Society, Transactions. 121: 427–440. doi:10.1039/CT9222100427.
- ^ Ghosh, Abhik; Wamser, Carl (2022). "Chemistry's Curly Arrow Hits 100". American Scientist. 110 (6): 338. doi:10.1511/2022.110.6.338. ISSN 0003-0996.
- ^ Ball, Philip (2022-02-14). "A century of curly arrows". chemistryworld.com. Retrieved 2022-12-22.
- ^ Boikess, Robert S. (2015). Chemical principles for organic chemistry. Stamford, CT. ISBN 978-1-285-45769-7. OCLC 881840629.
{{cite book}}: CS1 유지 관리: 위치 누락 게시자(링크) - ^ "Notes on arrow pushing (curly arrows)" (PDF). Imperial College London. Retrieved 2009-04-27.
- ^ "Free Radical Reactions -- One Electron Intermediates". Washington State University. Retrieved 2009-05-02.
- ^ "3.3: Arrow Conventions". Chemistry LibreTexts. 2019-04-15. Retrieved 2022-11-18.
- ^ Liu, Xin (2021-12-09). "9.1 Homolytic and Heterolytic Cleavage".
{{cite journal}}:저널 요구사항 인용journal=(도움말) - ^ "The Lewis Definitions of Acids and Bases". chemed.chem.purdue.edu. Retrieved 2022-11-18.
- ^ Richardson, Jacquie (2020-09-16). "Loudon Ch. 3 Review: Acids/Bases/Curved Arrows" (PDF).
- ^ "Brønsted Acids and Bases". chemed.chem.purdue.edu. Retrieved 2022-11-18.
- ^ "11.5: Characteristics of the SN1 Reaction". Chemistry LibreTexts. 2015-05-03. Retrieved 2022-10-31.
- ^ "11.3: Characteristics of the SN2 Reaction". Chemistry LibreTexts. 2015-05-03. Retrieved 2022-10-31.
- ^ Klein, David R. (2012). Organic chemistry. Hoboken, NJ: Wiley. ISBN 978-0-471-75614-9. OCLC 729915305.
참고문헌
외부 링크
- MIT.edu , 오픈코스웨어: 유기화학Ⅰ
- HaverFord.edu , 유기화학 강의, 동영상 및 텍스트
- 유기화학 가상교과서 CEM.MSU.edu





