케이지 효과
Cage effect쌍둥이자리 [2]재조합으로도 알려진 [1]화학에서의 케이지 효과는 분자의 특성이 주변 환경에 의해 어떻게 영향을 받는지를 묘사한다.1934년 Franck와 Rabinowitch에 의해 처음 소개된 케이지 효과는 개별 입자로 작용하는 대신 용매 내의 분자가 캡슐화된 입자로 더 정확하게 묘사된다는 것을 암시합니다.캡슐화된 분자 또는 라디칼은 케이지 쌍 또는 쌍둥이자리 [5][6]쌍이라고 불립니다.다른 분자와 상호작용하기 위해서는 케이지에 갇힌 입자가 용제 케이지에서 확산되어야 합니다.용제 케이지의 일반적인 수명은 10초입니다−11.[7]케이지 효과의 많은 징후가 존재한다.[8]
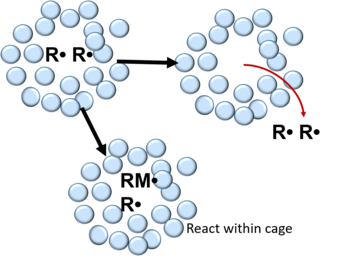
유리 래디칼 중합에서 개시제 분자의 분해로 형성된 래디칼을 용매 및/또는 단량체 [6]분자로 이루어진 케이지로 둘러싸인다.케이지 안에서 활성산소는 많은 충돌을 겪으며 재결합 또는 상호 [5][6][9]불활성화를 일으킨다.이는 다음과 같은 반응을 통해 설명할 수 있습니다.
재결합 후 유리기는 케이지 벽 안에서 단량체 분자와 반응하거나 케이지 밖으로 확산될 수 있다.폴리머에서 유리 라디칼 쌍이 케이지 내에서 재결합을 탈출할 확률은 0.1~0.01이고 [5]액체에서는 0.3~0.8이다.단분자 화학에서는 요오드[10] 분자와 [11][12]헴 단백질을 사용하여 용액 단계에서 주원소 재조합이 최초로 연구되었다.고체 상태에서는 귀가스 고체[13] 매트릭스 및 트라이요오드화 결정성 [14][15][16]화합물에 갇힌 작은 분자와 함께 보석 재조합이 입증되었다.
케이지 재결합 효율
케이지 효과는 케이지 재조합 효율성c F로 정량적으로 설명할 수 있습니다. 여기서 다음과 같은 경우:
여기서c F는 케이지 재결합 속도상수(k)와c 모든 케이지 프로세스의 [9]속도상수 합계의 비율로 정의된다.수학적 모델에 따르면 F는c 라디칼 크기, 모양 및 용매 [9][17][18]점도를 포함한 여러 매개변수의 변화에 의존합니다.래디컬 사이즈의 증가와 래디컬 질량의 감소에 따라 케이지 효과가 증가할 것으로 보고되고 있다.
이니시에이터 효율
유리기 중합에서 개시 속도는 개시제가 [6]얼마나 효과적인지에 따라 달라집니다.낮은 이니시에이터 효율인 ,는 주로 케이지 효과에 기인한다.개시율은 다음과 같이 설명됩니다.
여기서i R은 개시 속도, k는d 개시제 해리의 속도 상수, [I]는 개시제의 초기 농도이다.개시자 효율은 체인 개시에 실제로 기여하는 1차 라디칼 R·의 비율을 나타냅니다.케이지 효과로 인해 활성산소는 서로 비활성화할 수 있어 전파를 시작하는 대신 안정적인 생성물이 생성되어 [6]δ의 값을 낮출 수 있습니다.
「 」를 참조해 주세요.
레퍼런스
- ^ Chemistry (IUPAC), The International Union of Pure and Applied. "IUPAC - cage effect (C00771)". goldbook.iupac.org. doi:10.1351/goldbook.c00771. Retrieved 2022-03-28.
- ^ Chemistry (IUPAC), The International Union of Pure and Applied. "IUPAC - geminate recombination (G02603)". goldbook.iupac.org. Retrieved 2022-03-28.
- ^ Rabinowitch, Franck (1934). "Some remarks about free radicals and the photochemisty of solutions". Transactions of the Faraday Society. 30: 120–130. doi:10.1039/tf9343000120.
- ^ Rabinowitch, E (1936). "The collison [sic] mechanism and the primary photochemical process in solutions". Transactions of the Faraday Society. 32: 1381–1387. doi:10.1039/tf9363201381.
- ^ a b c Denisov, E.T. (1984). "Cage effects in a polymer matrix". Macromolecular Chemistry and Physics. 8: 63–78. doi:10.1002/macp.1984.020081984106.
- ^ a b c d e f Chanda, Manas (2013). Introduction to Polymer Science and Chemistry: A problem solving approach. New York: CRC Press. pp. 291, 301–303.
- ^ Herk, L.; Feld, M.; Szwarc, M. (1961). "Studies of "Cage" Reactions". J. Am. Chem. Soc. 83 (14): 2998–3005. doi:10.1021/ja01475a005.
- ^ "Radical cage effects" (PDF).
- ^ a b c d e Braden, Dale, A. (2001). "Solvent cage effects. I. Effect of radical mass and size on radical cage pair recombination efficiency. II. Is geminate recombination of polar radicals sensitive to solvent polarity?". Coordination Chemistry Reviews. 211: 279–294. doi:10.1016/s0010-8545(00)00287-3.
- ^ Schwartz, Benjamin J.; King, Jason C.; Harris, Charles B. (1994), Simon, John D. (ed.), "The Molecular Basis of Solvent Caging", Ultrafast Dynamics of Chemical Systems, Dordrecht: Springer Netherlands, pp. 235–248, doi:10.1007/978-94-011-0916-1_8, ISBN 978-94-011-0916-1, retrieved 2022-03-28
- ^ Chernoff, D A; Hochstrasser, R M; Steele, A W (1980-10-01). "Geminate recombination of O2 and hemoglobin". Proceedings of the National Academy of Sciences. 77 (10): 5606–5610. doi:10.1073/pnas.77.10.5606. ISSN 0027-8424.
- ^ Rohlfs, R J; Olson, J S; Gibson, Q H (1988-02-05). "A comparison of the geminate recombination kinetics of several monomeric heme proteins". Journal of Biological Chemistry. 263 (4): 1803–1813. doi:10.1016/s0021-9258(19)77948-4. ISSN 0021-9258.
- ^ Apkarian, V. A.; Schwentner, N. (1999-06-09). "Molecular Photodynamics in Rare Gas Solids". Chemical Reviews. 99 (6): 1481–1514. doi:10.1021/cr9404609. ISSN 0009-2665.
- ^ Cerullo, Giulio; Garavelli, Marco (2017-05-27). "Caught in the act". Nature Chemistry. 9 (6): 506–507. doi:10.1038/nchem.2780. ISSN 1755-4349.
- ^ Poulin, Peter R.; Nelson, Keith A. (2006-09-22). "Irreversible Organic Crystalline Chemistry Monitored in Real Time". Science. doi:10.1126/science.1127826.
- ^ Xian, Rui; Corthey, Gastón; Rogers, David M.; Morrison, Carole A.; Prokhorenko, Valentyn I.; Hayes, Stuart A.; Miller, R. J. Dwayne (2017-03-27). "Coherent ultrafast lattice-directed reaction dynamics of triiodide anion photodissociation". Nature Chemistry. 9 (6): 516–522. doi:10.1038/nchem.2751. ISSN 1755-4349.
- ^ Noyes, R.M. (1954). "A Treatment of Chemical Kinetics with Special Applicability to Diffusion Controlled Reactions". J. Chem. Phys. 22 (8): 1349–1359. Bibcode:1954JChPh..22.1349N. doi:10.1063/1.1740394.
- ^ Noyes, R.M. (1961). "Effects of diffusion rates on chemical kinetics". Progr. React. Kinet. 1: 129–60.


![{\displaystyle R_{i}=2fk_{d}[I]}](https://wikimedia.org/api/rest_v1/media/math/render/svg/2936da4d0aabb5a11998aa807c6c5b1e446bd966)


