구조식
Structural formula
화학 화합물의 구조 공식은 분자 구조를 (구조 화학 방법에 의해 결정됨) 그래픽으로 표현한 것으로, 실제 3차원 공간에서 원자가 어떻게 배열될 수 있는지를 보여줍니다.분자 내의 화학적 결합은 또한 명시적으로 또는 암시적으로 보여집니다.기호의 수가 제한되고 설명력이 제한된 다른 화학식 [a]유형과 달리 구조식은 분자 구조를 보다 완벽하게 기하학적으로 표현합니다.예를 들어, 많은 화학적 화합물들은 다른 이성질체 형태로 존재하는데, 이것들은 다른 이성질체 구조를 가지고 있지만 분자식은 같습니다.이러한 구조식을 그리는 방법에는 Lewis Structures, 축합식, 골격식, Newman projections, Cyclohexane conformations, Haworth projections, Fischer [2]projections 등의 다양한 유형이 있습니다.
화학 데이터베이스에서와 같은 몇 가지 체계적인 화학 명명 형식이 기하학적 구조와 동등하고 강력한 방식으로 사용됩니다.이러한 화학적 명명체계는 SMILES, InChI 그리고 CML을 포함합니다. 이러한 체계적인 화학명은 구조식으로 변환될 수 있고 그 반대의 경우도 있지만 화학자들은 거의 항상 화학적인 이름보다는 구조식을 사용하여 화학반응이나 합성을 설명합니다.왜냐하면 구조 공식들은 화학자들이 분자들과 화학반응동안 그것들에서 일어나는 구조적인 변화들을 시각화할 수 있게 해주기 때문입니다.ChemSketch 및 ChemDraw는 일반적으로 Lewis Structure 스타일로 반응 및 구조 공식을 그릴 수 있는 인기 다운로드/웹 사이트입니다.
구조식에서의 구조물
본즈
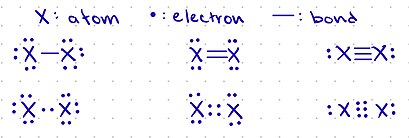
결합은 종종 한 원자와 다른 원자를 연결하는 선으로 표시됩니다.한 줄은 단일 결합을 나타냅니다.두 줄은 이중 결합을 나타내고 세 줄은 삼중 결합을 나타냅니다.어떤 구조에서는 각각의 결합 사이에 있는 원자들이 명시되어 보여집니다.그러나 일부 구조에서는 탄소 분자가 구체적으로 쓰여지지 않습니다.대신에, 이 탄소들은 두 개의 선이 연결될 때 형성되는 모서리로 표시됩니다.또한 수소 원자는 암시적으로 존재하며 일반적으로 추출되지 않습니다.이것들은 탄소가 얼마나 많은 다른 원자들에 붙어있는지에 근거하여 추론될 수 있습니다.예를 들어, 만약 탄소 A가 다른 탄소 B에 붙어 있다면, 탄소 A는 옥텟을 채우기 위해 [3]3개의 수소를 가지고 있을 것입니다.
전자
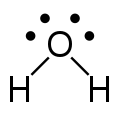
전자는 보통 원 안에서 색깔을 띠는 것으로 표시됩니다.하나의 원은 하나의 전자를 나타냅니다.두 개의 원은 전자의 쌍을 나타냅니다.일반적으로 한 쌍의 전자는 음전하를 나타냅니다.각 원자의 원자가 껍질에 있는 전자의 수는 색을 띤 원을 사용함으로써 [3]분자에서 해당 원자의 반응 능력에 관한 추가적인 설명 정보를 제공합니다.
과금
종종 원자들은 그들의 옥텟이 완전하지 않을 수도 있기 때문에 양전하 또는 음전하를 가질 수 있습니다.만약 원자가 전자쌍이 없거나 양성자를 가지고 있다면, 그것은 양전하를 가질 것입니다.만약 원자가 다른 원자와 결합하지 않은 전자를 가지고 있다면 음전하가 있을 것입니다.구조식에서 양전하는 ⊕로 표시되고 음전하는 ⊖로 표시됩니다.

입체화학(골격식)

골격 공식에서 키랄리티는 나타 투영 방법으로 표시됩니다.입체화학은 분자 내 원자들의 상대적인 공간적 배열을 보여주기 위해 사용됩니다.이를 보여주기 위해 쐐기를 사용하는데, 두 가지 유형이 있습니다. 즉, 대시(dashed)와 채우기(filling)입니다.채워진 쐐기는 원자가 분자의 앞쪽에 있다는 것을 나타냅니다. 원자는 종이의 평면 위에서 앞쪽을 가리키고 있습니다.점선 쐐기는 원자가 분자 뒤에 있음을 나타냅니다. 원자가 종이의 평면 아래를 가리키고 있습니다.직선으로 대쉬하지 않은 선이 사용될 때 원자는 종이의 면에 있습니다.이 공간적 배열은 3차원 공간에서 분자의 아이디어를 제공하고 공간적 배열이 [3]어떻게 배열될 수 있는지에 대한 제약이 있습니다.
불특정 입체화학
물결 모양의 단일 결합은 알려지지 않았거나 지정되지 않은 입체 화학 또는 이성질체의 혼합을 나타냅니다.예를 들어, 인접한 도표는 왼쪽에 HOCH-2 그룹에 물결 모양의 결합을 가진 과당 분자를 보여줍니다.이 경우 두 가지 가능한 고리 구조는 서로 화학적 평형 상태에 있으며 또한 열린 사슬 구조에도 있습니다.고리는 자동적으로 열리고 닫히는데, 때로는 하나의 입체화학으로 그리고 때로는 다른 하나로 닫힙니다.
골격 공식은 시스와 알켄의 트랜스 이성질체를 묘사할 수 있습니다.물결 모양의 단일 결합은 알려지지 않았거나 지정되지 않은 입체 화학 또는 이성질체의 혼합을 나타내는 표준 방법입니다(사면체 입체 중심과 같이).교차 이중 결합이 때때로 사용되었지만 더 이상 일반적으로 [4]사용할 수 있는 스타일로 간주되지 않습니다.

루이스 구조
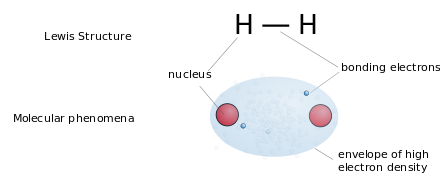
루이스 구조(Lewis dot structures)는 원자 연결과 외쌍 또는 짝이 없는 전자를 보여주는 평평한 그래픽 공식이지만 3차원 구조는 보여주지 않습니다.이 표기법은 주로 작은 분자에 사용됩니다.각 선은 단일 결합의 두 전자를 나타냅니다.원자 쌍 사이의 두 개 또는 세 개의 평행선은 각각 이중 또는 삼중 결합을 나타냅니다.또는 점 쌍을 사용하여 결합 쌍을 나타낼 수도 있습니다.또한 결합되지 않은 모든 전자(짝지은 전자 또는 짝을 이루지 않은 전자)와 원자에 있는 모든 형식적인 전하가 표시됩니다.루이스 구조의 사용을 통해 전자의 위치는 결합에 있든 단독 쌍에 있든 간에 분자 내 원자의 공식 전하를 확인하여 안정성을 이해하고 반응에서 형성될 가능성이 가장 높은 분자를 결정할 수 있습니다.루이스 구조는 종종 분자의 기하학에 약간의 생각을 주고, 결합은 실제 생활에서 분자를 나타내기 위해 특정 각도로 그려집니다.루이스 구조는 전자와 결합이 보여질 때 공식적인 전하 또는 원자가 어떻게 서로 결합하는지를 계산하는 데 가장 잘 사용됩니다.루이스 구조는 결합과 외쌍의 존재에 따라 달라지는 분자와 전자기하학에 대한 아이디어를 제공하며, 이를 통해 결합각과 혼성화도 결정할 수 있습니다.
축약식
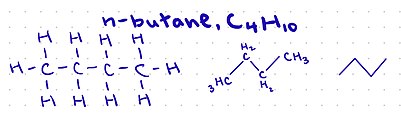
그래픽의 사용이 매우 제한적이었던 초기 유기화학 출판물에서, 한 줄의 텍스트로 유기 구조를 묘사하는 타이포그래픽 시스템이 등장했습니다.이 시스템은 순환 화합물에 적용하는 데 문제가 있는 경향이 있지만, 단순한 구조를 나타내는 편리한 방법으로 남아 있습니다.
- 3 {\에탄올)
괄호는 여러 개의 동일한 그룹을 나타내는 데 사용되며, 공식 내에서 나타날 때 왼쪽에 있는 가장 가까운 비수소 원자에 부착되거나 공식 시작 시 오른쪽에 있는 원자에 부착됨을 나타냅니다.
- 3) 2 {( CH ( OH2-프로판올)
모든 경우에 수소 원자를 포함하여 모든 원자가 표시됩니다.카보닐이 어디에 있는지를 보여주는 것도 도움이 됩니다.
C {\=은(는) 괄호 안에 있는O {O을(를) 합니다.예를 들어,
3 ( 3{\{\ (아세톤)
따라서 브래킷의 원자 왼쪽을 보고 어떤 원자에 부착되어 있는지 확인하는 것이 중요합니다.이것은 축합식에서 골격식이나 루이스 구조와 같은 다른 형태의 구조식으로 변환할 때 도움이 됩니다.축합식에서 다양한 작용기를 방법은 {\ce {}}, 카르복실산을 H 와 같이 다양합니다. 또는 {\{\ Essters R{\ COOR {\ 그러나 축합 공식을 사용한다고 해서 화합물의 분자 형상이나 탄소 간의 결합 수를 바로 알 수 있는 것은 아닙니다.그것은 탄소에 부착된 원자의 [5]수와 탄소에 전하가 있는지를 기준으로 인식될 필요가 있습니다.
골격 공식
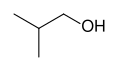
골격 공식은 더 복잡한 유기 분자의 표준 표기법입니다.유기화학자 프리드리히 아우구스트 케쿨레 폰 스트라도니츠에 [6]의해 처음 사용된 이러한 유형의 도표에서 탄소 원자는 원자 기호 C로 표시되기 보다는 선분의 꼭짓점(모서리)과 끝에 위치하도록 암시됩니다.탄소 원자에 부착된 수소 원자는 표시되지 않습니다. 각각의 탄소 원자는 탄소 원자에 4개의 결합을 줄 수 있는 충분한 수소 원자와 관련이 있는 것으로 이해됩니다.탄소 원자에 양전하 또는 음전하가 존재하면 암시된 수소 원자 중 하나를 대체합니다.탄소 이외의 원자에 부착된 수소 원자는 명시적으로 표기해야 합니다.골격 공식의 추가적인 특징은 특정 구조를 추가함으로써 화합물의 입체화학, 즉 3차원 구조를 결정할 수 있다는 것입니다.종종 골격 공식은 선 대신 쐐기를 사용하여 입체화학을 나타낼 수 있습니다.실선 쐐기는 종이의 평면 위를 가리키는 결합을 나타내고, 파선 쐐기는 평면 아래를 가리키는 결합을 나타냅니다.
-
이소부탄올 골격식, (CH3)2CHCHOH2
투시도
뉴먼투영 및 톱말투영
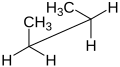
뉴먼 프로젝션과 톱말 프로젝션은 특정 컨포머를 묘사하거나 근접 입체화학을 구별하는 데 사용됩니다.두 경우 모두 두 특정 탄소 원자와 그 연결 결합이 관심의 중심입니다.유일한 차이는 약간 다른 관점입니다: 관심 있는 유대를 똑바로 내려다보는 뉴먼 투영, 같은 유대를 바라보지만 다소 비스듬한 유리한 관점에서 바라본 톱마 투영.뉴먼 투영에서 원은 결합에 수직인 평면을 나타내기 위해 사용되며, 전면 탄소의 치환기와 후면 탄소의 치환기를 구분합니다.톱말 돌기에서, 앞 탄소는 대개 왼쪽에 있고 항상 약간 낮습니다.때때로 화살표는 앞의 탄소를 나타내기 위해 사용됩니다.톱말 돌기는 골격 공식과 매우 유사하며, 분자의 입체화학을 나타내기 위해 선 대신 쐐기를 사용할 수도 있습니다.톱말 투영은 분자 기하학 및 분자 배열의 좋은 지표가 아니기 때문에 골격 공식과 구별됩니다.Newman과 Sawhorse Projection 둘 다 Fischer Projection을 만드는 데 사용할 수 있습니다.
-
부탄의 뉴먼 돌기
-
톱말의 부탄돌기
사이클로헥산 적합성
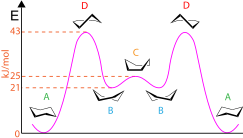
사이클로헥산과 다른 작은 고리 화합물의 특정한 형태는 표준 규약을 사용하여 보여질 수 있습니다.예를 들어, 사이클로헥산의 표준 의자 형상은 탄소 원자의 평균 평면보다 약간 높은 곳에서 원근법을 사용하며, 어떤 그룹이 축 방향(수직으로 위 또는 아래를 가리키고)이고 어떤 그룹이 적도 방향(거의 수평으로 위 또는 아래로 약간 기울어져 있음)인지를 명확하게 나타냅니다.앞의 본드는 더 강한 선이나 쐐기로 강조될 수도 있고 그렇지 않을 수도 있습니다.형상은 다음과 같이 진행됩니다. 의자에서 반의자로, 보트에서 보트로, 보트에서 반의자로, 의자로.사이클로헥산의 형상은 그림에 표시된 것처럼 각 단계에 존재하는 전위 에너지를 표시하는 데에도 사용될 수 있습니다.의자 형상(A)은 에너지가 가장 낮은 반면, 반의자 형상(D)은 에너지가 가장 높습니다.보트 형상(C)에는 피크/로컬 최대치가 있고, 트위스트 보트 형상(B)에는 밸리/로컬 최소치가 있습니다.또한, 사이클로헥산 컨포메이션은 분자가 1,[7] 3, 5개 탄소의 축방향 치환기 사이의 입체적인 상호작용인 1, 3개의 2축-상호작용을 갖는지를 나타내기 위해 사용될 수 있습니다.
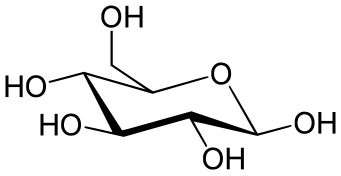
하워스 프로젝션
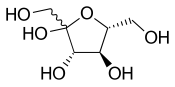
하워스 프로젝션은 고리형 당에 사용됩니다.축 및 적도 위치는 구분되지 않으며, 대신 치환기는 연결된 고리 원자의 바로 위 또는 바로 아래에 위치합니다.수소 치환기는 일반적으로 생략됩니다.
그러나 하워스 프로젝션을 읽을 때 주의해야 할 중요한 점은 링 구조가 평평하지 않다는 것입니다.따라서 Haworth는 3-D 형상을 제공하지 않습니다.Norman Haworth 경은 탄수화물에 대한 연구와 비타민 C의 구조를 발견한 것으로 노벨 화학상을 수상한 영국의 화학자였습니다.그가 발견한 동안, 그는 또한 현재 하워스 프로젝션이라고 불리는 다양한 구조 공식을 추론했습니다.하워스 프로젝션에서 피라노스 당은 육각형으로 묘사되고 퓨라노스 당은 오각형으로 묘사됩니다.보통 산소는 피라노스에서는 오른쪽 위에, 퓨라노스에서는 중앙 위에 위치합니다.링 상단의 얇은 본드는 멀리 떨어져 있는 본드를 의미하고 링 하단의 두꺼운 본드는 보는 [8]사람에게 더 가까운 링의 끝을 의미합니다.

-
하워스 프로젝션 베타-D-글루코스
피셔 투영법
피셔 투영은 선형 단당류에 주로 사용됩니다.임의의 주어진 탄소 중심에서 수직 결합선은 관찰자로부터 멀어지는 입체화학적 해시 표시와 동일한 반면, 수평선은 관찰자를 가리키는 쐐기와 동일한 것입니다.당류는 이러한 다중적인 형태를 채택하지 않을 것이기 때문에 이러한 예측은 비현실적입니다.그럼에도 불구하고, 피셔 투영은 실제 적합성에 대한 지식을 필요로 하거나 암시하지 않는 다수의 순차 입체 중심을 묘사하는 간단한 방식입니다.피셔 투영은 3-D 분자를 2-D로 제한하므로 카이랄 중심의 구성을 변경하는 데 제한이 있습니다.피셔 투영은 카이랄 탄소의 R 및 S 구성을 결정하는 데 사용되며, 이는 칸 잉골드 프리로그 규칙을 사용하여 수행됩니다.이것은 이성질체와 이성질체를 [8]표현하고 구분하는 편리한 방법입니다.
한계
구조 공식은 화학 구조의 특정 측면을 나타낼 수 없는 단순화된 모델입니다.예를 들어, 비국재화 결합과 같은 동적 시스템에는 형식화 결합이 적용되지 않을 수 있습니다.방향성은 그러한 경우이며 결합을 나타내기 위해 관습에 의존합니다.다른 스타일의 구조 공식은 방향성을 다른 방식으로 나타낼 수 있으며, 동일한 화학 화합물을 다른 방식으로 나타낼 수 있습니다.또 다른 예는 전자 밀도가 공식 결합 외부에 퍼져 부분적인 이중 결합 특성과 실온에서의 느린 상호 변환으로 이어지는 공식 이중 결합입니다.모든 동적 효과에 대해 온도는 변환 간 속도에 영향을 미치며 구조를 표현하는 방법을 변경할 수 있습니다.많은 사람들이 표준 온도라고 가정하지만 구조 공식과 관련된 명시적인 온도는 없습니다.
참고 항목
메모들
참고문헌
- ^ Denise DeCooman (2022-04-08). "What are Chemical Formulas and How are They Used?". Study.com. sec. Chemical Formula Examples. Archived from the original on 2022-06-23.
- ^ Goodwin, W. M. (2007-04-13). "Structural formulas and explanation in organic chemistry". Foundations of Chemistry. 10 (2): 117–127. doi:10.1007/s10698-007-9033-2. ISSN 1386-4238. S2CID 93952251.
- ^ a b c d Brown, William Henry; Brent L. Iverson; Eric V. Anslyn; Christopher S. Foote (2018). Organic chemistry (Eighth ed.). Boston. ISBN 978-1-305-58035-0. OCLC 974377227.
{{cite book}}: CS1 유지 관리: 위치 누락 게시자(링크) - ^ J. Brecher (2006). "Graphical representation of stereochemical configuration (IUPAC Recommendations 2006)" (PDF). Pure Appl. Chem. 78 (10): 1897–1970. doi:10.1351/pac200678101897. S2CID 97528124.
- ^ Liu, Xin (2021-12-09). "2.1 Structures of Alkenes".
{{cite journal}}:저널 요구사항 인용journal=(도움말) - ^ "Friedrich August Kekule von Stradonitz –inventor of benzene structure - World Of Chemicals". www.worldofchemicals.com. Retrieved 2022-04-04.
- ^ Brown, William Henry (2018). Organic chemistry. Brent L. Iverson, Eric V. Anslyn, Christopher S. Foote (Eighth ed.). Boston, MA. ISBN 978-1-305-58035-0. OCLC 974377227.
{{cite book}}: CS1 유지 관리: 위치 누락 게시자(링크) - ^ a b Zhang, Qing-zhi; Zhang, Shen-song (June 1999). "A New Method To Convert the Fischer Projection of a Monosaccharide to the Haworth Projection". Journal of Chemical Education. 76 (6): 799. doi:10.1021/ed076p799. ISSN 0021-9584.
외부 링크
- 구조식의 중요성
- "Structural Formulas". 2016-05-09. Archived from the original on 2016-05-09. Retrieved 2022-12-17.
- 결정학을 이용하여 구조식을 얻는 방법