브라디루조비움속
Bradyrhizobium| 브라디루조비움속 | |
|---|---|
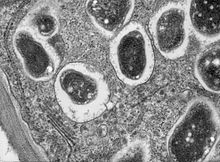 | |
| 콩뿌리 결절을 횡단한다.서맥은 뿌리를 감염시켜 질소 고정 공생을 형성한다.이 고배율 이미지는 심볼 내에 단일 박테로이드가 있는 세포의 일부를 보여준다. | |
| 과학적 분류 | |
| 도메인: | 박테리아 |
| 문: | 슈도모나도타속 |
| 클래스: | 알파프로테오박테리아 |
| 주문: | 균사체 |
| 패밀리: | 니트로박터과 |
| 속: | 브라디루조비움속 1982년 요르단 |
| 모식종 | |
| 쯔가시카미 | |
| 종. | |
| 텍스트 참조 | |
| 동의어 | |
Bradyrhizobium은 그램 음성의 토양 박테리아로 많은 양이 질소를 고정시킨다.질소 고정은 질소 순환의 중요한 부분이다.식물은 대기 중 질소(N2)를 사용할 수 없으며 질산염과 같은 질소 화합물을 사용해야 한다.
특성.
Bradyrhizobium 종은 그램 음성균(봉 모양)으로 아극성 또는 극성 편모를 가지고 있다.그들은 식물에서 나오는 탄수화물과 교환하여 질소를 고정시키는 콩과 식물 종과 공생 관계를 형성할 수 있는 흔한 토양에 사는 미생물입니다.다른 뿌리 공포증처럼, 이 속의 많은 구성원들은 대기 질소를 다른 유기체가 쉽게 사용할 수 있는 형태로 고정하는 능력을 가지고 있습니다.서맥근 공포증은 또한 삼림 토양 미생물 군집의 주요 구성요소이며, 이러한 토양에서 분리된 균주는 전형적으로 질소를 고정하거나 [3]응결시킬 수 없다.그들은 빠르게 성장하는 뿌리공포증으로 여겨지는 뿌리공포증과는 대조적으로 느리게 자란다.액체 배지에서 브래디리조비움 종은 적당한 혼탁도를 만드는 데 3~5일이 걸리고 개체 수가 두 배가 되는 데 6~8시간이 걸린다.그들은 탄소원으로서 [4]펜토스와 함께 가장 잘 자라는 경향이 있다.일부 균주(예: USDA 6 및 CPP)는 일산화탄소를 [5]곡예적으로 산화시킬 수 있습니다.
분류법
승인된 종
Bradyrhizobium은 다음과 같은 [6]종으로 구성된다.
- B. agreste Klepa et al.[7]
- 알제리엔세 안니아 외 연구진 2019
- 아메리카넘 라미레스-바헤나 외 2017년
- 암피카르페아과 브롬필드 외 2019년
- 비아라키도리 왕 외 연구진 2013
- B. 원형 헬레네 외 연구진 2020
- B.오스트레일리엔스 헬레네 외 연구진 2020
- 베타에 리바스 등2004
- 카자니목 아라우조 외 2017년
- 카나리센스 Vinuesa et al. 2005
- 센트로즈마티스 Corrig. 라미레스-바헤나 외 2017년
- 우주인 와사이하라 외 2020년
- B. 사이티시 Chahbourne 외 2011년
- 다칭센스 Wang JY 외 2012년
- B. 데니트리칸스 (Hirsch and Muller 1986) van Berkum et al. 2011
- 디아조피키엔스 델라무타 외 2013년
- B. 다양성 Serenato Klepa 외[7]
- elkani 쿠이켄달 외 1993년
- B. 메짐성 델라무타 외 2015년
- 적혈구 야오 외 2015년
- 페릴리그니 야오 외 2015년
- 프레데릭이 데 올리베이라 우르키아가 외 2019년
- 간저우엔시 Lu 등 2014년
- 글리시니스 Serenato Klepa 외[7]
- B. 광둥성 Li 등 2015년
- B. 광시센스 Li 등 2015년
- 히포넨시 Rejili et al. 2020
- 황화이하이엔스 장 외 2012년
- 고드름 두란 외 연구진 2014년
- 잉게 da Silva et al. 2014
- 이리오모텐스 이슬람 외 2010년
- 이보렌스 Fossou et al. 2020
- 자포니쿰 (키르치네르 1896년)요르단 1982년
- 지카마에 라미레스-바헤나 외2009
- 카방겐세 라세 그로네마이어 외 2015
- B. labi Chang et al. 2011
- 랴오닝센스 쉬 외 1995년
- 루피니 Peix et al. 2015
- B. 마나우센스 실바 외 연구진 2014
- 메르칸테이 Helene 외 2017년
- 머도치 헬레네 외 연구진 2020
- 나미엔세 Grönemeyer 외 2017년
- B. 나노넨스 Li 등 2020년
- 신열대성 질리 외 2014년
- 니프탈리 Klepa et al. 2019
- 니트로루센스 장 외 연구진 2020
- B. 올리고토스피라툼 (오타 & 핫토리 1985) 라미레스-바헤나 외 2013년
- B. 오타와인스 Yu 등 2014년
- 파키리지 라미레스-바헤나 외2009
- B. 팍셀레리 두란 외 연구진 2014년
- 레타메 게루즈 외 2013년
- B. 리펜스 Chahboune 외 2012년
- 리패 Bünger 외 2018년
- B. 쉬엔스 Aserse et al. 2018
- B. stylosan this 마르송 델라무타 외 2016년
- 지렁이아지렁이속 Gronemeyer 외 2015년
- 심비오데피시엔스 브롬필드 외 2020년
- 트로피키아그리 델라무타 외 2015년
- 비그네 Grönemeyer et al. 2016
- 비리디푸투리 Helene 등 2015년
- B. 위안밍센스 야오 외 2002년
잠정종
다음 종이 발표되었지만 세균학 [6]법규에 따라 검증되지 않았습니다.
- "B. 브라질렌스" 마르틴스 다 코스타 외 2017
- "B. campsiandrae" 카브랄 미셸 외 2021
- "B. centrolobii" 미셸 외 2017년
- "B. forestalis" Martins da Costa et al. 2018
- "B. gangsouense" Li et al. 2019
- "B. macuxiense" 미셸 외 2017
- "B. sacchari" de Matos et al. 2017
- "Photorhizobium tompsonianum" 이글샴 외 1990년[2]
- "B. uaiense" 카브랄 미셸 외 연구진
- "B. valentinum" 두란 외 2014년
- "B. 잔장센스" 리 외 2019년
계통발생학
현재 승인된 분류법은 LPSN([6]Standing in Nomenclature)을 가진 원핵생물 이름 목록을 기반으로 한다.계통 발생은 전체 유전자 [9]분석에 기초한다.
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
결절
결절 형성
결절은 세균이 서식하는 콩과 식물의 뿌리에서 자라는 것이다.식물의 뿌리는 뿌리권에 아미노산과 당분을 분비한다.뿌리 공포증은 뿌리 쪽으로 이동하고 뿌리 털에 붙는다.그 후 식물은 박테리아 내에서 결절 유전자의 발현을 유도하는 플라보노이드를 방출한다.이러한 유전자의 발현은 뿌리털 컬링을 시작하는 노드 인자라고 불리는 효소의 생산을 야기합니다.이 과정에서 뿌리털 공포증은 뿌리털과 함께 웅크려진다.뿌리공포증은 뿌리털을 통해 주뿌리로 자라는 감염사를 통해 뿌리털 세포에 침투한다.이것은 감염된 세포를 분열시켜 결절을 형성하게 한다.뿌리 공포증은 이제 질소 고정을 시작할 수 있다.
결절 유전자
55개 이상의 유전자가 [10]결절과 관련이 있는 것으로 알려져 있다.NodD는 다른 Nod [11]유전자의 발현에 필수적이다.두 개의 다른 결절 유전자는 결절과1 결절이다2.성공적인 [10]결절을 위해서는 nodD만1 필요합니다.
질소 고정
브라디근육과 다른 뿌리 공포증은 대기 중 질소를 가져다가 암모니아나3 암모늄에4+ 고정시킨다.식물은 대기 질소를 사용할 수 없습니다. 그들은 결합되거나 고정된 형태의 원소를 사용해야 합니다.광합성 후 질소 고정(또는 흡수)[12]은 식물의 성장과 발달에 가장 중요한 과정이다.식물의 우레이드 질소 수준은 식물이 차지하는 고정 [13]질소의 양과 관련이 있습니다.
유전자
Nif와 fix는 Bradyrhizobium 종 중에서 질소 고정과 관련된 중요한 유전자이다.니프 유전자는 자유생활성 디아조트로프인 클렙시엘라 폐렴에서 발견되는 유전자와 매우 유사하다.서맥근공포증에서 발견되는 유전자는 폐렴구균에서 발견되는 유전자와 유사한 기능과 구조를 가지고 있다.고정 유전자는 공생 질소 고정에 중요하며 뿌리 공포증 종에서 처음 발견되었다.nif 유전자와 fix 유전자는 염색체 상의 적어도 두 개의 다른 클러스터에서 발견됩니다.클러스터 I에는 질소 고정 유전자가 대부분 포함되어 있습니다.클러스터 II는 결절 [14]유전자 근처에 위치한 세 개의 고정 유전자를 포함합니다.
다양성
이 박테리아의 속은 특이하거나 일반적인 [4]공생을 형성할 수 있다; Bradyrhizobium의 한 종은 하나의 콩 종만을 결절시킬 수 있는 반면, 다른 Bradyrhizobium 종은 여러 콩 종들을 결절시킬 수 있다.리보솜 RNA는 이 미생물 그룹에서 매우 보존되어 있어 Bradyrhizobium을 종의 다양성의 지표로 사용하는 것을 매우 어렵게 만듭니다.대신 DNA-DNA 교배가 사용되었고 더 많은 다양성을 보여 준다.그러나 표현형의 차이가 거의 보이지 않기 때문에 많은 종의 이름이 [15]붙여지지 않았다.
일부 변종은 광합성이며, 이 브라디리조비움은 종종 반수생인 아이스키노멘 콩과 줄기에서 결절을 형성하며, 아프리카 야생 쌀인 오리자 브레빌리구라타의 [16]결절 뿌리에서도 발견됩니다.
중요성
곡물 콩은 매년 [12]약 150만2 km의 땅에서 재배된다.매년 고정되는 질소의 양은 전세계적으로 약 44-6600만 톤으로 [17]농업에 사용되는 모든 질소의 거의 절반을 공급한다.Bradyrhizobium의 시판 접종제를 이용할 수 있다.
Bradyrhizobium은 또한 DNA 추출 키트 시약 및 초순수 시스템의 오염물질로 확인되었으며, 이는 마이크로바이오타 또는 메타게노믹 데이터 [18]세트에 잘못 나타날 수 있다.질소 고정 박테리아가 오염 물질로 존재하는 것은 저장 [19]탱크에서 미생물의 성장을 억제하기 위해 초순수 생성에 질소가스를 사용했기 때문일 수 있습니다.
주목종
- Bradyrhizobium betae는 사탕무의 종양과 같은 뿌리 변형으로부터 분리되었다; 그들은 공생 상태를 [15]알 수 없다.
- Bradyrhizobium elkani, Bradyrhizobium diazoefficiens 및 Bradyrhizobium 랴오닝센스는 [15]콩과 공생 관계를 형성합니다.
- 콩, 카우피, 녹두, 시라트로를 [15]결절시킵니다.
- Bradyrhizobium Yuanmingense는 Lespedeza를 [15]끄덕인다.
- 카나리아 제도의 고유종인 제니스토이드 콩을 결절시킵니다.호주 서부와 아프리카 [15]남부의 루핀과 세라델라 결절에서도 발견된다.
레퍼런스
- ^ Ramirez-Bahena, M.-H.; Chahboune, R.; Peix, A.; Velazquez, E. (2012). "Reclassification of Agromonas oligotrophica into the genus Bradyrhizobium as Bradyrhizobium oligotrophicum comb. nov". International Journal of Systematic and Evolutionary Microbiology. 63 (Pt 3): 1013–6. doi:10.1099/ijs.0.041897-0. PMID 22685107.
- ^ a b Eaglesham AR, Ellis JM, Evans WR, Fleishman DE, Hungria M, Hardy KW (1990). "The first photosynthetic N2-fixing Rhizobium: Characteristics". In Gresshoff PM, Koth LE, Stacey G, Newton WE (eds.). Nitrogen Fixation: Achievements and Objectives. Boston, MA: Springer. pp. 805–811. doi:10.1007/978-1-4684-6432-0_69. ISBN 978-1-4684-6434-4.
- ^ VanInsberghe, David; Maas, Kendra; Cardenas, Erick; Strachan, Cameron; Hallam, Steven; Mohn, William (2015). "Non-symbiotic Bradyrhizobium ecotypes dominate North American forest soils". The ISME Journal. 9 (11): 2435–2441. doi:10.1038/ismej.2015.54. PMC 4611507. PMID 25909973.
- ^ a b P. Somasegaran (1994). Handbook for rhizobia: Methods in legume–rhizobium technology. New York: Springer-Verlag. pp. 1–6, 167. ISBN 978-0-387-94134-9.
- ^ Gary, King (2003). "Molecular and culture-based analyses of aerobic carbon monoxide oxidizer diversity". Applied and Environmental Microbiology. 69 (12): 7257–7265. doi:10.1128/aem.69.12.7257-7265.2003. PMC 309980. PMID 14660374.
- ^ a b c "List of Prokaryotic names with Standing in Nomenclature —Bradyrhizobium". Retrieved May 23, 2021.
- ^ a b c Klepa MS, Ferraz Helene LC, O'Hara G, Hungria M. (2021). "Bradyrhizobium agreste sp. nov., Bradyrhizobium glycinis sp. nov. and Bradyrhizobium diversitatis sp. nov., isolated from a biodiversity hotspot of the genus Glycine in Western Australia". Int J Syst Evol Microbiol. 71 (3). doi:10.1099/ijsem.0.004742. PMC 8375429. PMID 33709900.
{{cite journal}}: CS1 maint: 작성자 파라미터 사용(링크) - ^ a b Kalita, M; Małek, W (2010). "Genista tinctoria microsymbionts from Poland are new members of Bradyrhizobium japonicum bv. genistearum". Systematic and Applied Microbiology. 33 (5): 252–9. doi:10.1016/j.syapm.2010.03.005. PMID 20452160.
- ^ Hördt, Anton; López, Marina García; Meier-Kolthoff, Jan P.; Schleuning, Marcel; Weinhold, Lisa-Maria; Tindall, Brian J.; Gronow, Sabine; Kyrpides, Nikos C.; Woyke, Tanja; Göker, Markus (7 April 2020). "Analysis of 1,000+ Type-Strain Genomes Substantially Improves Taxonomic Classification of Alphaproteobacteria". Frontiers in Microbiology. 11: 468. doi:10.3389/fmicb.2020.00468. PMC 7179689. PMID 32373076.
- ^ a b Stacey, Gary (1995). "Bradyrhizobium japonicum nodulation genetics". FEMS Microbiology Letters. 127 (1–2): 1–9. doi:10.1111/j.1574-6968.1995.tb07441.x. PMID 7737469.
- ^ Stacey, G; Sanjuan, J.; Luka, S.; Dockendorff, T.; Carlson, R.W. (1995). "Signal exchange in the Bradyrhizobium–soybean symbiosis". Soil Biology and Biochemistry. 27 (4–5): 473–483. doi:10.1016/0038-0717(95)98622-U.
- ^ a b Caetanoanolles, G (1997). "Molecular dissection and improvement of the nodule symbiosis in legumes". Field Crops Research. 53 (1–3): 47–68. doi:10.1016/S0378-4290(97)00022-1.
- ^ van Berkum, P.; Sloger, C.; Weber, D. F.; Cregan, P. B.; Keyser, H. H. (1985). "Relationship between Ureide N and N2 Fixation, Aboveground N Accumulation, Acetylene Reduction, and Nodule Mass in Greenhouse and Field Studies with Glycine max (L.) Merr". Plant Physiol. 77 (1): 53–58. doi:10.1104/pp.77.1.53. PMC 1064455. PMID 16664027.
- ^ Hennecke, H (1990). "Nitrogen fixation genes involved in the Bradyrhizobium japonicum–soybean symbiosis". FEBS Letters. 268 (2): 422–6. doi:10.1016/0014-5793(90)81297-2. PMID 2200721. S2CID 43001831.
- ^ a b c d e f Rivas, Raul; Martens, Miet; De Lajudie, Philippe; Willems, Anne (2009). "Multilocus sequence analysis of the genus Bradyrhizobium". Systematic and Applied Microbiology. 32 (2): 101–10. doi:10.1016/j.syapm.2008.12.005. PMID 19201125.
- ^ Chaintreuil, Clémence; Giraud, Eric; Prin, Yves; Lorquin, Jean; Bâ, Amadou; Gillis, Monique; de Lajudie, Philippe; Dreyfus, Bernard (December 2000). "Photosynthetic Bradyrhizobia Are Natural Endophytes of the African Wild Rice Oryza breviligulata". Applied and Environmental Microbiology. 66 (12): 5437–5447. Bibcode:2000ApEnM..66.5437C. doi:10.1128/AEM.66.12.5437-5447.2000. PMC 92479. PMID 11097925. Retrieved 7 May 2021.
- ^ Alberton, O; Kaschuk, G; Hungria, M (2006). "Sampling effects on the assessment of genetic diversity of rhizobia associated with soybean and common bean". Soil Biology and Biochemistry. 38 (6): 1298–1307. doi:10.1016/j.soilbio.2005.08.018.
- ^ Salter, S; Cox, M; Turek, E; Calus, S; Cookson, W; Moffatt, M; Turner, P; Parkhill, J; Loman, N; Walker, A (2014). "Reagent contamination can critically impact sequence-based microbiome analyses". bioRxiv 10.1101/007187.
- ^ Kulakov, L; McAlister, M; Ogden, K; Larkin, M; O'Hanlon, J (2002). "Analysis of Bacteria Contaminating Ultrapure Water in Industrial Systems". Applied and Environmental Microbiology. 68 (4): 1548–1555. Bibcode:2002ApEnM..68.1548K. doi:10.1128/AEM.68.4.1548-1555.2002. PMC 123900. PMID 11916667.


