플라모듐알레시
Plasmodium knowlesi| 플라모듐알레시 | |
|---|---|
 | |
| 인간 적혈구를 감염시키는 플라스모디움 노를레시의 지엠사(Giemsa)에 얼룩진 얼룩말 | |
| 과학적 분류 | |
| 도메인: | 에우카리오타 |
| (랭킹되지 않음): | 보더리크목 |
| 클래드: | SAR |
| 인크라이킹도: | 알베올라타 |
| 망울: | 아피콤플렉스속 |
| 클래스: | 아코노이드아목 |
| 순서: | 해모스포라목 |
| 패밀리: | 플라모디과 |
| 속: | 플라스모듐 |
| 종: | P. knowlesi |
| 이항식 이름 | |
| 플라모듐알레시 신톤과 멀리건 1932년 | |
플라스모디움 노를레시는 인간과 다른 영장류에게 말라리아를 일으키는 기생충이다.동남아시아 전역에서 발견되며, 말레이시아에서 인간 말라리아의 가장 흔한 원인이다.다른 플라스모디움 종과 마찬가지로 P. knowlesi는 모기와 온혈 숙주 모두의 감염을 필요로 하는 생명 주기를 가지고 있다.P. knowlesi의 자연적인 온혈 숙주는 다양한 구세계 원숭이일 가능성이 높지만, 감염된 모기에 의해 식충되면 인간은 p. knowlesi에 감염될 수 있다.P. knowlesi는 망상 아피콤플렉스아, 속 플라모디움아, 하위 게놈 플라모듐에 있는 진핵생물이다.그것은 인간이 아닌 영장류를 감염시키는 다른 플라스모디움 종뿐만 아니라 인간 기생충 플라스모듐 비비박스와 가장 밀접한 관련이 있다.
P. knowlesi에 감염된 사람은 플라스모듐 팔시파룸에 의해 야기된 것과 유사하게 복잡하지 않거나 심각한 말라리아에 걸릴 수 있다.P. knowlesi 감염의 진단은 P. knowlesi가 인간을 감염시키는 다른 종들과 매우 흡사하기 때문에 어렵다.치료법은 다른 종류의 말라리아와 유사하며, 일반적으로 클로로킨이나 아르테미시닌 조합요법이 권장된다.P. knowlesi 말라리아는 이전에 인간에게 희귀하다고 생각되었던 새로운 질병이지만 동남아시아에서는 점점 더 큰 건강 부담으로 인식되고 있다.
P. knowlesi는 1932년에 처음으로 뚜렷한 종으로 인간 말라리아의 잠재적인 원인으로 묘사되었다.20세기 초 신경독 치료제로 발열을 일으키는 데 잠깐 사용되었다.20세기 중반 P. knowlesi는 플라스모디움 생물학을 연구하는 도구로 인기를 끌었고 기초 연구, 백신 연구, 약물 개발 등에 이용되었다.P. knowlesi는 여전히 말라리아의 실험실 모델로 사용되고 있는데, 그것은 영장류인 영장류인 마카크를 쉽게 감염시키고, 인간이나 마카크 혈액에서 세포 배양에서 자랄 수 있기 때문이다.
라이프 사이클
다른 플라스모듐 기생충과 마찬가지로 P. knowlesi는 포유류 숙주와 곤충 숙주 사이를 왔다 갔다 해야 하는 라이프 사이클이 있다.영장류는 침샘에 있는 포로조아이트라고 불리는 기생충 단계를 운반하는 감염된 아노펠레스 모기의 물림을 통해 감염된다.스포로조아충은 혈류를 따라 영장류 간으로 가서 5일에서 6일 사이에 발달하여 복제하며, 메로조아충이라고 불리는 수천 개의 딸 세포를 혈액으로 방출한다(관련 P. 비비박스와 달리 P. knowlesi는 간에 잠재된 하이프노조아이트를 만들지 않는다).[1][2]혈액 속의 인어생물은 영장류의 적혈구에 달라붙어 침입한다.적혈구 내부에서 기생충은 링 스테이지, 트로포조이트, 슈라이즌트라고 불리는 형태학적으로 구별할 수 있는 여러 단계를 거쳐 진행된다.분열에 감염된 적혈구는 결국 폭발하여, 새로운 적혈구를 감염시키고 순환을 계속하는 혈류로 최대 16개의 새로운 생물이 방출되었다.[1][3]P. knowlesi는 이 적혈구 주기를 24시간마다 완료하여 영장류에 감염된 플라스모듐 종들 사이에서 독특하게 빠른 속도를 낸다(일반적으로 48시간 또는 72시간이 걸린다).[2]때때로 적혈구를 침범하는 기생충은 대신 성 순환에 들어가 약 48시간 동안 마이크로가메테모세포 또는 마크로가메테모세포라고 불리는 뚜렷한 성형으로 발전한다.[1][3]이 생식세포들은 모기에 의해 섭취될 혈액 속에 남아있다.[1][3]
모기는 감염된 영장류 숙주로부터 혈액을 섭취할 때 생식세포들을 섭취한다.일단 모기장 안에서 생식세포는 생식세포로 발달한 후 융합하여 디플로이드 지고테를 형성한다.[1]지고테는 성숙하여 오오키네테(ookinete)로 성장하는데, 이 오키네테는 모기장 벽을 통해 이동하며 난모세포로 발전한다.[1][4]그리고 난모기는 수천 개의 포로조아이트를 방출하고, 이 포로조아이트는 모기를 통해 침샘으로 이동한다.[1]모기의 모든 과정은 12일에서 15일이 걸린다.[2]
세포생물학
P. knowlesi는 세포 생물학에서 다른 플라스모듐 종과 크게 닮았다.그것의 게놈은 14개의 염색체로 분리된 23.5메가바이트의 DNA로 구성되어 있다.[5]그것은 약 5200개의 단백질 코딩 유전자를 포함하고 있으며, 그 중 80%는 P. 팔시파룸과 P. 비비팩스에 존재하는 직교 유전자를 가지고 있다.[5]게놈에는 P. knowlesi 특유의 두 개의 큰 유전자 계열이 있는데, 면역체계를 피하기 위해 기생충 표면에 서로 다른 항원을 표시하는 데 관여하는 SICAvar(schizont inspected cell aggutation variates) 계열과 기생화된 적혈구를 에 붙이는 데 관여하는 Kir(kar) 계열이다.혈관벽[5]
아피콤플렉스인 P. knowlesi는 숙주세포를 침입하는 데 특화된 몇 가지 독특한 구조를 가지고 있다.여기에는 큰 전구형 roptries, 작은 미크론, 그리고 분산된 밀집된 과립 등이 포함되는데, 각각은 숙주세포에 들어가 수정하기 위해 이펙터를 분비한다.[6][7]다른 아피콤플렉스인들과 마찬가지로 P. knowlesi도 내분비생물의 기원을 가진 두 개의 오르간셀을 가지고 있는데, 하나의 큰 미토콘드리온과 아피코플라스트는 둘 다 기생충의 신진대사에 관여하고 있다.[8]
진화와 분류학
P. 말라리아와 형태학적으로 유사함에도 불구하고, P. knowlesi는 인간이 아닌 영장류를 감염시키는 다른 플라스모디움 종뿐만 아니라 P. vivax와 가장 밀접한 관련이 있다.[9]모든 현대 P. knowlesi 변종의 마지막 공통 조상은 약 9만8천년에서 47만8천년 전에 살았던 것으로 추정된다.[9]인간의 기생충 중에서 P. knowlesi는 1800만~3400만 년 전으로 갈라진 P. vivax와 가장 밀접한 관련이 있다.[5][10]인간을 감염시키는 플라스모듐 종을 비교하는 계통생성 나무는 다음과 같다.[5]
| 아브게누스 플라스모디움 |
| ||||||||||||||||||
P. knowlesi 기생충의 개체수는 P. falciparum이나 P. vivax보다 유전적으로 더 다양하다.P. knowlesi 안에는 유전적으로 구별되는 세 개의 하위 집단이 있다.[5]두 마리는 말레이시아 보르네오의 같은 지역에 존재하며 다른 모기들을 감염시킬 수 있다.[5]셋째는 동남아시아의 다른 지역에서 발원한 격리실험실에서만 발견되었다.[5]마카크로부터 격리된 P. knowlesi의 개체수는 유전적으로 인간의 감염으로부터 격리된 개체와 구별할 수 없으며, 동일한 기생충 개체수가 인간과 마카크를 서로 교환하여 감염시킬 수 있음을 시사한다.[11]
P. knowlesi의 아종은 스테인드피 필름에서의 외관상 차이를 바탕으로 설명되었는데, 각각 말레이시아, 자바, 대만에서 고립되었던 P. knowlesi edesoni, P. knowlesi sintoni, P. knowlesi arimai이다.[2][12]이렇게 묘사된 아종과 현대문학에서 묘사된 인구 사이의 관계는 명확하지 않다.[2]
분배
플라스모디움 노를레시는 동남아시아 전역에서 발견되는데, 주로 긴꼬리마카크, 돼지꼬리마카크, 수마트란 서릴리뿐만 아니라 반도의 모기 벡터 아노펠레스 해커리와 사라왁의 아노펠레스 래텐 등을 감염시킨다.[1]야생의 긴꼬리마카크들은 여러 다른 플라스모디움 종에 동시에 감염되어도 뚜렷한 질병 없이 P. knowlesi에 감염될 수 있다.[2][10]P. knowlesi는 동남아시아 이외의 지역에서는 거의 발견되지 않는데, 아마도 P. knowlesi가 감염시키는 모기들이 그 지역에 제한되어 있기 때문일 것이다.[11]
인간병에서의 역할
P. knowlesi는 인간에게 복잡하지 않고 심각한 말라리아를 유발할 수 있다.감염된 사람들은 거의 항상 열과 오한을 경험한다.[13]복잡하지 않은 P.Knowlesi 말라리아에 걸린 사람들은 종종 두통, 관절 통증, 말라리아, 그리고 식욕 감퇴를 경험한다.[13]덜 흔한 사람들은 기침, 복통, 설사, 메스꺼움, 구토 등을 보고한다.[13]감염자에 대한 실험실 테스트에서는 거의 항상 혈소판 수치가 낮지만 출혈 문제는 거의 발생하지 않는다.[13]다른 인간의 말라리아와는 달리, P. knowlesi 말라리아는 24시간마다 급증하는 열을 가지고 있는 경향이 있어서, 흔히 매일 또는 "쿼티디아" 말라리아라고 불린다.[13][14]복잡하지 않은 P. knowlesi 말라리아는 말라리아 치료제로 치료될 수 있다.[13]
P. knowlesi에 감염된 사람 중 적어도 10%는 심각한 말라리아에 걸린다.[11]심각한 P. knowlesi 말라리아는 P. 팔시파룸에 의한 심각한 말라리아와 유사하다.중증 질환자는 호흡곤란, 복통, 구토 등을 겪을 수 있다.[13]질병이 진행됨에 따라 기생충들은 급성 신장손상, 황달, 충격, 호흡곤란을 일으킬 가능성이 높은 혈액에 매우 높은 수준으로 복제된다.[13][15]대사산증은 흔치 않지만 특히 심각한 경우 발생할 수 있다.[15]심한 P. knowlesi 말라리아는 P. 팔시파룸 말라리아와 달리 혼수상태나 심각한 빈혈을 일으키는 경우는 드물다.[13][15]약 1~2%의 환자가 치명적이다.[11]
진단
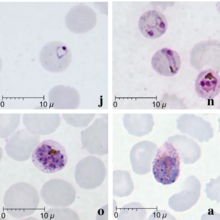
말라리아는 전통적으로 현미경으로 지엠사(Giemsa)가 묻은 혈막을 검사해 진단하지만, P. Knowlesi를 다른 플라스모디움 종과 이런 식으로 구별하는 것은 생김새가 비슷해 어려움을 겪고 있다.[11]지엠사로 얼룩진 P. knowlesi 링 스테이지 기생충은 P. 팔시파룸 링 스테이지와 유사하며, 한 두 개의 어두운 점의 염색질을 가진 원으로 나타난다.[16]나이든 열대호초들은 더욱 분산된 모습으로 나타나서 P. 말라리아에서 비슷한 단계를 닮은 "밴드 형태"라고 불리는 숙주세포에 걸쳐 퍼져 있는 직사각형 모양을 형성한다.[16]이 단계 동안, "신튼과 멀리건스의 스티플링"이라고 불리는 숙주 적혈구를 가로지르는 점들이 가끔 나타난다.[16]슈존트는 다른 플라스모디움 종과 유사하게 중심 암색의 색소를 둘러싸고 있는 자주색 생물의 군집으로서 나타난다.[16]
플라스모디움 종의 형태학적 유사성 때문에 P. 팔시파룸, P. 말라리아, 또는 P. 비비박스로서 P. knowlesi 감염의 오진이 일반적이다.[15]일부 급속 진단 테스트는 P. knowlesi를 검출할 수 있지만 민감도와 특수성이 떨어지는 경향이 있어 항상 신뢰할 수 있는 것은 아니다.[15][17]PCR이나 실시간 PCR에 의한 핵산 검출은 P. knowlesi를 검출하고, 다른 플라스모듐종 감염과 구별하는 가장 신뢰할 수 있는 방법이다.그러나 PCR의 상대적으로 느리고 비용이 많이 드는 특성 때문에, 이것은 많은 풍토 지역에서는 이용할 수 없다.[11]P. knowlesi 검출의 루프 매개 등온 증폭법도 개발되었지만 아직 널리 사용되고 있지는 않다.[11]
치료
P. knowlesi는 적혈구 사이클을 완료하는 데 24시간밖에 걸리지 않기 때문에 매우 높은 수준의 기생충을 빠르게 발생시킬 수 있으며 치명적인 결과를 초래할 수 있다.[15]세계보건기구(WHO)는 비복제 말라리아 환자의 경우 아르테미시닌 기반 복합치료제(ACT)나 클로로킨을 이용한 치료를 권고하고 있다.[18]심각한 말라리아를 앓고 있는 사람들에게 세계보건기구는 최소한 24시간 동안 정맥주사를 투여할 것을 권고하고 있고, 이어서 ACT 치료를 할 것을 권고하고 있다.[15]게다가, 초기 약물 실험에서는 클로로킨과 프리마킨, 장인과 메플로킨, 아르테메테더와 루메판트린, 그리고 클로로킨의 조합만으로도 복잡하지 않은 P. knowlesi 말라리아에 효과적인 치료법이 될 수 있다고 제안했다.[15]P. knowlesi가 현재의 말라리아에 대한 저항력을 발달시켰다는 증거는 없다.[15]
역학
말레이시아에서 말라리아의 가장 흔한 원인은 P. knowlesi이며,[5] 동남아시아의 대부분의 나라들뿐만 아니라 이 지역에서 온 여행객들도 P. knowlesi 말라리아에 걸린 사례가 보고되고 있다.[11]
P. knowlesi 감염은 사람들을 모기의 숙주가 흔히 발견되는 울창한 숲으로 데려오는 사회경제적, 생활습관적 요인과 관련이 있다.[13]특히 농부와 사냥꾼, 벌목꾼 등 숲에서 일하거나 그 여백에 있는 사람들은 감염 위험이 높다.[13]이 때문에 암컷보다 수컷이 더 자주 감염되고, 어린이보다 어른들이 더 자주 감염된다.[13]
리서치
P. knowlesi는 기생충과 숙주의 상호작용을 연구하고, 말라리아 백신과 약물을 개발하는 연구모델로 오랫동안 이용되어 왔다.[10]연구 모델로서의 그것의 효용은 부분적으로 일반적인 실험실 모델 영장류인 붉은털 마카크를 감염시키는 능력에 기인한다.레서스 마카크는 P. knowlesi에 매우 취약하며 모기에 물리거나 포로조산염 주사를 맞거나 혈중 기생충 주사를 맞으면 감염될 수 있다.[2][10]감염된 원숭이들은 빈혈과 비장과 간을 확장시키는 것을 포함한 인간 말라리아의 특징들을 발달시킨다.[2]감염은 일반적으로 치료하지 않으면 치명적이며, 사인은 혈관 벽에 감염된 적혈구를 부착하는 것으로 특징지어지는 순환기 장애로 보인다.[2]원숭이는 말라리아를 이용한 치료로 감염을 치료할 수 있다; 반복적인 감염에 따른 치료 결과는 원숭이들이 감염에 대한 면역력을 발달시키는 결과를 낳는데, 이것은 또한 상당한 연구의 대상이 되어 왔다.[2]
P. knowlesi는 플라스모디움 세포 생물학에 대한 체외 연구에도 사용된다.고립된 스토로조아충은 일차적혈구 간세포에 감염될 수 있어 기생충 간 단계의 체외 연구가 가능하다.[10]덧붙여 P. knowlesi와 P. palciparum은 붉은혈구와 인간 둘 다 배양된 적혈구에서 지속적으로 유지될 수 있는 유일한 플라스모디움 종이다.[10]분자 생물학 연구를 용이하게 하기 위해 P. knowlesi 게놈의 염기서열이 작성되었으며 PlasmoDB와 다른 온라인 저장소에서 이용할 수 있다.[10]P. knowlesi는 Rhesus macaque 모델 시스템 또는 혈액 세포 배양에서 전이되어 연구실에서 유전적으로 변형될 수 있다.[10][19]혈액감염 단계와 스포로조아이트는 글리세롤리테로 얼려 장기간 보관할 수 있어 관심종류의 보존이 가능하다.[1]
역사
이탈리아의 의사 주세페 프란치니는 1927년 긴꼬리마카크의 혈액에서 P. 시노몰기와 P. 이누이와는 구별되는 기생충을 발견했을 때 P. knowlesi였을 수도 있는 것을 처음으로 설명했다.[20][21]1931년, 이 기생충은 캘커타의 칼라 아자르(관찰적 라이슈마니아시스)에 관한 연구 중 H. G. M. 캠벨에 의해 긴꼬리마카크에서 다시 목격되었다; 캠벨의 동료 리오넬 에버라드 네이피어는 감염된 원숭이로부터 혈액을 뽑아 3마리의 실험용 원숭이를 접종했는데, 그 중 하나는 심각한 감염을 일으킨 붉은갈색 마카크였다.[3][22]캠벨과 네이피어는 감염된 원숭이를 비라즈 모한 다스 굽타에게 주었는데, 비라즈 모한 다스 굽타는 원숭이를 통해 기생충을 연속적으로 통로로 유지할 수 있었다.[23]1932년 다스 굽타와 그의 감독관 로버트 놀스는 마카크 피 속에 있는 기생충의 형태학을 설명하면서 그것이 세 명의 인간 환자를 감염시킬 수 있음을 증명했다(각각 다른 감염을 치료할 희망을 가지고 열을 유도하는 데 사용되었다).[3][24]또한 1932년 존 신튼과 H. W. 멀리건은 혈액 세포에 있는 기생충의 형태학을 더욱 자세히 묘사하여, 묘사된 다른 종들과는 구별되는 종이라고 판단하고 로버트 놀스를 기리기 위해 플라모디움 놀레시라고 명명했다.[3]
곧이어 1935년 C. E. Van Rooyen과 George R.말뚝은 정신과 환자의 전신마비를 치료하기 위해 P. knowlesi 감염을 사용했다고 보고했다.P. knowlesi는 계속해서 다양한 질병, 특히 신경독에 대한 일반적인 화농약으로 사용될 것이다. 특히 신경독은 적어도 1955년까지 사용되었다.[23]시릴 가넘이 1957년 P. knowlesi가 인간을 자연적으로 감염시킬 수 있다고 주장했던 반면,[25] P. knowlesi에 자연적으로 감염된 사람이 최초로 기록된 경우는 1965년 미국 육군 조사관에게서 5일간의 말레이시아에 배치되어 오한과 열이 발생한 사건이었다.[23][26]말레이시아 반도 의학연구소의 연구팀은 이 발견을 바탕으로 마카크에 가까운 곳에 사는 사람들을 대상으로 조사를 벌였지만, 시미아 말라리아가 사람에게 전염되고 있다는 증거를 발견하지는 못했다.[23]
1960년대와 1970년대에 걸쳐 과학 연구 단체들은 말라리아에 대한 정석적인 발견을 하기 위해 P. Knowlesi를 연구 모델로 사용했다.1965년과 1972년, 몇몇 그룹은 P. knowlesi 항원적 변화가 면역 회피와 만성 감염에 어떻게 기여했는지를 특징지었다.[23]1975년 루이 H. 밀러 등은 P. knowlesi가 적혈구를 침범하기 위해 적혈구 표면에 더피 인자를 필요로 한다는 것을 보여주었다(그들은 1년 후 P. vivax에 대한 동일한 요건을 계속 보여줄 것이다).[23]
인간 말라리아 기생충으로서 P. Knowlesi에 대한 연구는 2004년에 다시 활성화되었는데, 발비르 싱과 다른 사람들이 PCR을 사용하여 말레이시아 보르네오에서 P. 말라리아로 진단된 인간 그룹의 절반 이상이 실제로 P. Knowlesi에 감염되었음을 보여주었다.[23][27]그 후 10년 동안, 몇몇 연구자들은 동남아시아 전역의 증가하는 말라리아 환자 비율을 P. Knowlesi로 귀속시키기 위해 P. Knowlesi와 형태학적으로 유사한 기생충을 구별할 수 있는 분자 검출 방법을 사용했다.[28]보관 샘플에 대한 연구는 적어도 1990년대 이후 이 기생충에 대한 감염이 말레이시아에서 발생했음을 보여주었다.[29]
참조
- ^ a b c d e f g h i Collins WE (2012). "Plasmodium knowlesi: A Malaria Parasite of Monkeys and Humans". Annual Review of Entomology (Submitted manuscript). 57: 107–121. doi:10.1146/annurev-ento-121510-133540. PMID 22149265.
- ^ a b c d e f g h i j Butcher GA, Mitchell GH (September 2016). "The role of Plasmodium knowlesi in the history of malaria research". Parasitology. Cambridge University Press. 145 (1): 6–17. doi:10.1017/S0031182016001888. PMID 27829470.
- ^ a b c d e f Coatney GR, Collins WE, Warren M, Contacos PG (1971). The Primate Malarias. Atlanta, GA: Division of Parasitic Diseases, U.S. Centers for Disease Control. pp. 317–334. Retrieved 26 August 2019.
- ^ Smith RC, Barillas-Mury C (December 2016). "Plasmodium Oocysts: Overlooked Targets of Mosquito Immunity". Trends in Parasitology. Elsevier. 32 (12): 979–990. doi:10.1016/j.pt.2016.08.012. PMID 27639778.
- ^ a b c d e f g h i Garrido-Cardenas JA, Gonzalez-Ceron L, Manzano-Agugliaro F, Mesa-Valle C (January 2019). "Plasmodium genomics: an approach for learning about and ending human malaria". Parasitology Research. Springer. 118 (1): 1–27. doi:10.1007/s00436-018-6127-9. PMID 30402656. S2CID 53228888.
- ^ Counihan, Natalie A.; Kalanon, Ming; Coppel, Ross L.; De Koning-Ward, Tania F. (2013). "Plasmodium rhoptry proteins: Why order is important". Trends in Parasitology. 29 (5): 228–36. doi:10.1016/j.pt.2013.03.003. PMID 23570755.
- ^ Kemp, Louise E.; Yamamoto, Masahiro; Soldati-Favre, Dominique (2013). "Subversion of host cellular functions by the apicomplexan parasites". FEMS Microbiology Reviews. 37 (4): 607–31. doi:10.1111/1574-6976.12013. PMID 23186105.
- ^ Sheiner, Lilach; Vaidya, Akhil B.; McFadden, Geoffrey I. (2013). "The metabolic roles of the endosymbiotic organelles of Toxoplasma and Plasmodium spp". Current Opinion in Microbiology. 16 (4): 452–8. doi:10.1016/j.mib.2013.07.003. PMC 3767399. PMID 23927894.
- ^ a b Lee KS, Divis PC, Zakaria SK, Matusop A, Julin RA, Conway DJ, Cox-Singh J, Singh B (2011). Kazura JW (ed.). "Plasmodium knowlesi: Reservoir Hosts and Tracking the Emergence in Humans and Macaques". PLOS Pathog. 7 (4): e1002015. doi:10.1371/journal.ppat.1002015. PMC 3072369. PMID 21490952.
- ^ a b c d e f g h Pasini EM, Zeeman AM, Voorberg-Vanderwel A, Kocken CH (November 2016). "Plasmodium knowlesi: a relevant, versatile experimental malaria model". Parasitology. Cambridge University Press. 145 (1): 56–70. doi:10.1017/S0031182016002286. PMID 27938428.
- ^ a b c d e f g h Millar SB, Cox-Singh J (July 2015). "Human infections with Plasmodium knowlesi-zoonotic malaria". Clinical Microbiology and Infection. Elsevier. 21 (7): 640–648. doi:10.1016/j.cmi.2015.03.017. PMID 25843504.
- ^ Garnham PC (1963). "A new sub-species of Plasmodium knowlesi in the long-tailed macaque". J Trop Med Hyg. 66: 156–8. PMID 13960457.
- ^ a b c d e f g h i j k l Singh B, Daneshvar C (2013). "Human Infections and Detection of Plasmodium knowlesi". Clinical Microbiology Reviews. 26 (2): 165–184. doi:10.1128/CMR.00079-12. PMC 3623376. PMID 23554413.
- ^ Chin W, Contacos PG, Coatney RG, Kimbal HR (1965). "A naturally acquired quotidian-type malaria in man transferable to monkeys". Science. 149 (3686): 865. Bibcode:1965Sci...149..865C. doi:10.1126/science.149.3686.865. PMID 14332847. S2CID 27841173.
- ^ a b c d e f g h i Barber BE, Grigg MJ, William T, Yeo TW, Anstey NM (March 2017). "The treatment of Plasmodium knowlesi malaria". Trends in Parasitology. Elsevier. 33 (3): 242–253. doi:10.1016/j.pt.2016.09.002. PMID 27707609.
- ^ a b c d "DPDx Malaria - Image Gallery". U.S. Centers for Disease Control and Prevention. 29 December 2017. Retrieved 20 January 2020.
- ^ Despommier DD, Griffin DO, Gwadz RW, Hotez PJ, Knirsch CA. Parasitic Diseases (PDF) (7 ed.). Parasites Without Borders. p. 112.
- ^ "Treatment of uncomplicated malaria caused by P. vivax, P. ovale, P. malariae, or P. knowlesi". Guidelines for the Treatment of Malaria (3 ed.). World Health Organization. 2015. p. 60. ISBN 978-92-4-154912-7. Archived from the original on April 25, 2015. Retrieved 22 January 2020.
- ^ de Koning-Ward TF; Gilson PR; Crabb BS (June 2015). "Advances in molecular genetic systems in malaria". Nature Reviews Microbiology. Macmillan. 13 (6): 373–387. doi:10.1038/nrmicro3450. PMID 25978707. S2CID 19786233.
- ^ 프랜치니 G (1927년) 수디 un 플라스모디오 피그미아토 디 una scimia.아치 이탤릭 공상 메드 콜론 8:187–90
- ^ Antinori S, Milazzo L, Corbellino M (October 2011). "Plasmodium knowlesi: an overlooked Italian discovery?". Clinical Infectious Diseases. 53 (8): 849, author reply 849–50. doi:10.1093/cid/cir527. PMID 21890752.
- ^ Napier LE; Campbell HGM (May 1932). "Observations on a Plasmodium infection which causes haemoglobinuria in certain species of monkey" (PDF). The Indian Medical Gazette: 246–249. S2CID 26553543. Archived from the original (PDF) on 2019-02-28. Retrieved 27 August 2019.
- ^ a b c d e f g Spinello A, Galimberti L, Milaazo L, Corbellino M (2013). "Plasmodium knowlesi: The emerging zoonotic malaria parasite". Acta Tropica. 125 (2): 191–201. doi:10.1016/j.actatropica.2012.10.008. PMID 23088834.
- ^ Knowles R, Das Gupta BM (June 1932). "A study of monkey malaria, and its experimental transmission to man". Indian Medical Gazette. 67 (6): 301–320. PMC 5231565. PMID 29010910.
- ^ Garnham PC, Lainson R, Cooper W (1957). "The tissue stages and sporogony of Plasmodium knowlesi". Trans R Soc Trop Med Hyg. 51 (5): 384–396. doi:10.1016/0035-9203(57)90071-8. PMID 13467997.
- ^ Mason Dentinger, R (26 August 2015). "Patterns of Infection and Patterns of Evolution: How a Malaria Parasite Brought "Monkeys and Man" Closer Together in the 1960s". Journal of the History of Biology. 49 (2): 359–395. doi:10.1007/s10739-015-9421-8. PMID 26307748.
- ^ Singh B, Lee KS, Matusop A, Radhakrishnan A, Shamsul SS, Cox-Singh J, Thomas A, Conway DJ (2004). "A large focus of naturally acquired Plasmodium knowlesi infections in human beings" (PDF). Lancet. 363 (9414): 1017–24. doi:10.1016/S0140-6736(04)15836-4. PMID 15051281. S2CID 7776536.
- ^ Vythilingam I, Noorazian YM, Huat TC, Jiram AI, Yusri YM, Azahari AH, Norparina I, Noorrain A, Lokmanhakim S (2008). "Plasmodium knowlesi in humans, macaques and mosquitoes in peninsular Malaysia". Parasit Vectors. 1 (1): 26. doi:10.1186/1756-3305-1-26. PMC 2531168. PMID 18710577.
- ^ Lee KS; Cox-Singh J; Brooke G; Matusop A; Singh B (2009). "Plasmodium knowlesi from archival blood films: Further evidence that human infections are widely distributed and not newly emergent in Malaysian Borneo". Int J Parasitol. 39 (10): 1125–1128. doi:10.1016/j.ijpara.2009.03.003. PMC 2722692. PMID 19358848.
외부 링크
| 스콜리아는 Plasmodium knowlesi의 주제 프로파일을 가지고 있다. |