노달 신호 경로
Nodal signaling pathway이 글에는 노달 흐름과 그 발견에 대한 정보가 누락되어 있다[PMID 27821522]. (2021년 9월) |
노달 신호 경로는 배아 발달 중 지역 및 세포 분화에 중요한 신호 전달 경로다.[1]
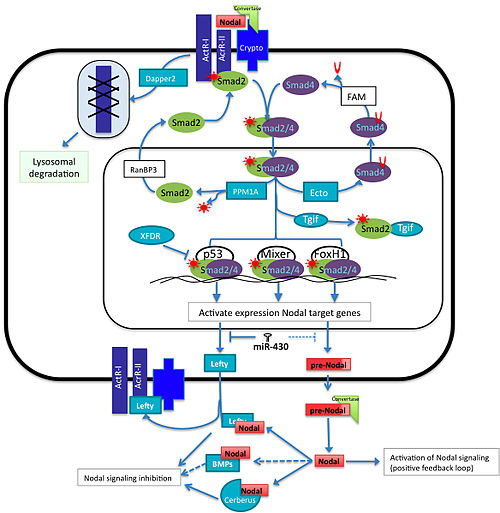
변형성장인자 베타(TGFβ) 슈퍼패밀리의 일부인 노달 단백질군은 중음도 유도, 신경계의 패터닝, 척추동물 배아의 등측 복측 축 결정 등을 담당한다. 노달 경로의 활성화는 활성과 활성과 유사한 수용체에 대한 노달 결합을 포함하며, 이는 Smad2의 인산화로 이어진다. P-Smad2/Smad4 복합체는 핵 속으로 반투명하여 FoxH1, p53 및 믹서(제노푸스 혼합 유사 내피 조절기)와 같은 전사 인자와 상호작용한다. 이는 결국 노달(NODAL), 레프티(Lefty) 등 노달(Nodal)과 노달(Nerverus)의 대항제인 노달(Lefty)과 같은 표적 유전자의 유도로 이어진다.[2]
노달 경로의 활성화는 그 자체의 유전자를 포함한 많은 표적 유전자의 전사를 유도하지만, 동시에 마이크로 RNA와 다른 단백질은 경로의 다른 지점에서 이 양성 피드백 루프를 부정적인 방식으로 방해한다.[2][3] 이러한 신호 활성화와 억제 균형은 개발 초기에 중요한 역할을 하는 다운스트림 표적 유전자의 정확한 위치, 농도, 지속시간을 달성하기 위해 필요하다. 본 기사에서는 신호 경로 규제에 긍정적이고 부정적으로 참여하는 일부 구성 요소의 역할을 요약한다. 노달 신호의 모든 주요 성분은 거의 모든 척추동물에 진화적으로 보존되어 있지만, 경로의 각 성분에 대한 조절은 종에 따라 달라지기도 한다.
역사
노달 유전자는 원래 콘론 외 연구진에 의해 쥐의 레트로바이러스 돌연변이에 의해 발견되었고, 이로 인해 정상적인 쥐의 위장과 배아 발달을 방해하는 유전자가 격리되었다.[4] 저우 외 연구진에 의한 이 유전자에 대한 추가 연구는 노달 유전자가 생쥐 배아에서 중뇌 세포를 유도하기에 충분한 분비 신호 펩타이드 인코딩을 한다는 것을 보여주었다. 이것은 다른 많은 요소들이 Xenopus의 중간자 형성에 관여했던 것과 달리 중요한 발견이었다. 반면에 배아적 치사율과 유전자의 모성 기여로 인해 이러한 요소들을 제거하기 어려웠던 것은 녹아웃 표현형태를 분석하기 어렵게 만들었다.[5] 제브라피쉬의 사이클롭스와 사팔뜨기와 같은 다른 척추동물의 결절신호에 대한 추가 연구는 결절신호가 모든 척추동물의 중추를 유도하기에 적합하다는 것을 증명했다.[2]
경로의 선택된 구성 요소
레프티
TGFβ 단백질의 상이한 구성원인 Lefty 단백질은 결절 신호의 세포외 대항제 역할을 한다. 제브라피쉬의 왼쪽 호몰로뉴, 항바이러스 등의 표현 연구는 왼쪽이 목덜미 신호의 경쟁적 억제제 역할을 할 가능성이 높다는 것을 보여준다.[6] 좌뇌의 과도한 압박은 노달 녹아웃과 유사한 표현형을 유도하고, 액티닌(노달 관련 단백질) 수용체 또는 수용체 세포외 영역의 과도한 압박은 표현형을 구제할 수 있다. 좌파의 유도는 노달 표현에 의존하므로, 좌파는 노달 신호에 대한 고전적인 피드백 억제제를 작용한다. 결절과 마찬가지로 모든 척추동물은 적어도 한 개의 왼쪽 유전자를 가지고 있는 반면 제브라피쉬와 쥐와 같은 많은 동물들은 두 개의 독특한 왼쪽 유전자를 가지고 있다.
DAN 단백질
제노푸스의 세르베루스와 코코, 생쥐의 세르베루스와 같은 DAN 단백질도 결절 신호의 대항제 역할을 한다. 왼쪽 단백질과 달리 DAN 단백질은 세포외 결절 단백질과 직접 결합해 신호를 차단한다. 또한, 모든 DAN 단백질이 결절 신호에만 특정한 것은 아니며, 또한 뼈 형태생성 단백질(BMPs)을 차단할 것이며, 세르베루스와 코코의 경우 Wnt 신호도 차단할 것이다.[7] 이 활동은 신경 발달과 좌우 대칭에서 중요한데, 이는 나중에 논의될 것이다.
BMPs
레프티와 세르베루스만이 노달과 세포외 공간에서 상호작용을 할 수 있는 것은 아니며, BMP3와 BMP7이 노달과 이단체를 형성하여 관련 경로에 대한 상호 억제를 유발한다는 생화학적 증거가 있다.[8]
변환기: furin 및 PACE4
노달 mRNA는 성숙한 노달을 생성하기 위해 변환이라고 불리는 단백질에 의해 분해되는 미성숙 단백질 형태의 노달을 생산한다. 미분비신 같은 프로프로테아제(SPC) 푸린(Spc1)과 PACE4(Spc4)는 결절단백질의 전구체를 특정 순서에 따라 인식하고 이를 쪼개 성숙한 결절리간드를 형성한다.[9] 반대로 노달의 미숙한 형태는 여전히 통로를 활성화시킬 수 있다.[10] 세포외 공간으로의 노달 운송 중 노달 공동수용기는 지질 뗏목에서 노달 전구체를 포착하고 세포 표면에서 한번 크립토는 변환체와 상호작용하여 노달 처리를 용이하게 하는 콤플렉스를 형성한다.[11]
EGF-CFC 단백질
EGF-CFC 단백질은 노달 신호 전달과 척추동물 발달 전반에 필수적인 공동 인자 역할을 하는 막 결합 세포외 인자다. 이 공작용제 제품군에는 제브라피쉬의 외눈 핀헤드(oep), 제노푸스의 FRL1, 생쥐와 인간의 Cripto와 Criptic이 포함된다. 제브라피쉬의 oep에 대한 유전학적 연구는 모성 oep와 zygotic oep의 knockout은 사팔뜨기/사이클로프(nodals) knockout과 유사한 표현형으로 이어진다는 것을 보여주었다. 마찬가지로, 노들(스퀴트/사이클로프)이나 oep 중 하나를 다른 것의 녹아웃과 함께 과도하게 표현하면 표현적 차이가 나타나지 않는다. 이 증거는 oep의 과도한 억제가 어떤 표현형도 보이지 않는다는 데이터와 결합되어 노달 신호에서 필수적인 공동 인자로서의 EGF-CFC의 역할을 확증한다.[12]
다퍼2
마우스, 개구리, 물고기에서 Dapper2는 Wnt 및 TGFβ/노달 신호 경로의 다운-규정을 통해 작용하는 중간자 형성의 음의 조절기다. 제브라피쉬에서 노달은 다페르2의 유전자 발현을 활성화시키는 것으로 알려져 있다.[13] 세포 표면에서 Dapper2는 활성 형태인 활성형 1 수용체에 단단히 결합하고 라이소솜 분해 수용체를 대상으로 한다. Dapper2 ooverxpression은 노달 신호를 변환할 수 없기 때문에 노달 공동수용체 기능 상실을 모방하여 중수체를 적게 생성한다. 생쥐 배아에서 dpr2 mRNA는 임신 7.5일 후 모든 배아에 걸쳐 위치하지만, 그 위치는 8.5-dpc에서 변화하며, 10-dpc, 신경관, octic vesicle 및 내장에 의해 관찰된다. 왜냐하면 Dapper2와 Nodal은 같은 영역에서 표현되기 때문에, 이것은 Daper가 mederm 유도를 반대한다는 것을 암시한다. 노달에서 파생된 [14]신호 어떻게 해서든 활성인 수용체의 감소는 다른 TGFb 경로의 활성 감소를 초래할 것이다.[13]
스마드
스마드 단백질은 노달 신호를 핵으로 변환하는 역할을 한다. 노달 단백질이 활성인 또는 활성인 유사 세린/트레오닌 키나아제 수용체에 결합하면 스마드2의 인산화 효과가 발생한다. 그리고 나서 Smad2는 Smad4와 연관되어 핵으로 번역될 것이며, 따라서 결절 표적 유전자의 전사를 자극할 것이다. 또 다른 스마드인 스마드3는 활성 수용체에 의해 인산염화될 수 있으며, 또한 목도 유전자의 활성제로 기능할 수 있다는 증거가 입증되었다. 그러나 생쥐에서 스마드2의 녹아웃은 원시적인 줄무늬의 형성에 지장을 초래한다. 이것은 Smad3가 Smad2와 어떤 중복 기능을 가지고 있다는 것을 보여주는 모든 중음부 유전자를 쓰러뜨리기에는 충분하지 않다. 그러나 이러한 유전자의 표현은 smad2 KO 배아에서 어디에나 있는 반면 야생형에서는 제한적이다. 스마드3 녹아웃은 표현이 스마드2와 중복된다는 것을 보여주는 표현형식이 없다.[15]
스마드를 통한 결절 활성화에 영향을 미치는 분자
Ectodermin은 단유입성 Smad4를 통해 smad4와 핵 내의 다른 smad의 상호작용을 억제함으로써 결절 경로를 부정적으로 조절하는데, 이 수정으로 인해 FAM 단백질에 의해 디유입될 수 있는 세포질 밖으로 운반되어 다른 smads와 다시 콤플렉스를 형성할 수 있게 된다.[16][17] Smads에 개입하는 경로의 또 다른 음성 조절기는 PPM1A로, Phospho-Smad2/3로 작용하여 비활성화하는 인산염이다.[18] 이후 Smad2/3은 RanBP2의 도움을 받아 핵 밖으로 운반된다.[19]
신호를 제어하는 전사적 요인
Smad2/3/4는 p53, 믹서, FoxH1과 같은 서로 다른 전사 인자와 연관시킬 수 있으며 특정 시스 규제 요소를 인식하여 정확한 시간과 위치에서 노달 표적 유전자의 발현을 활성화하고 중간 유도 시 필요한 유전자를 활성화할 수 있다. 노달 표적 유전자의 활성화를 위해 전사 기계의 일부 구성 요소와 경쟁하는 몇몇 다른 전사 인자가 있다. 예를 들어 Tgif1과 Tgif2는 Smad2의 활성 형태를 위해 경쟁하는 음의 공동규제체로서 핵에서 활성Smad2의 상대농도를 감소시킨다. Xenopus에서는 Tgf1과 Tgf2의 기능 상실이 Xnr5와 Xnr6의 상향 조절을 야기한다.[20] 개구리의 전사적 억제기의 또 다른 예로는 XFDL이 있는데, XFDL은 P53에 결합되어 Smad2/3/4 복합체와의 상호작용을 방해한다.[21]
신호를 제어하는 miRNA
척추동물의 경우 miR-430/427/302의 진화보존가족이 발달 초기에 표현된다. 중간자 및 내분자 규격을 제어하는 데 중요한 역할을 하며, 일부 노달 신호 성분의 단백질 발현 레벨을 조절하여 한다. 이 가족은 텔레ost miR-430, 양서류 miR-427, 포유류 miR-302에 의해 구성된다. In zebra fish the miR-430 inhibits translation of Sqt, Lefty1 and Lefty2, in frogs miR-427 regulate Xnr5, Xnr6b, LeftyA and LeftyB, however in humans embryonic stem cells it has been shown that miR-302 negative regulates the expression of only Lefty1 and Lefty2 but it does not seem down-regulate Nodal protein expression levels.[22]
개발 중인 노달 신호
중음도 유도
여러 연구에서 대부분의 중피 세포와 내피 세포 유형의 유도에 노달 신호가 필요하며 제브라피쉬의 사팔뜨기/사이클로프 녹아웃은 노토코드, 심장, 신장 또는 심지어 혈액까지 발달하지 않는다는 것이 밝혀졌다.[23] 결절 신호 단백질의 기원과 표현 패턴은 종마다 다르다. 포유류 결절 신호는 후두 세포에서 보편적으로 시작되며 Wnt3의 자동 관측 신호에 의해 유지되며, 세르베루스 유사 및 좌뇌와 같은 적대자의 유도에 의해 제한된다.[24] Xenopus에 대한 연구는 식물성 극장에서 VegT에 의해 xnr 표현(Xenopus nodal)이 유도되고, 바스라로 퍼지는 끄덕임이 발견되었다.[25] Xnr 표현은 β-카테닌의 존재에 의해 안정화된다. 이 정보는 노달 신호가 어떻게 내측과 중측 양쪽의 유도로 이어지게 하는가에 대한 의문을 제기한다. 답은 노달 단백질의 구배 형태로 나온다. 결절 신호의 시간적 및 공간적 차이는 세포 운명의 차이를 야기할 것이다. 서로 다른 결절의 길항과 가변적인 범위의 추가와 함께, 배아에 대한 중간과 내장을 포함한 세포 운명의 지도를 그릴 수 있다.[2] 단, 노달 신호의 합계가 되는 것인지, 또는 셀이 신호의 진폭에 반응하는 것인지는 불분명하다.[26]
좌우 패터닝
인체 해부학은 왼쪽에 위치한 심장과 오른쪽에 위치한 간으로 비대칭적이다. 좌우 비대칭(생물학)은 모든 척추동물이 공통적으로 볼 수 있는 특징이며 폐와 같은 쌍대칭 장기도 로브 수의 비대칭을 나타낸다. 노달 신호가 좌우 사양에 영향을 미친다는 증거는 좌우 사양에 부족한 유기체의 유전자 분석에서 나온다. 이러한 유전자 연구는 마우스의 ActRIIB, Criptic, FoxH1과 같은 노달 신호 경로의 구성 요소에서 돌연변이를 식별하도록 이끌었다.[27] 이 연구들은 좌우 대칭이 배아의 우측에 있는 결절 반대자 발현으로 인해 생성된다는 것을 발견했는데, 이는 배아의 다른 절반에 대해 스스로를 조절함으로써 균형을 이루고 있다. 그 결과는 배아의 복측에서 높으며, 길항제 작용을 통해 중간선으로의 구배로서 감소하는 결절 구배다. 노들 신호 경로와 다른 동물들의 PITX2와 같은 그것의 다운스트림 표적에 대한 연구는 그것이 또한 바다거미, 암피오크스, 성게, 연체동물 선에서의 좌우 비대칭 패터닝을 통제할 수 있다는 것을 보여주었다. [28]
신경 패터닝
노달신호 발생으로 인해 노달신호 발생과 중절신호 형성은 노달의 적수인 세르베루스의 표현에 의해 이루어지는 차단노달신호를 필요로 한다. 복측 세포 신경 패터닝을 지정하기 위해 노달 신호가 필요할 때 노달 신호의 역할은 나중에 개발 과정에서 다시 나타난다. 제브라피쉬에서 키클롭스나 oep의 기능 상실은 내측 바닥판과 복측 전뇌의 부족으로 특징지어지는 사이클로프 배아를 낳는다.[2] 모든 끄덕임이 중뇌의 형성을 초래하는 것은 아니다. Xenopus nodal 관련 3, (Xnr3) TGFβ 슈퍼 패밀리의 다이버전트 멤버는 단백질 Xbra의 발현을 유도한다. Xbra 표현 패턴은 표현 패턴의 상관관계에서 또 다른 신경 유발제인 Xlim-1은 Xenopus에서 조직자의 패터링을 유발한다. 이 신호는 다른 결절, 노긴, 코딘, 엽리스타틴 등과 결합하여 척추동물 중추신경계의 최종 패터닝을 초래한다.[29]
참조
- ^ Shen MM (March 2007). "Nodal signaling: developmental roles and regulation". Development. 134 (6): 1023–34. doi:10.1242/dev.000166. PMID 17287255.
- ^ a b c d e Schier AF (2003). "Nodal signaling in vertebrate development". Annu. Rev. Cell Dev. Biol. 19: 589–621. doi:10.1146/annurev.cellbio.19.041603.094522. PMID 14570583.
- ^ Schier AF (November 2009). "Nodal morphogens". Cold Spring Harb Perspect Biol. 1 (5): a003459. doi:10.1101/cshperspect.a003459. PMC 2773646. PMID 20066122.
- ^ Conlon FL, Barth KS, Robertson EJ (April 1991). "A novel retrovirally induced embryonic lethal mutation in the mouse: assessment of the developmental fate of embryonic stem cells homozygous for the 413.d proviral integration". Development. 111 (4): 969–81. doi:10.1242/dev.111.4.969. PMID 1879365.
- ^ Zhou X, Sasaki H, Lowe L, Hogan BL, Kuehn MR (February 1993). "Nodal is a novel TGF-beta-like gene expressed in the mouse node during gastrulation". Nature. 361 (6412): 543–7. Bibcode:1993Natur.361..543Z. doi:10.1038/361543a0. PMID 8429908. S2CID 4318909.
- ^ Thisse C, Thisse B (January 1999). "Antivin, a novel and divergent member of the TGFbeta superfamily, negatively regulates mesoderm induction". Development. 126 (2): 229–40. doi:10.1242/dev.126.2.229. PMID 9847237.
- ^ Piccolo S, Agius E, Leyns L, Bhattacharyya S, Grunz H, Bouwmeester T, De Robertis EM (February 1999). "The head inducer Cerberus is a multifunctional antagonist of Nodal, BMP and Wnt signals". Nature. 397 (6721): 707–10. Bibcode:1999Natur.397..707P. doi:10.1038/17820. PMC 2323273. PMID 10067895.
- ^ Yeo C, Whitman M (May 2001). "Nodal signals to Smads through Cripto-dependent and Cripto-independent mechanisms". Mol. Cell. 7 (5): 949–57. doi:10.1016/S1097-2765(01)00249-0. PMID 11389842.
- ^ Beck S, Le Good JA, Guzman M, Ben Haim N, Roy K, Beermann F, Constam DB (December 2002). "Extraembryonic proteases regulate Nodal signalling during gastrulation". Nat. Cell Biol. 4 (12): 981–5. doi:10.1038/ncb890. PMID 12447384. S2CID 12078090.
- ^ Ben-Haim N, Lu C, Guzman-Ayala M, Pescatore L, Mesnard D, Bischofberger M, Naef F, Robertson EJ, Constam DB (September 2006). "The nodal precursor acting via activin receptors induces mesoderm by maintaining a source of its convertases and BMP4". Dev. Cell. 11 (3): 313–23. doi:10.1016/j.devcel.2006.07.005. PMID 16950123.
- ^ Blanchet MH, Le Good JA, Mesnard D, Oorschot V, Baflast S, Minchiotti G, Klumperman J, Constam DB (October 2008). "Cripto recruits Furin and PACE4 and controls Nodal trafficking during proteolytic maturation". EMBO J. 27 (19): 2580–91. doi:10.1038/emboj.2008.174. PMC 2567404. PMID 18772886.
- ^ Shen MM, Schier AF (July 2000). "The EGF-CFC gene family in vertebrate development". Trends Genet. 16 (7): 303–9. doi:10.1016/S0168-9525(00)02006-0. PMID 10858660.
- ^ a b Chen YG (January 2009). "Endocytic regulation of TGF-beta signaling". Cell Res. 19 (1): 58–70. doi:10.1038/cr.2008.315. PMID 19050695.
- ^ Su Y, Zhang L, Gao X, Meng F, Wen J, Zhou H, Meng A, Chen YG (March 2007). "The evolutionally conserved activity of Dapper2 in antagonizing TGF-beta signaling". FASEB J. 21 (3): 682–90. doi:10.1096/fj.06-6246com. PMID 17197390. S2CID 86415243.
- ^ Whitman M (November 2001). "Nodal signaling in early vertebrate embryos: themes and variations". Dev. Cell. 1 (5): 605–17. doi:10.1016/S1534-5807(01)00076-4. PMID 11709181.
- ^ Dupont S, Zacchigna L, Cordenonsi M, Soligo S, Adorno M, Rugge M, Piccolo S (April 2005). "Germ-layer specification and control of cell growth by Ectodermin, a Smad4 ubiquitin ligase". Cell. 121 (1): 87–99. doi:10.1016/j.cell.2005.01.033. PMID 15820681. S2CID 16628152.
- ^ Dupont S, Mamidi A, Cordenonsi M, Montagner M, Zacchigna L, Adorno M, Martello G, Stinchfield MJ, Soligo S, Morsut L, Inui M, Moro S, Modena N, Argenton F, Newfeld SJ, Piccolo S (January 2009). "FAM/USP9x, a deubiquitinating enzyme essential for TGFbeta signaling, controls Smad4 monoubiquitination". Cell. 136 (1): 123–35. doi:10.1016/j.cell.2008.10.051. PMID 19135894. S2CID 16458957.
- ^ Lin X, Duan X, Liang YY, Su Y, Wrighton KH, Long J, Hu M, Davis CM, Wang J, Brunicardi FC, Shi Y, Chen YG, Meng A, Feng XH (June 2006). "PPM1A functions as a Smad phosphatase to terminate TGFbeta signaling". Cell. 125 (5): 915–28. doi:10.1016/j.cell.2006.03.044. PMC 6309366. PMID 16751101.
- ^ Dai F, Lin X, Chang C, Feng XH (March 2009). "Nuclear export of Smad2 and Smad3 by RanBP3 facilitates termination of TGF-beta signaling". Dev. Cell. 16 (3): 345–57. doi:10.1016/j.devcel.2009.01.022. PMC 2676691. PMID 19289081.
- ^ Powers SE, Taniguchi K, Yen W, Melhuish TA, Shen J, Walsh CA, Sutherland AE, Wotton D (January 2010). "Tgif1 and Tgif2 regulate Nodal signaling and are required for gastrulation". Development. 137 (2): 249–59. doi:10.1242/dev.040782. PMC 2799159. PMID 20040491.
- ^ Sasai N, Yakura R, Kamiya D, Nakazawa Y, Sasai Y (May 2008). "Ectodermal factor restricts mesoderm differentiation by inhibiting p53". Cell. 133 (5): 878–90. doi:10.1016/j.cell.2008.03.035. PMID 18510931. S2CID 16711420.
- ^ Rosa A, Spagnoli FM, Brivanlou AH (April 2009). "The miR-430/427/302 family controls mesendodermal fate specification via species-specific target selection". Dev. Cell. 16 (4): 517–27. doi:10.1016/j.devcel.2009.02.007. PMID 19386261.
- ^ Gritsman K, Talbot WS, Schier AF (March 2000). "Nodal signaling patterns the organizer". Development. 127 (5): 921–32. doi:10.1242/dev.127.5.921. PMID 10662632.
- ^ Brennan J, Lu CC, Norris DP, Rodriguez TA, Beddington RS, Robertson EJ (June 2001). "Nodal signalling in the epiblast patterns the early mouse embryo". Nature. 411 (6840): 965–9. Bibcode:2001Natur.411..965B. doi:10.1038/35082103. PMID 11418863. S2CID 4402639.
- ^ Kofron M, Demel T, Xanthos J, Lohr J, Sun B, Sive H, Osada S, Wright C, Wylie C, Heasman J (December 1999). "Mesoderm induction in Xenopus is a zygotic event regulated by maternal VegT via TGFbeta growth factors". Development. 126 (24): 5759–70. doi:10.1242/dev.126.24.5759. PMID 10572051.
- ^ Green J (December 2002). "Morphogen gradients, positional information, and Xenopus: interplay of theory and experiment". Dev. Dyn. 225 (4): 392–408. doi:10.1002/dvdy.10170. PMID 12454918. S2CID 6480950.
- ^ Burdine RD, Schier AF (April 2000). "Conserved and divergent mechanisms in left-right axis formation". Genes Dev. 14 (7): 763–76. PMID 10766733.
- ^ Namigai, E; Kenny NJ; Shimeld SM (2014). "Right across the tree of life: the evolution of left–right asymmetry in the Bilateria". Genesis. 52 (6): 458–470. doi:10.1002/dvg.22748. PMID 24510729. S2CID 24995729.
- ^ Taira M, Saint-Jeannet JP, Dawid IB (February 1997). "Role of the Xlim-1 and Xbra genes in anteroposterior patterning of neural tissue by the head and trunk organizer". Proc. Natl. Acad. Sci. U.S.A. 94 (3): 895–900. Bibcode:1997PNAS...94..895T. doi:10.1073/pnas.94.3.895. PMC 19610. PMID 9023353.
추가 읽기
- Baker K, Holtzman NG, Burdine RD (September 2008). "Direct and indirect roles for Nodal signaling in two axis conversions during asymmetric morphogenesis of the zebrafish heart". Proc. Natl. Acad. Sci. U.S.A. 105 (37): 13924–9. Bibcode:2008PNAS..10513924B. doi:10.1073/pnas.0802159105. PMC 2544555. PMID 18784369.
- Chea HK, Wright CV, Swalla BJ (October 2005). "Nodal signaling and the evolution of deuterostome gastrulation". Dev. Dyn. 234 (2): 269–78. doi:10.1002/dvdy.20549. PMID 16127715. S2CID 24982316.
- Chen Y, Schier AF (May 2001). "The zebrafish Nodal signal Squint functions as a morphogen". Nature. 411 (6837): 607–10. Bibcode:2001Natur.411..607C. doi:10.1038/35079121. PMID 11385578. S2CID 4325920.
- Dougan ST, Warga RM, Kane DA, Schier AF, Talbot WS (May 2003). "The role of the zebrafish nodal-related genes squint and cyclops in patterning of mesendoderm". Development. 130 (9): 1837–51. doi:10.1242/dev.00400. PMID 12642489.
- Luxardi G, Marchal L, Thomé V, Kodjabachian L (February 2010). "Distinct Xenopus Nodal ligands sequentially induce mesendoderm and control gastrulation movements in parallel to the Wnt/PCP pathway". Development. 137 (3): 417–26. doi:10.1242/dev.039735. PMID 20056679.

