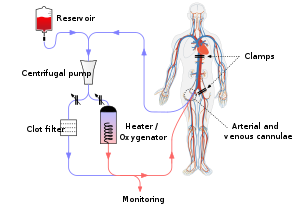
기계 관류
Machine perfusion기계관류(MP)는 이식 대상 장기를 보존하는 수단으로 장기이식에 사용되는 기술이다.
기계 관류에는 다양한 형태가 있으며, 관류액의 온도에 따라 냉간(4°C)과 온간(37°[1]C)으로 분류할 수 있습니다.기계 관류는 신장이식, 간이식[3],[2][4] 폐이식에 적용되어 왔다.스태틱 콜드 스토리지(SCS)의 대체 수단입니다.
연구 개발
2022년에는 보통 12시간 미만에서 3일 동안 간의 기계 관류를 통해 장기 장기 장기 보존이 보고된 바 있다.저온 보존법에 [5][6]의해 10일까지 연장되어 상당한 세포 손상을 방지할 수 있습니다.대안적 접근법에는 새로운 저온 보호 [7][8]용제가 포함됩니다.
신장 보존 기술의 역사
신장 저장 및 이식 개발을 위한 필수 사전은 혈관 [9]문합을 위한 방법을 개발하는 알렉시스 카렐의 작업이었다.Carrel은 1902년에 개에게 수행된 최초의 신장 이식에 대해 설명했고, Ulman은[10] 같은 해에 비슷한 실험을 독립적으로 설명했습니다.이 실험에서 신장은 보관을 시도하지 않고 이식되었다.
신장의 체외 저장을 가능하게 하는 중요한 단계는 1943년 [11]Fuhrman에 의해 분리된 조직의 대사 과정에 대한 저체온증의 가역적인 영향을 증명한 것이다.이전에 신장은 혈액이나 희석된 혈액 [12][13]관류액을 사용하여 정상 체온에 저장되었지만 성공적인 재이식은 이루어지지 않았다.Fuhrman은 쥐의 신장 피질과 뇌의 슬라이스가 산소 소비량이 최소인 온도에서 1시간 동안 0.2°C까지 냉각되는 것을 견뎠다는 것을 보여주었다.슬라이스를 37°C로 다시 데웠을 때 산소 소비량이 정상으로 복구되었습니다.
허혈성 온전한 신장에 대한 저체온증의 이로운 영향은 1955년[14] 오웬스에 의해 입증되었는데, 오웬스는 개를 23-26°C로 식히고 흉부 대동맥을 2시간 동안 막으면 개를 다시 데웠을 때 그들의 신장은 뚜렷한 손상을 보이지 않는다는 것을 보여주었다.이 저체온증이 신장허혈증 손상에 미치는 보호효과는 2시간 동안 고정시킨 개 신장의 표면냉각에 의한 보호효과는 Bogardus에[15] 의해 확인되었다.모이어는[16] 저체온성 허혈증의 같은 기간 동안 개와 인간의 신장 기능에 동일한 효과를 보여줌으로써 이러한 개 실험의 인간에 대한 적용 가능성을 입증했다.
1958년이 되어서야 온전한 개의 신장이 낮은 온도로 식혀진다면 허혈증을 더 잘 견뎌낼 수 있다는 것이 입증되었다.Stueber는[17] 신장을 냉각 재킷에 넣어 0-5°C까지 식히면 신장 경정에서 6시간 동안 생존할 수 있다는 것을 보여주었고, Schloerb는[18] 헤파린화된 개 신장을 2-4°C로 식히는 유사한 기술이 12시간이 아닌 8시간 동안 보호를 제공한다는 것을 보여주었다.Schloerb는 또한 체외 보관과 냉각된 신장의 자가 이식을 시도했고, 4시간 동안 신장 보관 후 재이식과 즉시 대측신 절제술로 장기 생존자 1명을 얻었다.그는 또한 콩팥을 24시간 보관하고 반대쪽 신전 절제술을 지연시킨 후 콩팥에 말기 동맥혈전증이 발병한 개를 거의 생존시켰다.
이러한 표면 냉각 방법은 신장 혈관 시스템을 보관하기 전에 차가운 액체로 씻어내는 기술의 도입으로 개선되었습니다.이것은 신장의 냉각 속도를 증가시키는 효과가 있었고 혈관계에서 적혈구를 제거했다.Kiser는[19] 이 기술을 사용하여 저장하기 전에 덱스트란과 희석된 혈액의 혼합물로 신장이 5°C에서 플러싱되었을 때 개의 신장을 성공적으로 7시간 체외 저장했다.1960년[20] 랍친스키는 신장 28시간 동안 2-4°C에서 보관된 후 생존한 개 8마리를 보고한 후 자가이식과 지연된 대측신 절제술이 가능하다는 것을 확인했다.Lapchinsky는 그의 논문에서 자세한 내용을 밝히지 않았지만, 이러한[21] 실험들은 차가운 혈액으로 신장을 1시간 동안 냉각시킨 후 2-4°C에서 보관한 후 다시 따뜻한 혈액으로 신장을 1시간 이상 데우는 것을 포함했다고 Humpries는 보고했다.대측방신절제술은 두 달 동안 지연되었다.
Humphries는[21] 보관 기간 내내 신장에 지속적으로 관류를 공급하여 이 보관 기술을 개발했습니다.그는 희석된 혈장이나 혈청을 관류액으로 사용했으며 신장 부종을 방지하기 위해 낮은 관류액 압력의 필요성을 지적했지만 관류액 온도2, Po, 흐름 등의 변수에 대한 최적의 값은 아직 알려지지 않았음을 인정했다.이때 그의 가장 좋은 결과는 4-10°C에서 24시간 동안 신장을 보관한 후 살아남은 개 2마리로, 몇 주 후 자가이식과 지연된 대측신절제술이었다.
Calne은[22] 훨씬 더 간단한 기술을 사용하여 성공적인 12시간 보존을 달성할 수 있다는 것을 증명함으로써 지속적인 관류 방법의 필요성에 도전했습니다.Calne은 재이식 수술과 동시에 반대쪽 신전 절제술을 시행했을 때에도 생명을 지탱하는 하나의 신장을 가지고 있었다.Calne은 개의 신장을 헤파린화한 다음 4°C의 얼음 용액에 저장했습니다.신장 절제술이 지연될 때 한 번의 실험에서 17시간 보존이 가능한 것으로 나타났지만, 24시간 보관으로 성공을 거두지 못했다.
다음 발전은 1964년 험프리에 의해[23] 이루어졌는데, 그는 그의 원래 연속 관류 시스템에 사용된 관류액을 수정했고, 심지어 재이식과 동시에 즉시 반대쪽 신전 절제술이 수행되었을 때에도 24시간 보관 후 생명을 유지할 수 있는 개의 신장을 가졌습니다.이 실험에서는 Tis-U-Sol 용액으로 10 °C에서 50% 희석한 자가 혈액을 Perfusate로 사용했다.관류액 압력은 40mm Hg, 관류액 pH 7.11-7.35(37°C에서)였습니다.혈액 손상을 방지하기 위해 막 폐가 산소화에 사용되었다.
이 결과들을 향상시키기 위해 노력하는 가운데 Manax[24], 신장이 저장에 앞선dextran/Tis-U-Sol 해결책을 7.9대기 압력에서 물이 개 신장의 성공적인48-hour 저장 2°C에서의 끊임 없는 관류를 사용하지 않고, 가능하다는 것을 발견했고, 반대쪽 다리 nephr 고압 산소의 영향을 조사했다.ecto재이식 후 2주에서 4주까지 지연되었습니다.마낙스는 고압산소가 신진대사를 억제하거나 신장 세포로 산소가 확산되는 것을 돕는 것으로 작용한다고 가정했지만, 그는 그의 모델의 다른 측면이 고압산소보다 더 중요한지를 결정하기 위한 통제 실험을 보고하지 않았다.
1967년[25] 벨저는 8-12°C에서 개 혈장 기반 관류액을 사용하여 연속 관류한 후 72시간 신장 저장에 성공했다고 보고했습니다.Belzer는[26] 복잡한 72시간 관류를 가능하게 하는 중요한 요인은 관류액에서 사용되는 혈장의 저온 침강으로 불안정한 지방단백질의 양을 감소시켰으며, 그렇지 않으면 용액에서 침강되어 신장의 혈관계를 점진적으로 방해한다는 것을 알아냈다.또한 저온 침전에 의해 리포 단백질의 35%만이 제거되었기 때문에 리포 단백질의 변성을 방지하기 위해 막 산소 공급기가 시스템에 사용되었습니다.Perfusate는 개 혈장 1리터, 황산 마그네슘 4mEq, 덱스트로스 250ml, 인슐린 80유닛, 페니실린 200,000유닛, 히드로코르티손 100mg으로 구성되었습니다.Perfusate는 저온 침전된 것 외에 사용 직전에 0.22 마이크론 필터를 통해 사전 여과되었습니다.Belzer는 맥동성 Perfusate 흐름을 생성하는 기계에서 7.4~7.5의 Perfusate pH, 1502~190 mm Hg의 Po 및 50~80 mm의 Perfusate 압력을 사용했습니다.이 시스템을 사용하여 Belzer는 신장이 72시간 동안 저장된 후 생존한 6마리의 개를 재이식했고, 재이식 수술에서 즉시 반대쪽 신절제술을 수행했습니다.
보존 보조제로 벨저의 하이드로코르티손 사용은 개의 신장 [27]슬라이스에 대한 Lotke의 연구에서 제안되었다. Hydrocortisone은 2-4°C에서 30시간 보관 후 PAH와 산소를 배출하는 슬라이스의 능력을 향상시켰다. Lotke는 이러한 실험들에서 하이드로코르티손이 리소좀 막 안정제 역할을 할 수 있다고 제안했다.Belzer 모델의 다른 구성요소는 경험적으로 도달했다.인슐린과 마그네슘은 인공 동면을 유도하기 위해 부분적으로 사용되었는데, 수오말라이넨은[28] 이 방법이 자연 동면기에서 동면을 유도하는 데 효과적이라는 것을 발견했기 때문이다.이 마그네슘은 개 심장 보존에 효과적인 약제라는 가미야마 씨의 실증[29] 후에 대사 억제제로도 제공되었습니다.마그네슘에 대한 또 다른 근거는 혈장 내 구연산염에 의해 결합되었던 칼슘을 대체할 필요가 있다는 것이었다.
벨저는[30] 그가 개의 신장에 사용했던 것과 같은 저장 기술을 사용하여 인간 신장이식에 대한 자신의 경험을 보고했을 때 그의 개 실험의 인간 신장 저장에 대한 적용 가능성을 증명했습니다.그는 기증자가 잘 준비되었을 때 수술 후 투석이 필요한 환자 중 8%만이 신장을 50시간까지 저장할 수 있었다.
1968년[31] 험프리스는 여분의 지방산이 함유된 희석된 혈장 배지를 사용하여 10°C에서 5일간 관류 기계에 신장을 보관한 후 14마리 중 1마리의 생존자를 보고했다.그러나 재이식 후 4주 후 지연된 대측신절제술은 이러한 실험에서 성공을 거두기 위해 필요했으며, 이는 보관 중에 신장이 심하게 손상되었음을 시사했다.
1969년에[32] 콜린스는 저체온 신장 저장의 단순한 비관류 방법으로 달성할 수 있는 결과의 개선을 보고했다.그는 저장 중에 신장에서 전해질이 손실되는 것을 세포에 정상적으로 존재하는 양이온을 함유한 저장액을 사용함으로써 막을 수 있다는 켈러의 관찰에[33] 그의 기술을 기초했다.콜린스의 모델에서, 개들은 신 절제술 전에 수분을 충분히 공급받았고, 또한 이뇨를 유도하기 위해 만니톨을 투여받았다.혈관확장제이자 리소좀 효소 안정제인 [34][35]페녹시벤자민은 신장 절제술 전에 신장 동맥에 주입되었다.신장은 제거 직후 식염수에 담가 100cm 높이에서 100~150ml의 차가운 전해질 용액을 신장 동맥을 통해 관류했다.신장은 남은 저장 기간 동안 얼음 식염수에 남아 있었다.이러한 성공적인 냉류 관류를 위해 사용된 용액은 다량의 칼륨과 마그네슘을 함유함으로써 세포 내 액체의 전해질 구성을 모방했습니다.용액에는 포도당, 헤파린, 프로카인 및 페녹시벤자민도 함유되어 있었다.용액의 pH는 25°C에서 7.0이었다.콜린스는 6개의 신장을 24시간 보관하고 3개의 신장을 30시간 보관하는 데 성공했으며, 재이식 후 즉시 신장이 기능했다.Collins는 표면 냉각만으로 처리된 신장과 비교했을 때 이러한 관리에서 유사한 결과를 발견한 Ringer's solution flushing에서 얻은 나쁜 결과를 강조했다.Liu는[36] 콜린스의 용액이 아미노산과 비타민의 함유로 수정되었을 때 48시간 동안 성공적으로 저장될 수 있었다고 보고했다.그러나 Liu는 이러한 수정이 중요하다는 것을 보여주기 위해 대조 실험을 수행하지 않았습니다.
다른 작업자들은 Belzer의 성공적인 72시간 관류 스토리지 실험을 반복하는 데 어려움을 발견했습니다.우즈는[37] 저체온 관류 시스템의 관류액으로 저온흡입 혈장을 가진 벨저 첨가물을 사용해 신장 6개 중 3개를 48시간 보관하는 데 성공했지만 벨저처럼 보관 시간을 72시간으로 늘리지 못했다.하지만[38] 우즈는 이후 개의 신장을 3일과 7일 동안 보관하는 데 성공했다.Woods는 250mg의 메틸프레드니솔론을 첨가하여 Belzer's Perfusate를 수정했고, 황산 마그네슘 함량을 16.2mEq, 인슐린을 320유닛으로 증가시켰다.신장 6개 중 6개는 즉시 측방신절제술에도 불구하고 72시간 보관 후 재이식 시 생명유지 기능을 발휘했고, 신장 2개 중 1개는 96시간 보관 후, 2개 중 1개는 120시간 보관 후, 1개는 168시간 보관 후 생명유지 기능을 발휘했다.Perfusate 압력은 60 mm Hg, Perfusate pump rate는 분당 70회였으며, CO 적정기에2 의해 Perfusate pH가 자동으로 7.4로 유지되었다.우즈는 기증자와 기증받은 동물들의 수분공급의 중요성을 강조했다.메틸프레드니솔론이 없다면, 우즈는 저장 시간이 48시간 이상일 때 선박의 파괴력이 문제가 된다는 것을 알게 되었다.
1972년[40] Johnson과 Claes가[39] 알부민 기반의 Perfusate를 도입하면서 저체온 관류 저장 기술을 크게 단순화했습니다.이 Perfusate는 Belzer가 사용하는 극저온 침강 및 밀리포어 여과 플라즈마를 제조할 필요가 없어졌습니다.이 관류액의 준비는 힘들고 시간이 걸렸고 간염 바이러스와 세포독성 항체로 인한 잠재적 위험이 있었다.관류액에서 리포 단백질의 부재는 리포 단백질의 침전을 방지하기 위해 관류액/공기 계면을 피할 필요가 없기 때문에 관류 회로에서 막 산소 공급기를 제거할 수 있음을 의미했다.두 근로자 모두 Belzer가 추천한 것과 동일한 첨가제를 사용했습니다.
존슨이 사용한 용액은 혈액제품연구소(Elstree: England)가 혈장에서 열연성 피브리노겐과 감마 글로불린을 추출해 혈장단백질분율(PPF) 용액을 만들어 준비했다.용액을 60 [41]°C에서 10시간 동안 배양하여 혈청 간염의 작용제를 비활성화하였다.그 결과 소량의 감마 및 베타 글로불린이 함유된 45g/l 인간 알부민 용액이 5년간 [42]0°C에서 30°C 사이에서 안정적이었다.PPF에는 2.2mmol/l의 유리지방산이 [43]함유되어 있었다.
존슨의 실험은[39] 주로 장기간의 따뜻한 부상으로 손상된 신장의 저장에 관한 것이었다.하지만, 따뜻하지 않은 상처 입은 개의 신장을 대조군에서는, 존슨은 PPF 관류액을 사용하면 24시간 보존이 쉽다는 것을 보여주었고, 그는 72시간 관류 후 생존자와 즉시 반대쪽 신장을 이식한 후 다른 곳에서 생존자를 묘사했다[44].따뜻하게 다친 신장의 경우, 6마리 중 6마리가 40분간의 따뜻한 부상과 24시간 보관 후 생존한 후 신장 재이식과 즉시 반대쪽 신전 절제술로 콜린스의 방법보다 더 나은 결과를 보였다.PPF 용액에 칼륨, 마그네슘, 인슐린, 포도당, 히드로코르티손, 암피실린을 첨가하여 에너지원을 제공하고 세포 내 칼륨 누출을 방지하였다.Perfusate 온도는 6°C, 압력은 40–80mmHg, Po는2 200–400mmHg였습니다.pH는 7.2와 7.4 사이에서 유지되었다.
Claes는[40] 인간 알부민(Kabi:(스웨덴) 45g/l 농도로 식염수로 희석한다.Claes는 개 신장 5개 중 4개를 96시간 동안 보존했고, 즉시 반대쪽 신장 절제술에도 불구하고 재이식 직후 신장이 기능했다.Claes는 또한 이 관류액을 대조군에서 Belzer의 저온흡입 혈장과 비교했고 두 그룹에서 다시 이식된 신장의 기능 사이에 유의미한 차이를 발견하지 못했다.
우즈 외에 유일하게 7일간의 신장 보존에 성공한 그룹은 1973년 류와 험프리스였다[45].그들은 그들의 신장이 7일 동안 저장되고 나서 재이식과 즉각적인 대측방신절제술이 있은 후, 7마리 중 3마리가 살아남았다.그들의 가장 좋은 개는 재이식 후 크레아티닌이 50mg/l(0.44mmol/l)로 최고조에 달했다.Liu는 만니톨 이뇨제를 복용하는 잘 수분을 공급받은 개를 사용했으며 인간 PPF에서 유래한 Perfusate를 사용하여 신장을 9°C – 10°C에 저장했다.PPF는 수용성 고분자(Pluronic F-38)를 사용하여 더욱 세분화되었으며, 저온 살균을 가능하게 하는 안정제로 아세틸 트립토판산나트륨과 카프릴산나트륨이 PPF에 첨가되었다.이 용액에 인간 알부민, 헤파린, 만니톨, 포도당, 황산마그네슘, 염화칼륨, 인슐린, 메틸프레드니솔론, 카르베니실린, 물을 첨가하여 삼투압을 300~310 mosmol/kg으로 조절하였다.관류액은 보관일로부터 3.5일 후에 교환되었습니다.Perfusate 압력은 분당 60의 펌프 속도로 60 mm Hg 이하였다.Perfusate pH는 7.12~7.32(37°C에서), Pco2 27~47mmHg, Po2 173~219mmHg이었다.이 연구에[46] 대한 추가 보고서에서 험프리스는 PPF의 새로운 배치로 실험을 반복했을 때 생존자를 얻지 못했고, 초기 실험에서 생존자의 조직학에서 사구체성 과세포성을 보였으며, 이는 Pluronic 폴리머의 가능한 독성 효과에 기인했다.
조이스와 프록터는[47] 개의 신장을 72시간 동안 보관하기 위해 간단한 덱스트란 기반의 관류액을 성공적으로 사용했다고 보고했다.신장 17개 중 10개는 재이식 및 즉시 대측신 절제술 후에 생존했습니다.Joyce는 4°C에서 덱스트란 70(Pharmacia)을 2.1% 함유한 관류액과 추가적인 전해질, 포도당(19.5g/l), 프로카인 및 하이드로코르티손과 함께 비맥동 관류를 사용했다.관류액에는 플라즈마 또는 플라즈마 성분이 포함되어 있지 않았습니다.관류수 압력은 30cm HO2, pH 7.34-7.40, Po2 250–400mm Hg에 불과했다.이 연구에서는 72시간 보관 시 포도당 이외의 영양소가 필요하지 않았으며 낮은 관류액 압력과 흐름이 적절했다.
1973년[48] Sacks는 초기 냉각 및 신장 세척을 위해 새로운 플러싱 용액을 사용했을 때 72시간 저장에 간단한 얼음 저장을 성공적으로 사용할 수 있다는 것을 보여주었습니다.색스는 만니톨 주입 후 이뇨 중인 수분을 잘 섭취한 개에서 신장을 제거하고 100cm 높이에서 200ml의 용액으로 신장을 씻어냈다.그런 다음 신장은 추가 관류 없이 72시간 동안 2°C로 유지되었다.재이식 후 즉시 대측방신절제술이 이어졌다.이 플러시 용액은 세포 내 유체 구성을 모방하도록 설계되었으며 세포 부기를 더욱 방지하기 위해 불침투성 이온으로 만니톨을 함유하였다.용액의 삼투압은 2 °C에서 430 mosmol/kg, pH는 7.0이었다.Collins가 사용하던 첨가물(덱스트로스, 페녹시벤자민, 프로카인, 헤파린)은 Sacks에 의해 누락되었다.
이러한 결과는 Ross가 Collins' 또는 Sacks의 원래 솔루션을 사용하여 Collins' 또는 Sacks의 결과를 재현할 수는 없었지만 지속적인 관류를 사용하지 않고 72시간 동안 성공적으로 보관하는 데에도[49] 동일한 결과를 얻었습니다.Ross의 성공적인 용액은 전해질 성분에서 고토닉 구연산염과 만니톨을 첨가한 세포 내 액체와 유사했다.용액에는 인산염, 중탄산염, 염화물 또는 포도당이 존재하지 않았다. 삼투압은 400 mosmol/kg, pH 7.1이었다. 8마리 중 5마리는 신장이 로스의 용액으로 플러싱된 후 72시간 동안 저장되었을 때 신장 재이식과 즉시 반대쪽 신전 절제술에서 살아남았다. 그러나 로스는 7을 달성하지 못했다.지연된 대측신절제술이 사용되었을 때에도 이 기술로 주간 보관을 할 수 있었다.
성공적인 72시간 저체온 관류 보관을 위한 요건은 콜린스에 의해 추가로 정의되었으며, 콜린스는 49 mm Hg의 관류 압력을 사용할 경우 맥동 관류가 필요하지 않으며 7 °C가 2 °C 또는 12 °[50][51]C보다 보관하기에 더 좋은 온도라는 것을 보여주었다.그는 또한 다양한 관류산염 조성물을 비교하여 인산염 완충 관류산염이 성공적으로 사용될 수 있다는 것을 알아냈으며, 따라서 이산화탄소 [50]공급이 필요하지 않았다.그룬드만은[52] 또한 낮은 관류수 압력이 적절하다는 것을 보여주었다.그는 72시간 관류에서 20mm Hg의 평균 맥박 압력을 사용했고, 이는 15, 40, 50 또는 60mm Hg의 평균 압력보다 더 나은 결과를 얻었다.
Cohen은 다양한[53] 유형의 Perfusate를 사용하여 최대 8일 동안 보관에 성공했다고 보고했으며, 8°C에서 인산염 완충 Perfusate를 사용할 때 최상의 결과를 얻었습니다.이러한 성공적인 실험을 반복할 수 없는 것은 PPF가 더 높은 옥탄산 함량이 유해한 상태에서 제조되는 방식에 변화가 있었기 때문인 것으로 생각되었다.옥탄산은 저체온 관류[54] 중에 대사 활동을 자극할 수 있으며 이는 해로울 수 있다.
신장 보존 손상의 성질
구조 손상
이전에 다치지 않은 신장의 72시간 저체온 저장 동안 발생하는 구조적 변화는 맥케이에 의해[55] 설명되었으며, 맥케이는 특히 근위세관에 영향을 미치는 세포의 세포질의 점진적 액포화가 어떻게 일어났는지를 보여주었다.전자현미경 검사에서 미토콘드리아는 내부 크리스탈 막의 조기 분리와 이후 모든 내부 구조의 손실로 인해 팽창하는 것으로 나타났다.리소좀의 완전성은 늦게까지 잘 보존되었고, 세포의 파괴는 용해 효소에 의해 야기되지 않은 것으로 보인다.[citation needed] 왜냐하면 리소좀 바로 옆에 세포의 다른 부분보다 더 큰 손상이 없었기 때문이다.
Woods와[38][56][45] Liu는 성공적인 5일 및 7일 신장 저장에 대해 설명할 때 관류 말기와 사후 부검에서 볼 수 있는 빛 현미경적 변화를 설명했지만 림프구 침윤과 간혹 일어나는 관상 위축을 제외하고는 심각한 이상을 거의 발견하지 못했다.
재이식 전 인간 신장의 짧은 관류 동안의 변화는 재이식 후 1시간 후에 생체 검사를 수행한 힐에 의해[57] 설명되었습니다.전자현미경 검사에서 힐은 재이식 후 섬유소 침착의 심각도와 상관되는 내피 손상을 발견했다.힐이 광현미경 검사에서 사구체에서 본 변화는 간혹 섬유소 혈전과 다형체 침윤이었다.힐은 이러한 변화가 면역학적으로 유발된 병변이라고 의심했지만 조직학적 병변의 심각성과 면역글로불린 [citation needed]퇴적물의 유무 사이에는 상관관계가 없다는 것을 발견했다.
관류 보관 중 신장에 의해 생성된 소변의 분석에 대한 여러 보고가 있다.Kastagir는[58] 24시간 관류하는 동안 생성된 소변을 분석하여 관류액의 초여과율임을 확인하였고[59] Scott는 24시간 관류하는 동안 소변에서 미량의 단백질을, Pederson은[60] 36시간 관류하는 동안 미량의 단백질만을 발견했습니다.페더슨은 이전 실험에서 심한 단백뇨를 발견했다고 언급했다.우즈는[56] 5일 동안 보관한 후 생존 가능한 신장의 세관에 단백질이 함유된 것을 발견했지만 관류 시 발생하는 소변에 대해서는 분석하지 않았다.Cohen의[53] 연구에서 소변의 단백질 함량이 Perfusate와 같아질 때까지 8일간 보존하는 동안 소변 단백질 농도가 점진적으로 증가했습니다.이는 사구체 기저막의 팽창과 같은 관류 저장 기간 동안 관찰된 상피 세포 발 과정의 점진적 융합과 관련이 있을 수 있다.
부상의 메커니즘
저체온 보관 중에 신장을 손상시키는 메커니즘은 다음과 같이 세분할 수 있습니다.
- 다음을 원인으로 하는 세포의 대사 과정에 대한 손상:
- 추워요
- 저체온 보관 기간 전후에 신장이 따뜻할 때 나타나는 산소 결핍증.
- 올바른 영양소를 공급하지 못했습니다.
- 관류액에 독소가 쌓였어요
- 저장액에 의한 유독성 손상
- 신장 세포에서 필수 기질을 씻어냅니다.
- 핵 DNA에 대한 손상.
- 저체온 관류 중 신장의 혈관계에 대한 기계적 손상.
- 재이식 후 부상.
대사 손상
추워요
정상 온도에서 세포벽의 펌프 메커니즘은 높은 수준으로 세포 내 칼륨을 유지하고 나트륨을 추출합니다.이러한 펌프가 실패하면 나트륨은 세포에 흡수되고 칼륨은 손실됩니다.물은 나트륨을 수동적으로 따라다니며 세포의 붓기를 일으킨다.이 세포 붓기 조절의 중요성은 개의 신장 피질수 함량과 36시간 보관 후 생명을 유지하는 신장의 능력 사이의 유의한 상관관계를 발견한 McLoughlin에[61] 의해 입증되었다.펌핑 메커니즘은 Na+K+활성[62] ATPase로 알려진 효소 시스템에 의해 구동되며 추위에 의해 억제된다.레비는[63] 산소 소비량 측정에서 알 수 있듯이 10°C에서 대사 활성이 정상의 약 5%로 감소했으며, 모든 효소 시스템이 저체온증에 의해 유사한 방식으로 영향을 받기 때문에 10°C에서 ATPase 활성이 현저하게 감소한다는 것을 발견했다.
그러나 저체온증에 견딜 수 있는 조직의 능력의 차이를 설명할 수 있는 이 ATP 효소의 저온 감수성에는 조직과 종의 차이가 있다.마틴은[64] 개의 신장 피질 세포에서 일부 ATP 효소 활성은 여전히 10°C에서 존재하지만 0°C에서는 존재하지 않는다는 것을 보여 주었다.간 및 심장 세포 활동은 10°C에서 완전히 억제되었으며, ATPase의 냉감도의 차이는 간 및 심장 세포의 저체온 저장 동안 세포 부기를 제어하는 데 더 큰 어려움과 관련이 있었다.혈관 벽에서 구별되는 ATP 효소가 발견되며, Belzer에[65] 의해 이 온도에서 신장 피질 세포 ATP 효소가 여전히 활성 상태일 때 10 °C에서 완전히 억제되는 것으로 나타났다.이러한 실험은 대동맥 내피에서 수행되었지만, 신장의 혈관 내피가 동일한 특성을 가지고 있다면 혈관 손상이 신장 장기 저장의 제한 요인이 될 수 있습니다.
윌리스는[66] 동면자들이 나트륨과 칼륨을 세포막을 통해 활발하게 운반할 수 있는 Na+K+-ATPase를 5°C에서 가지고 있어 낮은 온도에서 생존하는 능력을 얻는 방법을 보여주었습니다. 이 이동 속도는 세포 붓기를 방지하기에 충분합니다.
조직의 냉각 속도는 효소 시스템에 대한 손상 생성에도 유의할 수 있습니다.프랑카빌라는[67] 간 슬라이스를 급속 냉각(6분 이내에 12°C로 즉시 냉각)했을 때 37°C로 다시 데울 때 혐기성 당분해가 지연 냉각된 슬라이스에서 확인된 활성의 약 67%에 의해 억제되었음을 보여주었다.그러나 개의 신장 슬라이스는 간 슬라이스보다 급속 냉각에 의한 심각한 영향을 덜 받았습니다.
아녹시아
모든 세포는 신진대사 활동을 위한 에너지원으로 ATP를 필요로 한다.신장 피질 세포가 혐기성 조건에서 세포의 요구를 충족시키기에 충분한 ATP를 생성하지 못할 때 신장은 산소 결핍에 의해 손상된다.신장을 절제할 때 신장 동맥을 분할하고 신장을 식히는 동안 일부 산소 부족은 불가피하다.버그스트롬은[68] 개의 신장 피질 세포 중 50%의 ATP 함량이 신장 동맥을 클램핑한 후 1분 이내에 손실된다는 것을 보여주었고, 워닉에[69] 의해 약 30초 후에 세포 ATP가 50% 감소하는 유사한 결과가 전체 생쥐 신장에서 발견되었다.워닉과 버그스트롬은 또한 제거 직후 신장을 식히는 것이 추가적인 ATP 손실을 현저하게 감소시킨다는 것을 보여주었다.이러한 온상을 입지 않은 신장이 산소화된 저체온 혈장으로 관류되었을 때, 24시간 보관 후 ATP 수치는 50% 감소했고 48시간 후, 평균 조직 ATP 수치는 ATP 합성이 일어났음을 나타내는 이것보다 약간 더 높았다.Pegg는[70] 토끼 신장이 따뜻한 부상 후 관류 저장 기간 후에 ATP를 재합성할 수 있다는 것을 보여주었지만, 따뜻하게 다치지 않은 신장에서는 재합성이 일어나지 않았다.
보관 후 신장을 재이식하는 동안에도 따뜻한 무산소가 발생할 수 있다.Lannon은[71] 석신산염 대사를 측정함으로써 신장이 보관 직전에 발생하는 같은 기간의 따뜻한 저산소증에 비해 보관 후 발생하는 따뜻한 저산소증에 얼마나 더 민감한지 보여주었다.
필수 영양소 부족
중탄산염 생성과 포도당의 활성 대사가 Petterson과[72] [53]Cohen에 의해 입증되었다.
페터슨 연구는[72] 6일 저체온 관류 저장 동안 신장에 의한 포도당과 지방산의 대사에 관한 연구였으며, 그는 신장이 포도당을 4.4 μmol/g/day, 지방산을 5.8 μmol/g/day로 소비하는 것을 발견했다.Cohen의 연구에서[53] 최고의 8일 저장 신장은 각각 2.3μmol/g/day 및 4.9μmol/g/day의 속도로 포도당을 소비했으며, 이는 페터슨 개의 신장과 유사한 속도로 지방산을 사용했을 가능성이 높았다.포도당 소비율과 중탄산염 생성 속도의 일관성은 해당과정 효소 또는 탄산무수분해효소 시스템에 어떠한 손상도 영향을 미치지 않음을 암시했다.
Lee는[73] 지방산이 정상 온도의 토끼 신장 피질에서 선호되는 기질이고 포도당은 정상적으로 혐기적으로 대사되는 수세포에서 선호되는 기질임을 보여주었다.Laidely는[74] 지방산과 포도당이 토끼 신장의 바깥쪽 수질에 의해 이용될 수 있지만 포도당이 우선적으로 사용되었음을 보여주었다.저체온증에서 신장의 신진대사 요구는 크게 감소하지만 포도당, 지방산 및 케톤체의 측정 가능한 소비가 발생한다.호스버그는[43] 15°C의 쥐 신장 피질에서 팔미틴산염 소비가 정상의 0-15%인 저체온성 신장에 의해 지질 사용됨을 보여주었다.페터슨은[72] 저체온 관류 신장에 의해 어금니 기준으로 포도당과 지방산이 거의 같은 속도로 대사된다는 것을 보여주었다.저체온 개 신장의 피질은 올레산염이 신장 관류액에 첨가되지 않는 한 지질을 잃는 것으로 Huang에 의해 나타났다[75].Huang은 이 손실이 세포의 구조에 영향을 줄 수 있으며, 그 손실은 신장이 지방산을 사용하고 있다는 것을 암시한다고 말했다.이후 출판물에서[76] Huang은 개의 신장 피질이 포도당이 아닌 대사 지방산을 10°C에서 얇게 잘라낸다는 것을 보여주었다.
올바른 영양소가 제공되어도 보존 시스템의 튜브에 흡수되어 손실될 수 있다.Lee는[77] 4시간의 관류 후 실리콘 고무(신장 보존 시스템에 널리 사용되는 물질)가 관류액의 46%를 흡수한다는 것을 증명했다.
독소 축적
Abouna는[78] 3일간의 신장 저장 동안 암모니아가 관류액으로 방출된다는 것을 보여주었고, 관류액의 빈번한 교체로 제거되지 않는 한 이는 신장 세포에 독성이 있을 수 있음을 시사했다.장기 관류 시 관류액 교환 사용에 대한 일부 지원은 7일간의 성공적인 스토리지 실험에서 관류액 교환을 사용한 Liu에 의해[45] 제공되었습니다.Grundmann은[79] 또한 96시간 보존 품질이 두 배 부피의 Perfusate를 사용하거나 Perfusate 교환을 통해 향상되었음을 발견했습니다.그러나 그룬드만의 결론은 오직 3마리의 개로 구성된 대조군과의 비교에 기초했다.Cohen은[53] 관류 8일 동안 암모니아 생성을 증명할 수 없었고 관류 중 알칼리성 진행은 중탄산염 생산에 의한 것으로 나타났습니다.
Perfusate에 의한 독성 손상
특정 관류액은 특정 화학물질이 잘못 함유되어 신장에 독성 영향을 미치는 것으로 나타났다.콜린스는[80] 플러시 액체의 제제에 포함된 프로카인이 독성이 있을 수 있다는 것을 보여주었고[81], Pegg는 PVC 가소제와 같은 독성 물질이 관류 회로 튜브에서 어떻게 세척될 수 있는지를 언급했습니다.드보락은[82] 우즈가 필수적이라고[56] 생각했던 관류액에 메틸프레드니솔론을 첨가하는 것이 어떤 상황에서는 해로울 수 있다는 것을 보여주었다.그는 관류 후 650ml의 메틸-프레드니솔론 650ml에 g 이상의 메틸-프레드니솔론이 함유된 상태에서(Woods가 사용한 1L당 250mg과 비교) 20시간 후에 신장에 돌이킬 수 없는 혈류역학 및 구조적 변화가 발생했음을 보여주었다.모세관 고리의 괴사, 보먼의 공간 폐색, 기저막 비후, 내피세포 손상 등이 있었습니다.
필수 기판 세척
저장[69] 후 세포에 남아 있는 뉴클레오티드의 수준은 세포가 ATP를 재합성하고 다시 따뜻해진 후에 회복할 수 있는지를 결정하는 데 중요하다고 워닉은 생각했다.관류액의 빈번한 변화나 다량의 관류액의 사용은 분해된 아데닌 뉴클레오티드가 세포에서 씻겨나갈 수 있고, 따라서 신장이 다시 따뜻해졌을 때 ATP로 재합성할 수 없다는 이론적 단점을 가지고 있다.
핵 DNA 손상
핵 DNA는 신장을 냉동 보관하는 동안 손상된다.Lazarus는[83] 저체온으로 저장된 생쥐의 신장에서 16시간 이내에 단일 가닥 DNA 파괴가 일어났으며, 콜린스나 색스의 용액에 저장함으로써 손상이 약간 억제된다는 것을 보여주었다.이 핵 손상은 이중 가닥 DNA 파손이 [84]일어났을 때 보였던 온상과는 달랐다.
혈관 시스템의 기계적 손상
관류 저장 방법은 신장 혈관 내피를 기계적으로 손상시켜 재이식 후 동맥 혈전증이나 섬유소 침착을 초래할 수 있습니다.Hill은[57] 사람의 신장에서 재이식 후 사구체 내 섬유소 침착과 수술 후 기능이 관류 저장의 길이와 관련이 있다고 지적했다.그는 관류나 얼음 저장으로 보존된 인간의 신장에서 혈관이 회복될 때 생체 검사를 받았고 전자 현미경으로 내피 교란이 관류된 신장에서만 발생한다는 것을 보여주었다.혈관 재혈관계 후 1시간 경과 후 생체검사에서 혈소판과 섬유소가 제거된 혈관 기저막의 모든 부위에 부착되어 있는 것으로 나타났다.다른 유형의 혈관 손상은 Sheil에[85] 의해 설명되었으며, Sheil은 제트 병변이 신장 동맥에 연결된 캐뉼라 원위부로 생성되어 캐뉼라 부위에서 약 1cm 원위부위의 동맥 혈전증으로 이어질 수 있는 방법을 보여주었다.
재이식 후
관류액이 특정 항체를 포함할 경우 재이식 후 면역학적 메커니즘이 저체온 관류 신장을 손상시킬 수 있다는 증거가 있다.크로스는[86] 한 쌍 중 한 쌍에 대해 특정 HLA 항체를 포함하는 저온흡입 혈장과 함께 동시에 관류된 두 쌍의 인간 시체 신장에 대해 설명했다.이 두 신장 모두 초기 동맥 혈전증을 앓았다.빛은[87] 관류 저장 후 유사한 초급성 거부를 설명했으며 사용된 극저온 침강 혈장에 세포독성 IgM 항체가 포함되어 있음을 보여주었다.cryoprecipitated 플라즈마를 이용해서 이 잠재적인 위험성은 실험적으로 Filo[88]는 24시간 동안 특별히 sensitisedcryoprecipitated 개 플라즈마와 화해를 했고, 다 형 핵의 leucocyte에 의해 모세 혈관 충혈, 내피 부풀음, 침투와 혈관 사구체 병변을 유도할 수 있다는 것을 알아내개 신장 perfused에 의해 입증되었습니다.가 어떻게 되nd 동맥 혈전증.면역 형광 현미경 검사는 내피 표면, 사구체 및 혈관 내 IgG의 특이적 결합을 보여주었다.재이식 후 보체고정 및 조직손상이 비슷한 패턴으로 발생했다.조직학적 손상의 심각성과 신장의 후속 기능 사이에는 약간의 상관관계가 있었다.
많은 근로자들이 재이식 중에 신장이 다시 따뜻해지는 것을 막으려고 시도했지만, 오직 Cohen만이 능동 [53]냉각 시스템을 사용한다고 설명했습니다.냉각 시스템 내부 또는 외부로 위장 문합된 신장에서 리소좀 효소 방출을 측정한 결과, 냉각 시스템의 효소 방출 방지 효과가 확인되었습니다.재이식 수술에서 부상을 최소화하는 또 다른 요인은 신장이 냉각 코일 내에서 7°C로 유지되었고, 이는 관류 저장 시 사용된 온도 범위 내에 있었기 때문에 신장이 얼음 냉각이 이루어졌더라면 발생했을 온도 변화에 영향을 받지 않았을 수 있습니다.ed.
뎀스터는[89] 신장 재이식 수술이 끝날 때 신장에 손상을 주지 않기 위해 혈관 클램프를 천천히 풀어주는 방법을 사용했다고 설명했지만 다른 근로자들은 이 방법을 사용했는지 여부에 대해 언급하지 않았다.Cohen이 관류 보관 [53]3일 후 신장 내 출혈과 함께 혈관 손상을 발견한 후, 모든 후속 실험에 느린 혈관 재생 기술을 사용하여 신장 내 혈관이 연약한 사구체 혈관에 수축기 압력이 완전히 가해지지 않도록 충분히 회복할 시간을 주도록 했다.그의 이후 관류에서 심각한 혈관 손상이 없는 것은 이 기법의 사용에 기인할 수 있다.
레퍼런스
- ^ Kay, Mark D.; Hosgood, Sarah A.; Harper, Simon J.F.; Bagul, Atul; Waller, Helen L.; Nicholson, Michael L. (November 2011). "Normothermic Versus Hypothermic Ex Vivo Flush Using a Novel Phosphate-Free Preservation Solution (AQIX) in Porcine Kidneys". Journal of Surgical Research. 171 (1): 275–282. doi:10.1016/j.jss.2010.01.018. PMID 20421110.
- ^ Yong, Cissy; Hosgood, Sarah A.; Nicholson, Michael L. (June 2016). "Ex-vivo normothermic perfusion in renal transplantation: past, present and future". Current Opinion in Organ Transplantation. 21 (3): 301–307. doi:10.1097/MOT.0000000000000316. ISSN 1087-2418. PMID 27145197. S2CID 22627245.
- ^ Ceresa, Carlo D. L.; Nasralla, David; Coussios, Constantin C.; Friend, Peter J. (February 2018). "The case for normothermic machine perfusion in liver transplantation: Ceresa et al". Liver Transplantation. 24 (2): 269–275. doi:10.1002/lt.25000. PMID 29272051.
- ^ Cypel, Marcelo; Yeung, Jonathan C.; Liu, Mingyao; Anraku, Masaki; Chen, Fengshi; Karolak, Wojtek; Sato, Masaaki; Laratta, Jane; Azad, Sassan; Madonik, Mindy; Chow, Chung-Wai (2011-04-14). "Normothermic Ex Vivo Lung Perfusion in Clinical Lung Transplantation" (PDF). New England Journal of Medicine. 364 (15): 1431–1440. doi:10.1056/NEJMoa1014597. ISSN 0028-4793. PMID 21488765. S2CID 10576812. Archived from the original (PDF) on 2020-02-22.
- ^ "Transplant success: Liver survives out of body for days". BBC News. 31 May 2022. Retrieved 24 June 2022.
- ^ Clavien, Pierre-Alain; Dutkowski, Philipp; Mueller, Matteo; Eshmuminov, Dilmurodjon; Bautista Borrego, Lucia; Weber, Achim; Muellhaupt, Beat; Sousa Da Silva, Richard X.; Burg, Brian R.; Rudolf von Rohr, Philipp; Schuler, Martin J.; Becker, Dustin; Hefti, Max; Tibbitt, Mark W. (31 May 2022). "Transplantation of a human liver following 3 days of ex situ normothermic preservation". Nature Biotechnology: 1–7. doi:10.1038/s41587-022-01354-7. ISSN 1546-1696. PMID 35641829. S2CID 249234907.
- ^ "New cryoprotectant chemicals could preserve organs without ice damage". New Atlas. 22 June 2022. Retrieved 24 June 2022.
- ^ Bryant, Saffron J.; Awad, Miyah N.; Elbourne, Aaron; Christofferson, Andrew J.; Martin, Andrew V.; Meftahi, Nastaran; Drummond, Calum J.; Greaves, Tamar L.; Bryant, Gary (22 June 2022). "Deep eutectic solvents as cryoprotective agents for mammalian cells". Journal of Materials Chemistry B. 10 (24): 4546–4560. doi:10.1039/D2TB00573E. ISSN 2050-7518. PMID 35670530.
- ^ Carrel A (1902). "La technique operatoire des anastomoses vasculaires et la transplantation des visceres". Lyon Med. 98: 859–864.
- ^ Ullman E (1902). "Experimentalle Nierentransplantation". Wein Klin Wochschr. 15: 281–282.
- ^ Fuhrman FA, Field J (1943). "The reversibility of the inhibition of rat brain and kidney metabolism by cold". Am J Physiol. 139 (2): 193–196. doi:10.1152/ajplegacy.1943.139.2.193.
- ^ Carrel A, Lindbergh CA (1935). "The culture of whole organs". Science. 81 (2112): 621–623. Bibcode:1935Sci....81..621C. doi:10.1126/science.81.2112.621. PMID 17733174. S2CID 19034161.
- ^ Bainbridge FA, Evans CL (1914). "The heart, lung, kidney preparation". J Physiol. 48 (4): 278–286. doi:10.1113/jphysiol.1914.sp001661. PMC 1420524. PMID 16993254.
- ^ Owens, J. Cuthbert (1955-01-01). "Prolonged Experimental Occlusion of Thoracic Aorta During Hypothermia". Archives of Surgery. 70 (1): 95–7. doi:10.1001/archsurg.1955.01270070097016. ISSN 0004-0010. PMID 13217608.
- ^ Bogardus GM, Schlosser RJ (1956). "The influence of temperature upon ischaemic renal damage". Surgery. 39 (6): 970–974. PMID 13324611.
- ^ Moyer, John H.; Morris, George; DeBakey, Michael E. (January 1957). "Hypothermia: I. Effect on Renal Hemodynamics and on Excretion of Water and Electrolytes in Dog and Man". Annals of Surgery. 145 (1): 26–40. doi:10.1097/00000658-195701000-00003. ISSN 0003-4932. PMC 1465379. PMID 13395281.
- ^ Stueber, P.; Kovacs, S.; Koletsky, S.; Persky, L. (July 1958). "Regional renal hypothermia". Surgery. 44 (1): 77–83. ISSN 0039-6060. PMID 13556447.
- ^ Schloerb, P. R.; Waldorf, R. D.; Welsh, J. S. (November 1959). "The protective effect of kidney hypothermia on total renal ischemia". Surgery, Gynecology & Obstetrics. 109: 561–565. ISSN 0039-6087. PMID 14442912.
- ^ Kiser, J. C.; Farley, H. H.; Mueller, G. F.; Strobel, C. J.; Hitchcock, C. R. (1960). "Successful renal autografts in the dog after seven hour selective kidney refrigeration". Surgical Forum. 11: 26–28. ISSN 0071-8041. PMID 13756355.
- ^ Lapchinsky AG (1960). "Recent results of experimental transplantation of preserved limbs and kidneys and possible use of this technique in clinical practice". Ann N Y Acad Sci. 87 (1): 539–569. Bibcode:1960NYASA..87..539L. doi:10.1111/j.1749-6632.1960.tb23220.x. PMID 14414086. S2CID 41367748.
- ^ a b Humphries AL; Russell R; Ostafin J; Goodrich SM; Moretz WH (1962). "Successful reimplantation of Dog kidney after 24-hour storage". Surgical Forum. 13: 380–382. PMID 13955710.
- ^ Calne, R. Y.; Pegg, D. E.; Pryse-Davies, J.; Brown, F. L. (1963-09-14). "Renal Preservation by Ice-cooling". BMJ. 2 (5358): 640–655. doi:10.1136/bmj.2.5358.640-a. ISSN 0959-8138. PMC 1872740. PMID 14046169.
- ^ Humphries, A. L.; Moretz, W. H.; Peirce, E. C. (April 1964). "Twenty-Four Hour Kidney Storage with Report of a Successful Canine Autotransplant After Total Nephrectomy". Surgery. 55: 524–530. ISSN 0039-6060. PMID 14138017.
- ^ Manax, William G. (1965-05-31). "Hypothermia and Hyperbaria: Simple Method for Whole Organ Preservation". JAMA. 192 (9): 755–9. doi:10.1001/jama.1965.03080220019004. ISSN 0098-7484. PMID 14285707.
- ^ Belzer, Folkert O.; Ashby, B.Sterry; Dunphy, J.Englebert (September 1967). "24-Hour and 72-Hour Preservation of Canine Kidneys". The Lancet. 290 (7515): 536–539. doi:10.1016/S0140-6736(67)90498-9. PMID 4166894.
- ^ Belzer, Folkert O.; Ashby, B. Sterry; Huang, Josephine S.; Dunphy, J. Englebert (September 1968). "Etiology of Rising Perfusion Pressure in Isolated Organ Perfusion". Annals of Surgery. 168 (3): 382–391. doi:10.1097/00000658-196809000-00008. ISSN 0003-4932. PMC 1387342. PMID 4877588.
- ^ Lotke PA (1966). "Lysosome stabilising agents for hypothermic kidney preservation". Nature. 212 (5061): 512–513. Bibcode:1966Natur.212..512L. doi:10.1038/212512a0. PMID 5339142.
- ^ Suomalainen P (1938). "Production of artificial hibernation". Nature. 142 (3609): 1157. Bibcode:1938Natur.142.1157S. doi:10.1038/1421157a0. S2CID 4087215.
- ^ Kamiyama, Teiko M. (1970-05-01). "Preservation of the Anoxic Heart With a Metabolic Inhibitor and Hypothermia". Archives of Surgery. 100 (5): 596–9. doi:10.1001/archsurg.1970.01340230062016. ISSN 0004-0010. PMID 4908950.
- ^ Belzer FO, Kountz SL (1970). "Preservation and transplantation of human cadaver kidneys: a two year experience". Ann Surg. 172 (3): 394–404. doi:10.1097/00000658-197009000-00009. PMC 1397323. PMID 4918001.
- ^ Humphries, A. L.; Russell, R.; Stoddard, L. D.; Moretz, W. H. (May 1968). "Successful five-day kidney preservation. Perfusion with hypothermic, diluted plasma". Investigative Urology. 5 (6): 609–618. ISSN 0021-0005. PMID 4914852.
- ^ Collins, G.M.; Bravo-Shugarman, Maria; Terasaki, P.I. (December 1969). "Kidney Preservation for Transportation". The Lancet. 294 (7632): 1219–1222. doi:10.1016/S0140-6736(69)90753-3. PMID 4187813.
- ^ Keeler, R.; Swinney, J.; Taylor, R. M. R.; Uldall, P. R. (December 1966). "The Problem of Renal Preservation1". British Journal of Urology. 38 (6): 653–656. doi:10.1111/j.1464-410X.1966.tb09773.x. PMID 5335118.
- ^ Duff RS, Ginsberg J (1957). "Some peripheral vascular effects of intra-arterial dibenyline in man". Clin Sci. 16 (1): 187–196. PMID 13414151.
- ^ Rangel DM, Bruckner WL, Byfield JE, Dinbar JE, Yakeishi Y, Stevens GH, Fonkalsrud EW (1969). "Enzymatic evaluation of hepatic preservation using cell-stabilising drugs". Surg Gynecol Obstet. 129: 963–972.
{{cite journal}}: CS1 maint: 여러 이름: 작성자 목록(링크) - ^ Liu, Wen-Pen; Humphries, ArthurL.; Stoddard, LelandD.; Moretz, WilliamH. (August 1970). "48-Hour Kidney Storage". The Lancet. 296 (7669): 423. doi:10.1016/S0140-6736(70)90041-3. PMID 4194732.
- ^ Woods, John E. (1970-11-01). "Problems in 48- to 72-Hour Preservation of Canine Kidneys". Archives of Surgery. 101 (5): 605–9. doi:10.1001/archsurg.1970.01340290061013. ISSN 0004-0010. PMID 5479705.
- ^ a b Woods JE (1971). "Successful three- to seven-day preservation of canine kidneys". Arch Surg. 102 (6): 614–616. doi:10.1001/archsurg.1971.01350060078024. PMID 4930759.
- ^ a b Johnson, R. W. G.; Anderson, Marilyn; Flear, C. T. G.; Murray, Sheila G. H.; Taylor, R. M. R.; Swinney, John (March 1972). "Evaluation of a New Perfusion Solution for Kidney Preservation". Transplantation. 13 (3): 270–275. doi:10.1097/00007890-197203000-00012. ISSN 0041-1337. PMID 4553729. S2CID 35755493.
- ^ a b Claes, G.; Aurell, M.; Blohmé, I.; Pettersson, S. (1972). "Experimental and clinical results of continuous hypothermic albumin perfusion". Proceedings of the European Dialysis and Transplant Association. European Dialysis and Transplant Association. 9: 484–490. ISSN 0071-2736. PMID 4589766.
- ^ Murray R, Diefenbach WCL (1953). "Effect of heat on the agent of homologous serum hepatitis". Proc Soc Exp Biol Med. 84 (1): 230–231. doi:10.3181/00379727-84-20599. PMID 13120994. S2CID 29635377.
- ^ Hink, J. H.; Pappenhagen, .A. R.; Lundblad, J.; Johnson, F. F. (June 1970). "Plasma Protein Fraction (Human)". Vox Sanguinis. 18 (6): 527–541. doi:10.1111/j.1423-0410.1970.tb02185.x. PMID 4104308. S2CID 71936479.
- ^ a b Horsburgh T (1973). "Possible role of free fatty acids in kidney preservation media". Nature New Biology. 242 (117): 122–123. doi:10.1038/newbio242122a0. PMID 4513414.
- ^ 존슨 RWG 신장 보존 연구 중뉴캐슬, 영국:1973년 뉴캐슬 대학교 94pp.M.S. 논문
- ^ a b c Liu, W. P.; Humphries, A. L.; Russell, R.; Stoddard, L. D.; Garcia, L. A.; Serkes, K. D. (1973). "Three- and seven-day perfusion of dog kidney with human plasma protein fraction IV-4". Surgical Forum. 24: 316–318. ISSN 0071-8041. PMID 4806016.
- ^ Humphries, A. L.; Garcia, L. A.; Serkes, K. D. (September 1974). "Perfusates for long-term preservation by continuous perfusion". Transplantation Proceedings. 6 (3): 249–253. ISSN 0041-1345. PMID 4606897.
- ^ Joyce M, Proctor E (1974). "Hypothermic perfusion-preservation of dog kidneys for 48-72 hours without plasma derivatives or membrane oxygenation". Transplantation. 18 (6): 548–550. doi:10.1097/00007890-197412000-00014. PMID 4612890.
- ^ Sacks, Stephen A.; Petritsch, Peter H.; Kaufman, Joseph J. (May 1973). "Canine Kidney Preservation Using a New Perfusate". The Lancet. 301 (7811): 1024–1028. doi:10.1016/S0140-6736(73)90665-X. PMID 4122110.
- ^ Ross, H.; Marshall, Vernon C.; Escott, Margaret L. (June 1976). "72-Hr Canine Kidney Preservation Without Continuous Perfusion". Transplantation. 21 (6): 498–501. doi:10.1097/00007890-197606000-00009. ISSN 0041-1337. PMID 936278. S2CID 29098639.
- ^ a b Collins GM, Halasz NA (1974). "Simplified 72-hr kidney storage". Surgical Forum. 25: 275–277. PMID 4612775.
- ^ Collins GM, Halasz NA (1973). "The role of pulsatile flow in kidney preservation". Transplantation. 16 (4): 378–379. doi:10.1097/00007890-197310000-00018. PMID 4583153.
- ^ Grundmann, R.; Raab, M.; Meusel, E.; Kirchhoff, R.; Pichlmaier, H. (March 1975). "Analysis of the optimal perfusion pressure and flow rate of the renal vascular resistance and oxygen consumption in the hypothermic perfused kidney". Surgery. 77 (3): 451–461. ISSN 0039-6060. PMID 1092016.
- ^ a b c d e f g Cohen, Geoffrey Leonard (1982). 8 day kidney preservation. copac.jisc.ac.uk (Ch.M thesis). University of Liverpool. OCLC 757144327. EThOS uk.bl.ethos.535952. (등록 필요)
- ^ Cohen, G.L.; Burdett, K.; Johnson, R.W.G. (December 1985). "Stimulation of oxygen consumption by oleic and octanoic acid during hypothermic kidney preservation". Cryobiology. 22 (6): 615–616. doi:10.1016/0011-2240(85)90078-1.
- ^ Mackay B, Moloney PJ, Rix DB. "신장 보존 및 관류에서의 전자 현미경 사용"입력: Norman JC, ED장기 관류 및 보존.뉴욕: Appleton Century Crofts, 1968:697-714.
- ^ a b c Woods, J. E.; Fleisher, G. A.; Hirsche, B. L. (September 1974). "Five-day perfusion of canine kidneys: a postulated effect of steroids". Transplantation Proceedings. 6 (3): 255–260. ISSN 0041-1345. PMID 4153357.
- ^ a b Hill, G. S.; Light, J. A.; Perloff, L. J. (April 1976). "Perfusion-related injury in renal transplantation". Surgery. 79 (4): 440–447. ISSN 0039-6060. PMID 769223.
- ^ Kastagir BK, Kabb K, Leonards JR (1969). "Ultrastructure in the canine kidney preserved for 24 hours". Trans Am Soc Artif Intern Organs. 15: 214–218.
{{cite journal}}: CS1 maint: 여러 이름: 작성자 목록(링크) - ^ Scott, D. F.; Morley, A. R.; Swinney, J. (September 1969). "Canine renal preservation following hypothermic perfusion and subsequent function". British Journal of Surgery. 56 (9): 688–691. doi:10.1002/bjs.1800560913. PMID 4897217. S2CID 44273808.
- ^ Pedersen, F. B.; Hrynczuk, J. R.; Scheibel, J. H.; Sørensen, B L (January 1973). "Urine Production and Metabolism of Glucose and Lactic Acid in the Kidney During 36 Hours of Cooling and Perfusion with Diluted Plasma". Scandinavian Journal of Urology and Nephrology. 7 (1): 68–73. doi:10.3109/00365597309133675. ISSN 0036-5599. PMID 4701659.
- ^ McLoughlin, Gerard A.; Sells, Robert A.; Tyrrell, Irene (May 1974). "An evaluation of kidney preservation techniques". British Journal of Surgery. 61 (5): 406–409. doi:10.1002/bjs.1800610520. PMID 4598857. S2CID 3249755.
- ^ Glynn IM (1968). "Membrane adenosine triphosphatase and cation transport". Br Med Bull. 24 (2): 165–169. doi:10.1093/oxfordjournals.bmb.a070620. PMID 4231272.
- ^ Levy MN (1959). "Oxygen consumption and blood flow in the hypothermic, perfused kidney". Am J Physiol. 197 (5): 1111–1114. doi:10.1152/ajplegacy.1959.197.5.1111. PMID 14416432.
- ^ Martin, David R.; Scott, David F.; Downes, Glenn L.; Belzer, Folkert O. (January 1972). "Primary Cause of Unsuccessful Liver and Heart Preservation: Cold Sensitivity of the ATPase System". Annals of Surgery. 175 (1): 111–117. doi:10.1097/00000658-197201000-00017. ISSN 0003-4932. PMC 1355165. PMID 4258534.
- ^ Belzer, Folkert O.; Hoffman, Robert; Huang, Josephine; Downes, Glenn (October 1972). "Endothelial damage in perfused dog kidney and cold sensitivity of vascular NaK-ATPase". Cryobiology. 9 (5): 457–460. doi:10.1016/0011-2240(72)90163-0. PMID 4265432.
- ^ Willis JS (1966). "Characteristics of ion transport in kidney cortex of mammalian hibernators". J Gen Physiol. 49 (6): 1221–1239. doi:10.1085/jgp.0491221. PMC 3328324. PMID 5924109.
- ^ Francavilla, Antonio; Brown, Theodore H.; Fiore, Rosa; Cascardo, Sergio; Taylor, Paul; Groth, Carl G. (1973). "Preservation of Organs for Transplantation Evidence of Detrimental Effect of Rapid Cooling". European Surgical Research. 5 (5): 384–389. doi:10.1159/000127678. ISSN 1421-9921. PMID 4595412.
- ^ Bergstrom J, Collste H, Groth C, Hultman E, Melin B (1971). "Water, electrolyte and metabolic content in cortical tissue from dog kidneys preserved by hypothermia". Proc Eur Dialysis Transplant Ass. 8: 313–320.
{{cite journal}}: CS1 maint: 여러 이름: 작성자 목록(링크) - ^ a b Warnick CT, Lazarus HM (1979). "The maintenance of adenine nucleotide levels during kidney storage in intracellular solutions". Proc Soc Exp Biol Med. 160 (4): 453–457. doi:10.3181/00379727-160-40469. PMID 450910. S2CID 29011354.
- ^ Pegg, D. E; Wusteman, M. C.; Foreman, J. (November 1981). "Metabolism of Normal and Ischemically Injured Rabbit Kidneys During Perfusion for 48 Hours at 10 C". Transplantation. 32 (5): 437–443. doi:10.1097/00007890-198111000-00020. ISSN 0041-1337. PMID 7330963.
- ^ Lannon, S. G.; Tukaram, K. T.; Oliver, J. A.; MacKinnon, K. J.; Dossetor, J. B. (May 1967). "Preservation of kidneys assessed by a biochemical parameter". Surgery, Gynecology & Obstetrics. 124 (5): 999–1004. ISSN 0039-6087. PMID 5336874.
- ^ a b c Pettersson, Silas; Claes, Göran; Scherstén, Tore (1974). "Fatty Acid and Glucose Utilization During Continuous Hypothermic Perfusion of Dog Kidney". European Surgical Research. 6 (2): 79–94. doi:10.1159/000127708. ISSN 1421-9921. PMID 4425410.
- ^ Lee, James B.; Vance, Vernon K.; Cahill, George F. (1962-07-01). "Metabolism of C 14 -labeled substrates by rabbit kidney cortex and medulla" (PDF). American Journal of Physiology. Legacy Content. 203 (1): 27–36. doi:10.1152/ajplegacy.1962.203.1.27. ISSN 0002-9513. PMID 14463505. S2CID 33890310. Archived from the original (PDF) on 2019-02-26.
- ^ Abodeely DA, Lee JB (1971). "Fuel of respiration of renal medulla". Am J Physiol. 220 (6): 1693–1700. doi:10.1152/ajplegacy.1971.220.6.1693. PMID 4253387.
- ^ Huang, J. S.; Downes, G. L.; Belzer, F. O. (September 1971). "Utilization of fatty acids in perfused hypothermic dog kidney". Journal of Lipid Research. 12 (5): 622–627. doi:10.1016/S0022-2275(20)39482-7. ISSN 0022-2275. PMID 5098398.
- ^ Huang, Josephine S.; Downes, Glenn L.; Childress, Gwendolyn L.; Felts, James M.; Belzer, Folkert O. (October 1974). "Oxidation of 14C-labeled substrates by dog kidney cortex at 10 and 38 °C". Cryobiology. 11 (5): 387–394. doi:10.1016/0011-2240(74)90105-9. PMID 4452273.
- ^ Lee KY (1971). "Loss of lipid to plastic tubing". J Lipid Res. 12 (5): 635–636. doi:10.1016/S0022-2275(20)39484-0. PMID 5098400.
- ^ Abouna, G. M.; Lim, F.; Cook, J. S.; Grubb, W.; Craig, S. S.; Seibel, H. R.; Hume, D. M. (March 1972). "Three-day canine kidney preservation". Surgery. 71 (3): 436–444. ISSN 0039-6060. PMID 4551562.
- ^ Grundmann, R; Berr, F; Pitschi, H; Kirchhoff, R; Pichlmaier, H (March 1974). "Ninety-Six-Hour Preservation of Canine Kidneys". Transplantation. 17 (3): 299–305. doi:10.1097/00007890-197403000-00010. ISSN 0041-1337. PMID 4592185. S2CID 37365155.
- ^ Collins GM, Halasz NA (1976). "Forty-eight hour ice storage of kidneys. Importance of cation content". Surgery. 79 (4): 432–435. PMID 769222.
- ^ Pegg, D. E.; Fuller, B. J.; Foreman, J.; Green, C. J. (December 1972). "The choice of plastic tubing for organ perfusion experiments". Cryobiology. 9 (6): 569–571. doi:10.1016/0011-2240(72)90182-4. ISSN 0011-2240. PMID 4658019.
- ^ Dvorak, Kenneth J.; Braun, William E.; Magnusson, Magnus O.; Stowe, Nicholas T.; Banowsky, Lynn H. W. (February 1976). "Effect of High Doses of Methylprednisolone on the Isolated, Perfused Canine Kidney". Transplantation. 21 (2): 149–157. doi:10.1097/00007890-197602000-00010. ISSN 0041-1337. PMID 1251463. S2CID 29825354.
- ^ Lazarus, Harrison M.; Warnick, C.Terry; Hopfenbeck, Arlene (April 1982). "DNA strand breakage after kidney storage". Cryobiology. 19 (2): 129–135. doi:10.1016/0011-2240(82)90133-X. PMID 7083879.
- ^ Lazarus HM, Hopfenbeck A (1974). "DNA degradation during storage". Experientia. 30 (12): 1410–1411. doi:10.1007/bf01919664. PMID 4442530. S2CID 5240888.
- ^ Sheil, A. G. Ross; Drummond, J. Malcolm; Boulas, John (August 1975). "Vascular Thrombosis in Machine-Perfused Renal Allografts". Transplantation. 20 (2): 178–9. doi:10.1097/00007890-197508000-00016. ISSN 0041-1337. PMID 1101485.
- ^ Cross, Donald E.; Whittier, Frederick C.; Cuppage, Francis E.; Crouch, Thomas; Manuel, Eugene L.; Grantham, Jared J. (June 1974). "Hyperacute Rejection of Renal Allografts Following Pulsatile Perfusion with a Perfusate Containing Specific Antibody". Transplantation. 17 (6): 626–628. doi:10.1097/00007890-197406000-00013. ISSN 0041-1337. PMID 4597928.
- ^ Light, Jimmy A.; Annable, Charles; Perloff, Leonard J.; Sulkin, Michael D.; Hill, Gary S.; Etheredge, Edward E.; Spees, Everett K. (June 1975). "Immune Injury from Organ Preservation". Transplantation. 19 (6): 511–516. doi:10.1097/00007890-197506000-00010. ISSN 0041-1337. S2CID 45211253.
- ^ Filo, R. S.; Dickson, L. G.; Suba, E. A.; Sell, K. W. (July 1974). "Immunologic injury induced by ex vivo perfusion of canine renal autografts". Surgery. 76 (1): 88–100. ISSN 0039-6060. PMID 4601595.
- ^ Dempster, W. J.; Kountz, S. L.; Jovanovic, M. (1964-02-15). "Simple Kidney-storage Technique". BMJ. 1 (5380): 407–410. doi:10.1136/bmj.1.5380.407. ISSN 0959-8138. PMC 1813389. PMID 14085969.