카테리시딘
Cathelicidin| 카테리시딘 | |||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 식별자 | |||||||||||||||||||||||||||||||||||||||||||||||||||
| 에일리어스 | 카테리시딘 | ||||||||||||||||||||||||||||||||||||||||||||||||||
| 외부 ID | Gene Cards : [ 1 ] | ||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| 위키데이터 | |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
기본적으로 대식 세포와 다 형 핵의 백혈구(PMNs)의 lysosomes에 저장됩니다 Cathelicidin 항균 펩티드(장군 진영)은 폴리 펩티드는 인간에서, 장군 진영 유전자인데proteinase 3-mediated 세포 밖의 분열에 의해 LL-37.[1][2]LL-37 있는 유일한 후춧가루는 능동적인 형태로 가공된 펩티드 전구체 CAP-18(18kDa), 부호화합니다.ptide인체에서 발견되는 카테리시딘 계열에서 발견됩니다.[3]
카테리시딘 펩타이드는 양친매라고 불리는 이중성 분자입니다: 분자의 한쪽 끝은 물에 끌리고 지방과 단백질에 의해 거부되며, 다른 쪽 끝은 지방과 단백질에 이끌리고 물에 의해 거부됩니다.이 과의 구성원들은 세포막을 분해, 손상 또는 뚫음으로써 병원균에 반응한다.
따라서 카테리시딘은 포유류의 선천적 면역 방어에 중요한 역할을 한다.[4]카테리시딘 계열의 펩타이드는 항균 펩타이드(AMP)로 분류된다.AMP 패밀리에는 디펜신도 포함되어 있습니다.디펜신은 공통적인 구조적 특징을 공유하지만, 카테리시딘 관련 펩타이드는 매우 [4]이질적이다.항균성 폴리펩타이드 카테리시딘 계열의 구성원은 고도로 보존된 영역(카텔린 도메인)과 매우 가변적인 카테리시딘 펩타이드 [4]도메인을 특징으로 한다.
카테리시딘 펩타이드는 많은 포유류 종에서 분리되었다.카테리시딘은 박테리아, 바이러스, 곰팡이, 기생충 또는 비타민 [6]D의 호르몬 활성 형태인 1,25-D에 의해 활성화된 후 호중구, 단구, 비만 세포, 수지상 세포 및 대식세포에서[5] 주로 발견된다.그들은 상피세포와 인간 각질세포를 [7]포함한 일부 다른 세포에서 발견되었다.
어원학
이 용어는 1995년 [8]카테리시딘에 존재하는 특징적인 카테린 유사 영역 때문에 카테린에서 만들어졌다.카테린이라는 이름은 1989년 [9]카테프신 L 억제제에서 유래했다.
항균 활성 메커니즘
카테리시딘 작용을 촉발하는 메커니즘의 일반적인 법칙은 다른 항균성 펩타이드와 마찬가지로 펩타이드가 [10]활성화된 유기체의 세포막의 붕괴(손상 및 구멍 뚫림)를 포함한다.곰팡이, 세균 및 바이러스 병원균에 대한 항균 효과가 관찰되었습니다.
카테리시딘은 대식세포에서 리소좀과 융합한 후 파고솜에 둘러싸인 미생물들의 리포단백질막을 빠르게 파괴한다.따라서 LL-37은 세균 생체막 [11]형성을 억제할 수 있다.
기타 액티비티
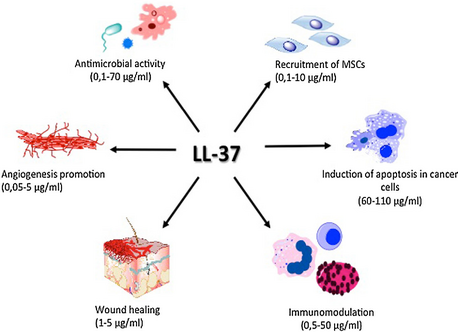
LL-37은 세포 증식과 이동의 활성화에 있어 창상 폐쇄 [12]과정에 기여한다.이 모든 메커니즘은 조직의 항상성과 재생 과정에서 필수적인 역할을 합니다.또한 포밀펩타이드 수용체 like-1(FPRL-1),[13] 퓨린성 수용체 P2X7, 표피성장인자 수용체(EGFR)[14] 또는 인슐린양성장인자-1 수용체(IGF-1R)[15] 등 다양한 다방성 수용체에 작용작용작용작용을 한다.이 수용체들은 무엇보다도 항종양 면역 반응에서 중요한 면역 조절 역할을 한다.
또한 혈관신생을 유도하고[16] 아포토시스를 [17]조절한다.이러한 과정은 종양 발생 동안 조절이 잘 되지 않기 때문에 LL-37은 악성 종양의 병원 형성에 관여할 수 있다.
특성.
카테리시딘의 크기는 12~80개의 아미노산 잔류물이며 광범위한 [18]구조를 가지고 있다.대부분의 카테리시딘은 아미노산 잔기가 23-37개인 선형 펩타이드이며, 양친매틱 α-헬리체로 접힌다.또한 카테리시딘은 하나 또는 두 개의 디술피드 결합에 의해 안정화되는 베타 헤어핀 구조를 가진 작은 크기의 분자(잔기 12-18개)일 수도 있다.더 큰 카테리시딘 펩타이드(39-80 아미노산 잔류물)도 존재한다.이러한 더 큰 카테리시딘은 확장된 폴리프롤린 유형 [4]구조를 형성하는 반복적인 프롤린 모티브를 표시합니다.
1995년, Gudmundsson 외 연구진은 활성 항균 펩타이드가 39-잔류 C-말단 도메인(FALL-39)으로 구성된다고 가정했다.하지만, 불과 1년 후에 현재 LL-37이라고 불리는 성숙 AMP가 실제로는 [19][20]FALL-39보다 두 개의 아미노산이 짧다고 말했다.
카테리시딘 계열은 시스테인 단백질 분해효소 억제제의 시스타틴[21] 계열과 1차 배열 상동성을 공유하지만, 그러한 단백질 분해효소 억제에서 중요한 것으로 생각되는 아미노산 잔류물은 일반적으로 부족하다.
비인간 맞춤법
카테리시딘 펩타이드는 사람, 원숭이, 쥐, 토끼, 기니피그, 팬더, 돼지, 소, 개구리, 양, 염소, 닭, 그리고 말에서 발견되었다.약 30개의 카테리시딘 계열이 포유류에서 설명되었다.
현재 확인된 카테리시딘 펩타이드는 [4]다음을 포함한다.
- 인간: hCAP-18(LL-37로 분할)
- Rhesus 원숭이: RL-37
- 마우스 : CRAMP-1/2 (카텔리시딘 관련 항균펩타이드[22])
- 쥐: rCRAMP
- 토끼: CAP-18
- 기니피그: CAP-11
- 돼지: PR-39, 프로페닌, PMAP-23,36,37
- 소: BMAP-27,28,34(소골수항균펩타이드), Bac5, Bac7
- 개구리: 카테리시딘-AL(Amolops [23]loloensis에서 발견됨)
- 닭:4개의 카테리시딘, fowlicidin 1, 2, 3 및 카테리시딘 베타-1
- 태즈메이니아 데빌: 사하-CATH5
- Salmonid: CATH1 및 CATH2
임상적 의의
로자세아 환자는 카테리시딘 수치가 높아지고 각질 트립틱 효소(SCTE) 지층이 증가한다.카테리시딘은 칼리크레인5 및 칼리크레인7세린단백질가수분해효소 양쪽에 의해 항균펩타이드 LL-37로 분해된다.LL-37의 과잉생산은 로자시아의 [26]모든 아형에서 기여하는 원인으로 의심된다.항생제는 과거에 장미병을 치료하기 위해 사용되었지만 항생제는 일부 SCTE를 [27]억제하기 때문에 효과가 있을 수 있다.
인간 카테리시딘 항균 단백질(hCAP18)의 혈장 수치가 낮으면 투석 [28]환자의 감염으로 인한 사망 위험이 크게 높아지는 것으로 보인다.카테리시딘의 생산은 비타민 [29][30]D에 의해 상향 조절된다.
SAAP-148(합성 항균 및 항이오필름 펩타이드)은 LL-37에 비해 항균 활성을 강화한 LL-37의 변형 버전이다.특히, SAAP-148은 생리적인 [31]조건하에서 박테리아를 죽이는 데 더 효과적이었다.
LL-37은 (다른 항균성 펩타이드와 함께) 건선 병인에 역할을 하는 것으로 생각된다.건선에서 손상된 각질세포는 LL-37을 방출하며, LL-37은 다른 세포로부터의 자기유전물질(DNA 또는 RNA)과 복합체를 형성한다.이러한 복합체는 수지상 세포(항원 제시 세포의 일종)를 자극하여 T세포의 분화와 지속적인 [32]염증에 기여하는 간섭체 α와 β를 방출한다.LL-37은 건선의 일반적인 자가 항원으로 밝혀졌다. LL-37에 특화된 T세포는 중간 정도에서 심각한 [32]건선을 가진 환자의 3분의 2에서 혈액과 피부에서 발견되었다.
LL-37은 알츠하이머병과 관련된 펩타이드 Ab에 결합한다.LL-37과 Ab의 불균형은 AD 관련 섬유 및 플라크에 영향을 미치는 인자일 수 있다.만성 구강 P. 치은염과 헤르페스 바이러스(HSV-1) 감염은 알츠하이머 치매 [33][34]진행에 기여할 수 있다.
적용들
AMP 제품군에 대한 연구(특히 그들의 행동 메커니즘에 관한 연구)는 거의 20년 동안 진행되어 왔습니다.지속적인 관심에도 불구하고, AMP를 유도하거나 이용하는 치료법은 여러 [35]가지 이유로 임상 용도로 널리 채택되지 않았다.첫째, 펩타이드는 단백질 분해 효소에 의해 빠르게 분해되기 때문에 AMP의 약물 후보는 생물학적 가용성의 창이 좁다.둘째, 펩타이드 약은 소분자 약품보다 생산 비용이 비싸며, 이는 펩타이드 약이 빠른 효소 분해에 대항하기 위해 대량으로 투여되어야 하기 때문에 문제가 있다.또한 이러한 품질은 일반적으로 주사, 주입 또는 느린 [36]방출 치료로 투여 경로를 제한합니다.
「 」를 참조해 주세요.
레퍼런스
- ^ "Entrez Gene: CAMP cathelicidin antimicrobial peptide".
- ^ UniProt 엔트리 : P49913 2019년 11월 29일 취득
- ^ Dürr U, Sudheendra U, Ramamoorthy, A (September 2006). "LL-37, the only human member of the cathelicidin family of antimicrobial peptides". Biochimica et Biophysica Acta (BBA) - Biomembranes. 1758 (9): 1408–1425. doi:10.1016/j.bbamem.2006.03.030. PMID 16716248.
- ^ a b c d e Zanetti M (January 2004). "Cathelicidins, multifunctional peptides of the innate immunity". Journal of Leukocyte Biology. 75 (1): 39–48. doi:10.1189/jlb.0403147. PMID 12960280. S2CID 14902156.
- ^ Vandamme D, Landuyt B, Luyten W, Schoofs L (November 2012). "A comprehensive summary of LL-37, the factotum human cathelicidin peptide". Cellular Immunology. 280 (1): 22–35. doi:10.1016/j.cellimm.2012.11.009. PMID 23246832.
- ^ Liu PT, Stenger S, Li H, Wenzel L, Tan BH, Krutzik SR, et al. (March 2006). "Toll-like receptor triggering of a vitamin D-mediated human antimicrobial response". Science. 311 (5768): 1770–3. Bibcode:2006Sci...311.1770L. doi:10.1126/science.1123933. PMID 16497887. S2CID 52869005.
- ^ Bals R, Wang X, Zasloff M, Wilson JM (August 1998). "The peptide antibiotic LL-37/hCAP-18 is expressed in epithelia of the human lung where it has broad antimicrobial activity at the airway surface". Proceedings of the National Academy of Sciences of the United States of America. 95 (16): 9541–6. Bibcode:1998PNAS...95.9541B. doi:10.1073/pnas.95.16.9541. PMC 21374. PMID 9689116.
- ^ Zanetti M, Gennaro R, Romeo D (October 1995). "Cathelicidins: a novel protein family with a common proregion and a variable C-terminal antimicrobial domain". FEBS Letters. 374 (1): 1–5. doi:10.1016/0014-5793(95)01050-o. PMID 7589491. S2CID 34865828.
- ^ Ritonja A, Kopitar M, Jerala R, Turk V (September 1989). "Primary structure of a new cysteine proteinase inhibitor from pig leucocytes". FEBS Letters. 255 (2): 211–4. doi:10.1016/0014-5793(89)81093-2. PMID 2792375.
- ^ Kościuczuk EM, Lisowski P, Jarczak J, Strzałkowska N, Jóźwik A, Horbańczuk J, et al. (December 2012). "Cathelicidins: family of antimicrobial peptides. A review". Molecular Biology Reports. 39 (12): 10957–70. doi:10.1007/s11033-012-1997-x. PMC 3487008. PMID 23065264.
- ^ Dosler S, Karaaslan E (December 2014). "Inhibition and destruction of Pseudomonas aeruginosa biofilms by antibiotics and antimicrobial peptides". Peptides. 62: 32–7. doi:10.1016/j.peptides.2014.09.021. PMID 25285879. S2CID 207359996.
- ^ Shaykhiev R, Beisswenger C, Kändler K, Senske J, Püchner A, Damm T, et al. (November 2005). "Human endogenous antibiotic LL-37 stimulates airway epithelial cell proliferation and wound closure". American Journal of Physiology. Lung Cellular and Molecular Physiology. 289 (5): L842-8. doi:10.1152/ajplung.00286.2004. PMID 15964896.
- ^ Chen Q, Schmidt AP, Anderson GM, Wang JM, Wooters J, Oppenheim JJ, Chertov O (October 2000). "LL-37, the neutrophil granule- and epithelial cell-derived cathelicidin, utilizes formyl peptide receptor-like 1 (FPRL1) as a receptor to chemoattract human peripheral blood neutrophils, monocytes, and T cells". The Journal of Experimental Medicine. 192 (7): 1069–74. doi:10.1084/jem.192.7.1069. PMC 2193321. PMID 11015447.
- ^ von Haussen J, Koczulla R, Shaykhiev R, Herr C, Pinkenburg O, Reimer D, et al. (January 2008). "The host defence peptide LL-37/hCAP-18 is a growth factor for lung cancer cells". Lung Cancer. 59 (1): 12–23. doi:10.1016/j.lungcan.2007.07.014. PMID 17764778.
- ^ Girnita A, Zheng H, Grönberg A, Girnita L, Ståhle M (January 2012). "Identification of the cathelicidin peptide LL-37 as agonist for the type I insulin-like growth factor receptor". Oncogene. 31 (3): 352–65. doi:10.1038/onc.2011.239. PMC 3262900. PMID 21685939.
- ^ Koczulla R, von Degenfeld G, Kupatt C, Krötz F, Zahler S, Gloe T, et al. (June 2003). "An angiogenic role for the human peptide antibiotic LL-37/hCAP-18". The Journal of Clinical Investigation. 111 (11): 1665–72. doi:10.1172/JCI17545. PMC 156109. PMID 12782669.
- ^ Ren SX, Shen J, Cheng AS, Lu L, Chan RL, Li ZJ, et al. (2013-05-20). Nie D (ed.). "FK-16 derived from the anticancer peptide LL-37 induces caspase-independent apoptosis and autophagic cell death in colon cancer cells". PLOS ONE. 8 (5): e63641. Bibcode:2013PLoSO...863641R. doi:10.1371/journal.pone.0063641. PMC 3659029. PMID 23700428.
- ^ Gennaro R, Zanetti M (2000). "Structural features and biological activities of the cathelicidin-derived antimicrobial peptides". Biopolymers. 55 (1): 31–49. doi:10.1002/1097-0282(2000)55:1<31::AID-BIP40>3.0.CO;2-9. PMID 10931440.
- ^ Agerberth B, Gunne H, Odeberg J, Kogner P, Boman HG, Gudmundsson GH (January 1995). "FALL-39, a putative human peptide antibiotic, is cysteine-free and expressed in bone marrow and testis". Proceedings of the National Academy of Sciences of the United States of America. 92 (1): 195–9. Bibcode:1995PNAS...92..195A. doi:10.1073/pnas.92.1.195. PMC 42844. PMID 7529412.
- ^ Gudmundsson GH, Agerberth B, Odeberg J, Bergman T, Olsson B, Salcedo R (June 1996). "The human gene FALL39 and processing of the cathelin precursor to the antibacterial peptide LL-37 in granulocytes". European Journal of Biochemistry. 238 (2): 325–32. doi:10.1111/j.1432-1033.1996.0325z.x. PMID 8681941.
- ^ Zaiou M, Nizet V, Gallo RL (May 2003). "Antimicrobial and protease inhibitory functions of the human cathelicidin (hCAP18/LL-37) prosequence". The Journal of Investigative Dermatology. 120 (5): 810–6. doi:10.1046/j.1523-1747.2003.12132.x. PMID 12713586.
- ^ Gallo RL, Kim KJ, Bernfield M, Kozak CA, Zanetti M, Merluzzi L, Gennaro R (May 1997). "Identification of CRAMP, a cathelin-related antimicrobial peptide expressed in the embryonic and adult mouse". The Journal of Biological Chemistry. 272 (20): 13088–93. doi:10.1074/jbc.272.20.13088. PMID 9148921.
- ^ Hao X, Yang H, Wei L, Yang S, Zhu W, Ma D, Yu H, Lai R (August 2012). "Amphibian cathelicidin fills the evolutionary gap of cathelicidin in vertebrate". Amino Acids. 43 (2): 677–85. doi:10.1007/s00726-011-1116-7. PMID 22009138. S2CID 2794908.
- ^ Achanta M, Sunkara LT, Dai G, Bommineni YR, Jiang W, Zhang G (May 2012). "Tissue expression and developmental regulation of chicken cathelicidin antimicrobial peptides". Journal of Animal Science and Biotechnology. 3 (1): 15. doi:10.1186/2049-1891-3-15. PMC 3436658. PMID 22958518.
- ^ Peel E, Cheng Y, Djordjevic JT, Fox S, Sorrell TC, Belov K (October 2016). "Cathelicidins in the Tasmanian devil (Sarcophilus harrisii)". Scientific Reports. 6: 35019. Bibcode:2016NatSR...635019P. doi:10.1038/srep35019. PMC 5057115. PMID 27725697.
- ^ Reinholz M, Ruzicka T, Schauber J (May 2012). "Cathelicidin LL-37: an antimicrobial peptide with a role in inflammatory skin disease". Annals of Dermatology. 24 (2): 126–35. doi:10.5021/ad.2012.24.2.126. PMC 3346901. PMID 22577261.
- ^ Yamasaki K, Di Nardo A, Bardan A, Murakami M, Ohtake T, Coda A, Dorschner RA, Bonnart C, Descargues P, Hovnanian A, Morhenn VB, Gallo RL (August 2007). "Increased serine protease activity and cathelicidin promotes skin inflammation in rosacea". Nature Medicine. 13 (8): 975–80. doi:10.1038/nm1616. PMID 17676051. S2CID 23470611.
- ^ Gombart AF, Bhan I, Borregaard N, Tamez H, Camargo CA, Koeffler HP, Thadhani R (February 2009). "Low plasma level of cathelicidin antimicrobial peptide (hCAP18) predicts increased infectious disease mortality in patients undergoing hemodialysis". Clinical Infectious Diseases. 48 (4): 418–24. doi:10.1086/596314. PMC 6944311. PMID 19133797.
- ^ Zasloff M (January 2002). "Antimicrobial peptides of multicellular organisms". Nature. 415 (6870): 389–95. Bibcode:2002Natur.415..389Z. doi:10.1038/415389a. PMID 11807545. S2CID 205028607.
- ^ Kamen DL, Tangpricha V (May 2010). "Vitamin D and molecular actions on the immune system: modulation of innate and autoimmunity". Journal of Molecular Medicine. 88 (5): 441–50. doi:10.1007/s00109-010-0590-9. PMC 2861286. PMID 20119827.
- ^ de Breij A, Riool M, Cordfunke RA, Malanovic N, de Boer L, Koning RI, et al. (January 2018). "The antimicrobial peptide SAAP-148 combats drug-resistant bacteria and biofilms". Science Translational Medicine. 10 (423): eaan4044. doi:10.1126/scitranslmed.aan4044. PMID 29321257.
- ^ a b Rendon A, Schäkel K (March 2019). "Psoriasis Pathogenesis and Treatment". International Journal of Molecular Sciences. 20 (6): 1475. doi:10.3390/ijms20061475. PMC 6471628. PMID 30909615.
- ^ Kanagasingam S, Chukkapalli SS, Welbury R, Singhrao SK (December 2020). "Porphyromonas gingivalis is a Strong Risk Factor for Alzheimer's Disease". Journal of Alzheimer's Disease Reports. 4 (1): 501–511. doi:10.3233/ADR-200250. PMC 7835991. PMID 33532698.
- ^ Rizzo R (June 2020). Spindler KR (ed.). "Controversial role of herpesviruses in Alzheimer's disease". PLoS Pathogens. 16 (6): e1008575. doi:10.1371/journal.ppat.1008575. PMC 7302436. PMID 32555685.
- ^ "Biomimetics Research from the Barron Lab". web.stanford.edu. Retrieved 2021-10-22.
- ^ DePalma A (2015-06-30). "Peptides: New Processes, Lower Costs". GEN - Genetic Engineering and Biotechnology News. Retrieved 2021-11-30.
추가 정보
- Dürr UH, Sudheendra US, Ramamoorthy A (September 2006). "LL-37, the only human member of the cathelicidin family of antimicrobial peptides". Biochimica et Biophysica Acta (BBA) - Biomembranes. 1758 (9): 1408–25. doi:10.1016/j.bbamem.2006.03.030. PMID 16716248.
- Chromek M, Slamová Z, Bergman P, Kovács L, Podracká L, Ehrén I, Hökfelt T, Gudmundsson GH, Gallo RL, Agerberth B, Brauner A (June 2006). "The antimicrobial peptide cathelicidin protects the urinary tract against invasive bacterial infection". Nature Medicine. 12 (6): 636–41. doi:10.1038/nm1407. PMID 16751768. S2CID 20704807.
- Gombart AF, Borregaard N, Koeffler HP (July 2005). "Human cathelicidin antimicrobial peptide (CAMP) gene is a direct target of the vitamin D receptor and is strongly up-regulated in myeloid cells by 1,25-dihydroxyvitamin D3". FASEB Journal. 19 (9): 1067–77. doi:10.1096/fj.04-3284com. PMID 15985530. S2CID 7563259.
- López-García B, Lee PH, Gallo RL (May 2006). "Expression and potential function of cathelicidin antimicrobial peptides in dermatophytosis and tinea versicolor". The Journal of Antimicrobial Chemotherapy. 57 (5): 877–82. doi:10.1093/jac/dkl078. PMID 16556635.
- Lehrer RI, Ganz T (January 2002). "Cathelicidins: a family of endogenous antimicrobial peptides". Current Opinion in Hematology. 9 (1): 18–22. doi:10.1097/00062752-200201000-00004. PMID 11753073. S2CID 23575052.
- Niyonsaba F, Hirata M, Ogawa H, Nagaoka I (September 2003). "Epithelial cell-derived antibacterial peptides human beta-defensins and cathelicidin: multifunctional activities on mast cells". Current Drug Targets. Inflammation and Allergy. 2 (3): 224–31. doi:10.2174/1568010033484115. PMID 14561157.
- van Wetering S, Tjabringa GS, Hiemstra PS (April 2005). "Interactions between neutrophil-derived antimicrobial peptides and airway epithelial cells". Journal of Leukocyte Biology. 77 (4): 444–50. doi:10.1189/jlb.0604367. PMID 15591123. S2CID 8261526.
- Cowland JB, Johnsen AH, Borregaard N (July 1995). "hCAP-18, a cathelin/pro-bactenecin-like protein of human neutrophil specific granules". FEBS Letters. 368 (1): 173–6. doi:10.1016/0014-5793(95)00634-L. PMID 7615076. S2CID 3172761.
- Gudmundsson GH, Magnusson KP, Chowdhary BP, Johansson M, Andersson L, Boman HG (July 1995). "Structure of the gene for porcine peptide antibiotic PR-39, a cathelin gene family member: comparative mapping of the locus for the human peptide antibiotic FALL-39". Proceedings of the National Academy of Sciences of the United States of America. 92 (15): 7085–9. Bibcode:1995PNAS...92.7085G. doi:10.1073/pnas.92.15.7085. PMC 41476. PMID 7624374.
- Larrick JW, Hirata M, Balint RF, Lee J, Zhong J, Wright SC (April 1995). "Human CAP18: a novel antimicrobial lipopolysaccharide-binding protein". Infection and Immunity. 63 (4): 1291–7. doi:10.1128/IAI.63.4.1291-1297.1995. PMC 173149. PMID 7890387.
- Larrick JW, Lee J, Ma S, Li X, Francke U, Wright SC, Balint RF (November 1996). "Structural, functional analysis and localization of the human CAP18 gene". FEBS Letters. 398 (1): 74–80. doi:10.1016/S0014-5793(96)01199-4. PMID 8946956. S2CID 35329283.
- Frohm M, Agerberth B, Ahangari G, Stâhle-Bäckdahl M, Lidén S, Wigzell H, Gudmundsson GH (June 1997). "The expression of the gene coding for the antibacterial peptide LL-37 is induced in human keratinocytes during inflammatory disorders". The Journal of Biological Chemistry. 272 (24): 15258–63. doi:10.1074/jbc.272.24.15258. PMID 9182550.
- Bals R, Wang X, Zasloff M, Wilson JM (August 1998). "The peptide antibiotic LL-37/hCAP-18 is expressed in epithelia of the human lung where it has broad antimicrobial activity at the airway surface". Proceedings of the National Academy of Sciences of the United States of America. 95 (16): 9541–6. Bibcode:1998PNAS...95.9541B. doi:10.1073/pnas.95.16.9541. PMC 21374. PMID 9689116.
- Chen Q, Schmidt AP, Anderson GM, Wang JM, Wooters J, Oppenheim JJ, Chertov O (October 2000). "LL-37, the neutrophil granule- and epithelial cell-derived cathelicidin, utilizes formyl peptide receptor-like 1 (FPRL1) as a receptor to chemoattract human peripheral blood neutrophils, monocytes, and T cells". The Journal of Experimental Medicine. 192 (7): 1069–74. doi:10.1084/jem.192.7.1069. PMC 2193321. PMID 11015447.
- Agerberth B, Charo J, Werr J, Olsson B, Idali F, Lindbom L, Kiessling R, Jörnvall H, Wigzell H, Gudmundsson GH (November 2000). "The human antimicrobial and chemotactic peptides LL-37 and alpha-defensins are expressed by specific lymphocyte and monocyte populations". Blood. 96 (9): 3086–93. doi:10.1182/blood.V96.9.3086. PMID 11049988.
- Bals R, Lang C, Weiner DJ, Vogelmeier C, Welsch U, Wilson JM (March 2001). "Rhesus monkey (Macaca mulatta) mucosal antimicrobial peptides are close homologues of human molecules". Clinical and Diagnostic Laboratory Immunology. 8 (2): 370–5. doi:10.1128/CDLI.8.2.370-375.2001. PMC 96065. PMID 11238224.
- Nagaoka I, Hirota S, Niyonsaba F, Hirata M, Adachi Y, Tamura H, Heumann D (September 2001). "Cathelicidin family of antibacterial peptides CAP18 and CAP11 inhibit the expression of TNF-alpha by blocking the binding of LPS to CD14(+) cells". Journal of Immunology. 167 (6): 3329–38. doi:10.4049/jimmunol.167.6.3329. PMID 11544322.
- Hase K, Eckmann L, Leopard JD, Varki N, Kagnoff MF (February 2002). "Cell differentiation is a key determinant of cathelicidin LL-37/human cationic antimicrobial protein 18 expression by human colon epithelium". Infection and Immunity. 70 (2): 953–63. doi:10.1128/IAI.70.2.953-963.2002. PMC 127717. PMID 11796631.
- Giuliani A, Pirri G, Nicoletto S (2007). "Antimicrobial peptides: an overview of a promising class of therapeutics". Cent. Eur. J. Biol. 2 (1): 1–33. doi:10.2478/s11535-007-0010-5.
- Burton MF, Steel PG (December 2009). "The chemistry and biology of LL-37". Natural Product Reports. 26 (12): 1572–84. doi:10.1039/b912533g. PMID 19936387.