이사틴
Isatin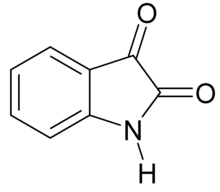 | |
 | |
| 이름 | |
|---|---|
| 선호 IUPAC 이름 1H-Indole-2,3-dione | |
| 식별자 | |
3D 모델(JSmol) | |
| 383659 | |
| 체비 | |
| 켐벨 | |
| 켐스파이더 | |
| 드러그뱅크 | |
| ECHA InfoCard | 100.001.889 |
| EC 번호 |
|
| 165206 | |
| 케그 | |
펍켐 CID | |
| 유니 | |
CompTox 대시보드 (EPA) | |
| |
| |
| 특성. | |
| C8H5NO2 | |
| 어금질량 | 147.1308 g/190 |
| 외관 | 주황붉은솔리드 |
| 녹는점 | 200 °C(392 °F, 473 K) |
| 위험 | |
| GHS 라벨 표시: | |
 | |
| 경고 | |
| H302, H315, H319, H335 | |
| P261, P264, P270, P271, P280, P301+P312, P302+P352, P304+P340, P305+P351+P338, P312, P321, P330, P332+P313, P337+P313, P362, P403+P233, P405, P501 | |
달리 명시된 경우를 제외하고, 표준 상태(25°C [77°F], 100 kPa)의 재료에 대한 데이터가 제공된다. | |
| Infobox 참조 자료 | |
트리불린이라고도 알려진 이사틴은 CHNO라는852 공식으로 세뇌에서 파생된 유기 화합물이다. 이 화합물은 1840년 오토 린네 에르드만과[1] 오귀스트 로랑에[2] 의해 질산과 크롬산에 의한 인디고 염료의 산화로부터 얻은 제품이다.
이사틴은 아드레날린의 대사 유도체로서 이사티스속,[3][4] 쿠루피타기아넨시스속 식물에서 발견될 수 있는 잘 알려진 천연물이다.[5]
붉은 오렌지 가루처럼 생겼으며, 항균제,[6][7] 항균제, 항HIV,[8] 항균제 등 다양한 생물학적 활성 화합물의 합성을 위한 건물 블록으로 주로 사용된다.[9]
이스타틴 코어는 '마야 블루'와 '마야 옐로' 염료 색도 담당한다.[10]
합성
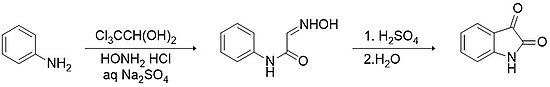
샌드마이어 방법론
샌드마이어 방법론은 이스타틴의 합성을 위한 가장 오래되고 간단한 방법이다.[11] 이 방법은 히드록시아민 염산수화물(예: 아닐린)이 있는 클로로알 하이드레이드와 일차 아릴아민(아닐린) 사이의 응축으로 황산나트륨을 수용하여 α-이소니트로소아세트아닐리드를 형성하는 것을 포함한다. 강산(예: 황산)에 의해 촉진되는 이 중간 및 후속 전기영동 사이클화의 격리는 이염화 함량이 75% 이하가 된다.
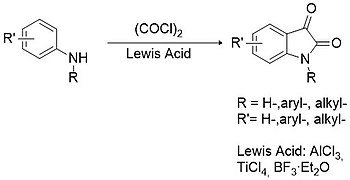
스톨레 방법론
스톨레 절차는 대체 및 미인증 이사틴의 합성을 위한 샌드마이어 방법론의 최선의 대안으로 간주된다.[12] 이 경우 일차 또는 이차 아릴아민은 옥살릴 염화물과 응축되어 클로로옥살릴릴릴산 중간을 형성하며, 이 중량은 루이스산(예: 알루미늄 트리클로라이드, 티타늄 테트라클로라이드, 붕소삼불화화화합물 등)의 존재에서 사이클링할 수 있다.
기타 절차
N 대체 이사틴의 합성에 대한 보다 최근의 접근방식은 TBHP,[13] IBX-SO3K,[14] tBuOON[15] 등과 같은 서로 다른 산화제로 시중에서 구할 수 있는 대체 인돌 또는 옥신돌의 직접 산화를 포함한다.
반응도
방향족인 케톤과 γ-락탐의 모이티인 방향족의 존재는 Isatin에게 전기영양체와 핵영양체로 사용될 수 있는 희귀한 잠재력을 준다. 실제로, 그것은 페닐 링의 C-5와 C-7 위치에서 핵영양성 첨가와 같은 엄청난 수의 반응을 겪는다. 카보닐 그룹, 화학적 감소, 산화, 링-염색 및 스피로-고정 이 독특한 반응성 때문에, 이사틴은 유기 합성에서 가장 가치 있는 구성 요소 중 하나로 여겨진다.
엔제피탈
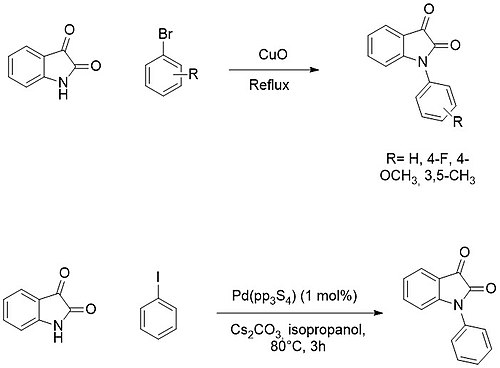
Isatin core의 N-기능화는 해당 나트륨 또는 칼륨 소금을 형성하고 이후 전기영양체(예: 알킬 또는 아킬 할리드)를 첨가함으로써 쉽게 얻을 수 있다.
반면 N-아릴레이션은 보통 구리 알 팔라듐 촉매를 사용하여 아릴 할리드와의 교차 결합 반응을 통해 이루어진다.[16][17]
링 팽창
유기합성 분야에서는 링 팽창이 '클래식' 방식으로 합성하기 어려운 중간 크기 링(7~9원자)을 획득할 수 있어 소중한 반응으로 꼽힌다.[18]
현재까지 이스타틴 파생상품의 링 확장에 관한 기사는 거의 보고되지 않았다. 첫 번째 것은 약화학에서 중요한 비석인 이소타진, 아미노우라실, 이소사졸론이 포함된 산성 1배트의 다원체 반응이다.[19]
또 다른 1배트 멀티콤포멘터 반응에서는 이스타틴을 인덴-1,3디오네와 N 대체 피리디늄 브로미이드와 반응시켜 디벤조[b,d]아제핀-6-one을 형성함으로써 독특한 2탄소 팽창이 이루어졌다.[20]
C-2/C-3 핵포도 첨가
Isatin은 C-2와 C-3 위치의 카보닐에 핵포화물을 첨가한다. 공정의 섭열성은 기질(이산염 코어에 대한 대체물질의 특성, 특히 질소 원자에 결합된 대체물질의 특성)과 반응 조건(솔루벤트, 온도 등) 모두에 강하게 의존한다. 어떤 경우에는 핵포화 부재가 이차 반응(예: 사이클링, 링 팽창, 링 개방 등)을 따를 수 있다.

산화
과산화수소나 무수화물 크롬을 이용한 이스타틴의 산화는 이산화 무수화물인데,[22][23] 이 화합물은 제초제 제품이나 약용 화학에서 널리 사용된다.
조광화
메탄올에서 KBH로4 이스타틴을 희석하면 인디루빈이 발생한다.[24] 이것은 인디고 색소의 적색 성분과 매우 효과적인 세포독성 화합물을 나타낸다.
축소
비아미드 카보닐 그룹의 감소는 분명히 각각 옥신돌을 주기 위해 발생한다.
참고 항목
참조
- ^ Erdmann, Otto Linné (1840). "Untersuchungen über den Indigo". Journal für Praktische Chemie. 19 (1): 321–362. doi:10.1002/prac.18400190161.
- ^ Laurent, Auguste (1840). "Recherches sur l'indigo". Annales de Chimie et de Physique. 3 (3): 393–434.
- ^ Pinto, A. C. (2001). "The chemistry of isatins: a review from 1975 to 1999". J. Braz. Chem. Soc. 12 (3): 273. doi:10.1590/S0103-50532001000300002.
- ^ Bergman, J. (1988). "The structure and properties of some indolic constituents in Couroupita guianensis aubl". Tetrahedron. 41 (14): 2879. doi:10.1016/S0040-4020(01)96609-8.
- ^ Chiyanzu, I. (2003). "Synthesis and evaluation of isatins and thiosemicarbazone derivatives against cruzain, falcipain-2 and rhodesain". Bioorg. Med. Chem. Lett. 13 (20): 3527–30. doi:10.1016/S0960-894X(03)00756-X. PMID 14505663.
- ^ Mallamo, J.P. (2006). "Structure-guided identification of novel VEGFR-2 kinase inhibitors via solution phase parallel synthesis". Bioorg. Med. Chem. Lett. 16 (8): 2158–62. doi:10.1016/j.bmcl.2006.01.063. PMID 16460933.
- ^ He, Y. (2006). "Design, synthesis, and biological evaluations of novel oxindoles as HIV-1 non-nucleoside reverse transcriptase inhibitors". Bioorg. Med. Chem. Lett. 16 (8): 2109–12. doi:10.1016/j.bmcl.2006.01.066. PMID 16464578.
- ^ Sriram, D. (2005). "Synthesis and evaluation of anti-HIV activity of isatin beta-thiosemicarbazone derivatives". Bioorg. Med. Chem. Lett. 15 (20): 4451–5. doi:10.1016/j.bmcl.2005.07.046. PMID 16115762.
- ^ Bin-Jubair, F.A.S. (2010). "Anti-Tubercular activity of Isatin and Derivatives". Int. J. Res. Pharm. Sci. 1: 113.
- ^ Vuzquez de Agredos-Pascual, M.L. (2011). "From Maya Blue to "Maya Yellow": A Connection between Ancient Nanostructured Materials from the Voltammetry of Microparticles". Angew. Chem. Int. Ed. 50 (25): 5741–4. doi:10.1002/anie.201100921. PMID 21557419.
- ^ Sandmeyer, T. (1919). "Über Isonitrosoacetanilide und deren Kondensation zu Isatinen". Helv. Chim. Acta. 2: 234. doi:10.1002/hlca.19190020125.
- ^ Stollé, R. (1922). "Über N-substituierte Oxindole und Isatine". J. Prakt. Chem. (In German). 105 (1): 137–148. doi:10.1002/prac.19221050111.
- ^ Ji, S.J. (2014). "I2/TBHP-Catalyzed Chemoselective Amination of Indoles". Org. Lett. 16: 3094–3097.
- ^ Kirsch, S.F. (2015). "Synthesis of Isatins through Direct Oxidation of Indoles with IBX-SO3K/NaI". Synthesis. 47 (13): 1937–1943. doi:10.1055/s-0034-1380517.
- ^ Wei, W.T. (2018). "Synthesis of Indoline-2,3-diones by Radical Coupling of Indolin-2-ones with tert-Butyl Hydroperoxide". Synlett. 29 (2): 215–218. doi:10.1055/s-0036-1589106.
- ^ Coppola, Gary M. (September 1987). "Arylation of isatins. A direct route to -arylisatoic anhydrides". Journal of Heterocyclic Chemistry. 24 (5): 1249–1251. doi:10.1002/jhet.5570240503.
- ^ Majumder, Arpi; Gupta, Ragini; Mandal, Mrinmay; Babu, Madhu; Chakraborty, Debashis (April 2015). "Air-stable palladium(0) phosphine sulfide catalysts for Ullmann-type C–N and C–O coupling reactions". Journal of Organometallic Chemistry. 781: 23–34. doi:10.1016/j.jorganchem.2014.11.018.
- ^ Donald, James R.; Unsworth, William P. (3 July 2017). "Ring-Expansion Reactions in the Synthesis of Macrocycles and Medium-Sized Rings". Chemistry - A European Journal. 23 (37): 8780–8799. doi:10.1002/chem.201700467. PMID 28295709.
- ^ Poomathi, Nataraj; Mayakrishnan, Sivakalai; Muralidharan, Doraiswamy; Srinivasan, Rajagopal; Perumal, Paramasivan T. (2015). "Reaction of isatins with 6-amino uracils and isoxazoles: isatin ring-opening vs. annulations and regioselective synthesis of isoxazole fused quinoline scaffolds in water". Green Chemistry. 17 (6): 3362–3372. doi:10.1039/c5gc00006h.
- ^ Shi, Rong-Guo; Wang, Xiao-Hua; Liu, Ruzhang; Yan, Chao-Guo (2016). "Two-carbon ring expansion of isatin: a convenient construction of a dibenzo[b,d]azepinone scaffold". Chemical Communications. 52 (37): 6280–6283. doi:10.1039/c6cc00525j. PMID 27079548. S2CID 36547699.
- ^ Bergman, Jan; Stålhandske, Claes; Vallberg, Hans (1997). "Studies of the Reaction between Indole-2,3-diones (Isatins) and Secondary Aliphatic Amines" (PDF). Acta Chemica Scandinavica. 51: 753–759. doi:10.3891/acta.chem.scand.51-0753.
- ^ Yang, Shuangshuang; Li, Xishuai; Hu, Fangfang; Li, Yinlong; Yang, Yunyun; Yan, Junkai; Kuang, Chunxiang; Yang, Qing (25 October 2013). "Discovery of Tryptanthrin Derivatives as Potent Inhibitors of Indoleamine 2,3-Dioxygenase with Therapeutic Activity in Lewis Lung Cancer (LLC) Tumor-Bearing Mice". Journal of Medicinal Chemistry. 56 (21): 8321–8331. doi:10.1021/jm401195n. PMID 24099220.
- ^ Bao, Yajie; Yan, Yizhe; Xu, Kun; Su, Jihu; Zha, Zhenggen; Wang, Zhiyong (20 April 2015). "Copper-Catalyzed Radical Methylation/C–H Amination/Oxidation Cascade for the Synthesis of Quinazolinones". The Journal of Organic Chemistry. 80 (9): 4736–4742. doi:10.1021/acs.joc.5b00191. PMID 25849218.
- ^ Wang, Cuiling; Yan, Jiaxu; Du, Mo; Burlison, Joseph A.; Li, Chi; Sun, Yanni; Zhao, Danqing; Liu, Jianli (May 2017). "One step synthesis of indirubins by reductive coupling of isatins with KBH 4". Tetrahedron. 73 (19): 2780–2785. doi:10.1016/j.tet.2017.03.077.
리뷰
- Popp, Prank D. (1975). "The Chemistry of Isatin". Advances in Heterocyclic Chemistry Volume 18. Advances in Heterocyclic Chemistry. 18. pp. 1–58. doi:10.1016/S0065-2725(08)60127-0. ISBN 9780120206186.
- Silva, Joaquim F. M. da; Garden, Simon J.; Pinto, Angelo C. (June 2001). "The chemistry of isatins: a review from 1975 to 1999". Journal of the Brazilian Chemical Society. 12 (3): 273–324. doi:10.1590/S0103-50532001000300002.
- Mesropyan, E. G.; Avetisyan, A. A. (2009). "New isatin derivatives". Russian Journal of Organic Chemistry. 45 (11): 1583. doi:10.1134/S1070428009110013. S2CID 97341279.
- Varun, Varun; Sonam, Sonam; Kakkar, Rita (2019). "Isatin and its derivatives: a survey of recent syntheses, reactions, and applications". MedChemComm. 10 (3): 351–368. doi:10.1039/C8MD00585K. PMC 6438150. PMID 30996856.
외부 링크
- . Encyclopædia Britannica. 14 (11th ed.). 1911. pp. 865–866.