노화의 특징
Hallmarks of aging노화의 특징은 생물학적 노화를 경험하고 생리학적 무결성의 점진적인 상실, 기능 저하, 그리고 결국 죽음을 초래하는 모든 유기체에서 일어나는 생화학적 변화의 유형이다.그것들은 생물학적 노화의 본질과 그 기본 메커니즘을 개념화하기 위해 2013년에[1] 획기적인 논문에 처음 열거되었다.
개요
시간이 지남에 따라, 거의 모든 생물들은 점진적이고 돌이킬 수 없는 노화의 증가와 신체 시스템의 적절한 기능 상실을 경험합니다.노화는 암, 당뇨병, 심혈관 장애, 신경변성 질환을 포함한 주요 인간 질병의 주요 위험 요소이기 때문에, 노화가 수반하는 변화의 유형을 기술하고 분류하는 것이 중요하다.에이징의 9가지 특징은 다음과 [1]같이 3가지 카테고리로 분류됩니다.
주요 특징(손상의 원인)
길항 마크(손상에 대한 반응)
- 조절되지 않은 영양소 감지
- 미토콘드리아 기능 장애
- 세포의 노화
통합적 특징(표현형 계산기)
1차 표식은 세포 손상의 주요 원인입니다.길항적 표식은 주요 표식의 발현에 대한 길항적 또는 보상적 반응이다.통합적 특징(integrative attacks)은 [1]노화와 관련된 추가적인 운영 열화를 초래하는 이전의 두 가지 특징 그룹의 기능적 결과물이다.
표식
각 상표는 [1]다음 기준을 충족하기 위해 선택되었습니다.
- 정상적인 노화 중에 나타난다.
- 실험적으로 증가시키면 노화가 가속화된다.
- 실험적으로 수정하는 것은 정상적인 노화 과정을 늦추고 건강한 수명을 증가시킨다.
이러한 조건들은 각각의 특징에 의해 다양한 범위에 걸쳐 충족됩니다.마지막 기준은 과학이 아직 살아있는 유기체에서 이러한 문제들을 수정할 수 있는 실행 가능한 방법을 발견하지 못했기 때문에 많은 특징에는 존재하지 않는다.
게놈 불안정성
게놈의 적절한 기능은 세포와 유기체의 원활한 기능을 위한 가장 중요한 전제 조건 중 하나이다.유전자 코드의 변화는 오랫동안 [2]노화의 주요 원인 중 하나로 여겨져 왔다.다세포 유기체의 게놈 불안정성은 [3]발암의 중심이며, 인간의 경우 근위축성 측삭경화증이나 신경근 질환 근위축증과 같은 신경변성 질환의 요인이다.
DNA의 이상 화학구조는 주로 산화스트레스와 환경요인에 [4]의해 형성된다.이 [5]손상을 복구하기 위해 많은 분자 과정이 지속적으로 작용합니다.안타깝게도 결과는 완벽하지 않기 때문에 시간이 [2]지남에 따라 피해가 누적됩니다.몇몇 리뷰 기사들은 부족한 DNA 복구가 DNA 손상의 더 많은 축적을 가능하게 하고, 조기 노화를 야기하고, 증가하는 DNA 복구가 더 많은 [6]수명을 촉진한다는 것을 보여주었다.
텔로미어 단축
텔로미어는 선형 염색체 끝에 있는 특수 단백질과 연관된 반복적인 뉴클레오티드 배열의 영역이다.그들은 염색체 DNA의 말단 영역을 진행성 저하로부터 보호하고 DNA 복구 시스템이 DNA 가닥의 끝을 이중 가닥의 단절로 오인하는 것을 방지함으로써 선형 염색체의 무결성을 보장한다.
텔로미어 단축은 노화, 사망률 및 노화와 관련된 질병과 관련이 있다.정상적인 노화는 인간과 생쥐 모두에서 텔로미어 감소와 관련이 있으며 유전자 변형 동물 모델에 대한 연구는 텔로미어 침식과 [7]노화 사이의 인과 관계를 시사한다.Leonard Hayflick은 정상적인 인간 태아 세포 집단은 노화 단계에 들어가기 전에 세포 배양에서 40배에서 60배까지 분열한다는 것을 증명했다.세포들이 유사분열을 겪을 때마다, 각 염색체의 끝에 있는 텔로미어는 약간 짧아진다.텔로미어가 임계 [8]길이로 짧아지면 세포 분열이 중단됩니다.이것은 (암과 같이) 제어되지 않은 세포 증식을 멈출 필요가 있을 때 유용하지만, 정상적으로 기능하는 세포가 필요할 때 분열할 수 없을 때는 해롭다.
텔로머라아제라고 불리는 효소는 배우자와 배아줄기세포에서 [9]텔로미어를 연장시킨다.인간의 텔로머라아제 결핍은 조직의 [10]재생 능력 상실과 관련된 여러 노화 관련 질병과 관련이 있다.또한 텔로머라아제 결핍 마우스에서는 텔로머라아제가 [11]재활성화되면 조기 노화가 되돌리는 것으로 나타났다.
후생유전학적 변화
게놈을 구성하는 모든 유전자 중에서, 오직 일부만이 항상 발현된다.게놈의 기능은 뉴클레오티드의 특정 순서(유전체 인자)에 따라 달라지며, 또한 DNA 사슬의 어떤 부분이 히스톤에 감겨져 접근 불능이 되는지, 그리고 어떤 부분이 녹지 않고 전사에 이용 가능한지에 따라 달라진다.특정 조직의 종류와 특정 세포가 있는 환경의 필요에 따라 [12]히스톤은 필요에 따라 특정 유전자를 켜거나 끄도록 수정될 수 있다.이러한 수정(후생유전자 프로파일)이 어디서, 언제, 어느 정도까지 일어나는지에 대한 프로파일은 노화에 따라 변화하고 유용한 유전자가 꺼지고 불필요한 유전자가 켜지면서 [13]세포의 정상적인 기능을 방해한다.
예를 들어, 시르투인은 히스톤에 대한 DNA의 결합을 촉진하여 불필요한 유전자를 [14]차단하는 단백질 탈아세틸라아제이다.이 효소들은 NAD를 보조 인자로 사용한다.우리가 나이가 들면서, 세포에서 NAD의 수치는 감소하며, 시르투인의 필요 없는 유전자를 적시에 차단하는 능력도 감소한다.시르투인의 활성을 감소시키는 것은 노화의 가속화와 관련이 있고 그들의 활성을 증가시키는 것은 여러 노화와 관련된 [15]질병을 예방하는 것으로 나타났다.
프로테오스타시스의 상실
프로테오스타시스는 세포의 기능에 필요한 모든 단백질을 적절한 형태, 구조, [16]풍부하게 유지하는 항상성 과정이다.단백질의 잘못된 접힘, 산화, 비정상적인 분열 또는 바람직하지 않은 번역 후 수정은 [17]세포의 정상적인 기능을 방해하는 기능 장애 또는 독성 단백질 또는 단백질 집계를 생성할 수 있습니다.이러한 단백질은 지속적으로 제거되고 재활용되지만, 손상되거나 응집된 단백질의 형성은 나이가 들수록 증가하여 단백질 [18]안정성의 점진적인 손실을 초래한다.이는 mTOR 경로 [20]억제를 통해 열량 제한[19] 또는 라파마이신 투여에 의해 느려지거나 억제될 수 있다.
조절되지 않은 영양소 감지
영양소 감지는 포도당, 지방산, 아미노산과 같은 마크롱 영양소의 농도 변화를 인식하고 반응하는 세포의 능력이다.풍부할 때, 동화작용은 다양한 경로를 통해 유도되며, 그 [21]중 가장 잘 연구된 mTOR 경로이다.에너지와 영양분이 부족할 때 AMPK 수용체는 이를 감지하고 자원을 [22]보존하기 위해 mTOR를 끕니다.
성장하는 유기체에서는 성장과 세포 증식이 중요하기 때문에 mTOR은 상향 조절된다.다 자란 유기체에서는 mTOR 활성화 신호는 [23]노화 중에 자연스럽게 감소한다.성장한 생쥐에서 이러한 경로를 강제로 과활성화하면 노화가 가속화되고 [24]암 발생률이 높아진다는 것이 밝혀졌습니다. 식단 제한이나 라파마이신 투여와 같은 mTOR 억제 방법은 웜, 파리 및 [25][26]생쥐에서 수명을 늘리는 가장 강력한 방법 중 하나인 것으로 나타났습니다.
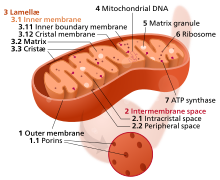
미토콘드리아 기능 장애
미토콘드리아는 세포의 원동력이다.다른 인간 세포들은 20에서 30에서 수천 개의 미토콘드리아를 포함하고 있으며, 각각은 탄소와 산소를 에너지와 이산화탄소로 변환한다.
노화가 진행되는 동안, 미토콘드리아의 효율은 떨어지는 경향이 있다.이에 대한 이유는 아직 상당히 불분명하지만, 몇몇 메커니즘이 의심된다. 생물 [27]발생 감소, 미토콘드리아 DNA의 손상과 돌연변이 축적, 미토콘드리아 단백질의 산화, 유사식세포에 [28]의한 품질 관리 결함이다.
기능 장애가 있는 미토콘드리아는 세포[29][30] 내 신호를 방해하고 염증 [31]반응을 유발함으로써 노화에 기여한다.
세포의 노화
특정한 조건 하에서, 세포는 죽지 않고 세포주기를 빠져나가고, 대신 휴면 상태가 되어 정상적인 기능을 멈춘다.이것은 세포 노화라고 불린다.노화는 텔로미어 단축,[32] DNA[33] 손상 및 스트레스를 포함한 여러 요인에 의해 유발될 수 있습니다.면역체계가 노화세포를 [34]찾아내 제거하도록 프로그램 되어 있기 때문에, 노화는 몸이 회복할 수 없을 정도로 손상된 세포를 스스로 제거하는 하나의 방법일 수도 있다.
세포 노화와 노화 사이에는 몇 가지 연관성이 있습니다.
- 노화 전지의 비율은 나이가 [35]들수록 증가한다.
- 노화전지는 [36]노화의 원인이 될 수 있는 염증성 표지를 분비한다.
- 노화전지의 청소는 노화와 관련된 [37]장애의 시작을 지연시키는 것으로 밝혀졌다.
줄기세포 소진
줄기세포는 무한히 증식할 수 있는 미분화 또는 부분적으로 분화된 세포이다.수정 후 처음 며칠 동안, 배아는 거의 전적으로 줄기세포로 구성되어 있다.태아가 성장함에 따라 세포는 증식하고 분화하며 유기체 내에서 적절한 기능을 한다.성인의 줄기세포는 주로 점진적인 마모를 겪거나 지속적인 보충이 필요한 부위에 위치한다.
재생 능력의 상실은 노화의 가장 명백한 결과 중 하나이다.이는 [38]시간이 지날수록 줄기세포의 비율과 분열 속도가 점차 낮아지기 때문이다.줄기세포의 회춘은 노화의 영향을 생물학적 차원에서 [39]일부 되돌릴 수 있다는 것이 밝혀졌다.
세포간 통신의 변화
25,211
세포 신호 바이오마커의 가장 두드러진 변화 중 하나는 나이가 [40]들면서 몸 전체에 만성 저급 염증이 생기는 "염증"이다.염증의 정상적인 역할은 손상과 위협이 존재하는 한 신체의 면역 체계와 회복 메커니즘을 특정 손상 부위에 모으는 것이다.몸 전체에 염증 표지가 계속 존재하면 면역 체계가 마모되고 건강한 [41]조직이 손상됩니다.
또한 노화 세포는 이웃 [42]세포에서 노화를 유발하는 SASP(Senesence-Associated Secretory Phannotype)라고 불리는 특정 분자 세트를 분비하는 것으로 밝혀졌다.반대로, 한 조직을 대상으로 한 수명 연장 조작은 다른 조직에서도 노화 과정을 늦출 수 있다.[43]
대체 개념 모델
다른 과학자들은 '노화의 7대 기둥'이라고 불리는 약간 다른 노화 개념 모델을 정의했는데, 이 모델에는 '노화의 특징'[44] 중 3개만이 포함되어 있다.7개 기둥 모델은 노후 [45]모델의 9개 특징에서 강조되지 않은 7개 기둥 간의 상호 연결성을 강조합니다.
「 」를 참조해 주세요.
레퍼런스
- ^ a b c d López-Otín, Carlos; Blasco, Maria A.; Partridge, Linda; Serrano, Manuel; Kroemer, Guido (2013-06-06). "The Hallmarks of Aging". Cell. 153 (6): 1194–1217. doi:10.1016/j.cell.2013.05.039. ISSN 0092-8674. PMC 3836174. PMID 23746838.
- ^ a b Vijg, Jan; Suh, Yousin (2013-02-10). "Genome Instability and Aging". Annual Review of Physiology. 75 (1): 645–668. doi:10.1146/annurev-physiol-030212-183715. ISSN 0066-4278. PMID 23398157.
- ^ Schmitt, Michael W.; Prindle, Marc J.; Loeb, Lawrence A. (2012-09-06). "Implications of genetic heterogeneity in cancer: Schmitt et al". Annals of the New York Academy of Sciences. 1267 (1): 110–116. doi:10.1111/j.1749-6632.2012.06590.x. PMC 3674777. PMID 22954224.
- ^ De Bont, R. (2004-05-01). "Endogenous DNA damage in humans: a review of quantitative data". Mutagenesis. 19 (3): 169–185. doi:10.1093/mutage/geh025. ISSN 1464-3804. PMID 15123782.
- ^ de Duve, Christian (2005-02-09). "The onset of selection". Nature. 433 (7026): 581–582. Bibcode:2005Natur.433..581D. doi:10.1038/433581a. ISSN 0028-0836. PMID 15703726. S2CID 4355530.
- ^ Hoeijmakers, Jan H.J. (2009-10-08). "DNA Damage, Aging, and Cancer". New England Journal of Medicine. 361 (15): 1475–1485. doi:10.1056/NEJMra0804615. ISSN 0028-4793. PMID 19812404.
- ^ Chakravarti, Deepavali; LaBella, Kyle A.; DePinho, Ronald A. (2021-01-14). "Telomeres: history, health, and hallmarks of aging". Cell. 184 (2): 306–322. doi:10.1016/j.cell.2020.12.028. PMC 8081271. PMID 33450206. S2CID 231607042.
- ^ Hayflick, L.; Moorhead, P.S. (1961-05-15). "The serial cultivation of human diploid cell strains". Experimental Cell Research. 25 (3): 585–621. doi:10.1016/0014-4827(61)90192-6. PMID 13905658.
- ^ Blasco, Maria A. (2005-08-01). "Telomeres and human disease: ageing, cancer and beyond". Nature Reviews Genetics. 6 (8): 611–622. doi:10.1038/nrg1656. ISSN 1471-0064. PMID 16136653. S2CID 14828121.
- ^ Armanios, Mary; Alder, Jonathan K.; Parry, Erin M.; Karim, Baktiar; Strong, Margaret A.; Greider, Carol W. (2009-11-25). "Short Telomeres are Sufficient to Cause the Degenerative Defects Associated with Aging". The American Journal of Human Genetics. 85 (6): 823–832. doi:10.1016/j.ajhg.2009.10.028. PMC 2790562. PMID 19944403.
- ^ Jaskelioff, Mariela; Muller, Florian L.; Paik, Ji-Hye; Thomas, Emily; Jiang, Shan; Adams, Andrew C.; Sahin, Ergun; Kost-Alimova, Maria; Protopopov, Alexei; Cadiñanos, Juan; Horner, James W. (2010-11-28). "Telomerase reactivation reverses tissue degeneration in aged telomerase-deficient mice". Nature. 469 (7328): 102–106. doi:10.1038/nature09603. ISSN 1476-4687. PMC 3057569. PMID 21113150.
- ^ Kouzarides, Tony (2007-02-23). "Chromatin Modifications and Their Function". Cell. 128 (4): 693–705. doi:10.1016/j.cell.2007.02.005. ISSN 0092-8674. PMID 17320507. S2CID 11691263.
- ^ Siametis, Athanasios; Niotis, George; Garinis, George A. (2021-04-01). "DNA Damage and the Aging Epigenome". Journal of Investigative Dermatology. 141 (4): 961–967. doi:10.1016/j.jid.2020.10.006. ISSN 0022-202X. PMID 33494932. S2CID 231711205.
- ^ Guarente, L. (2011-01-01). "Sirtuins, Aging, and Metabolism". Cold Spring Harbor Symposia on Quantitative Biology. 76: 81–90. doi:10.1101/sqb.2011.76.010629. ISSN 0091-7451. PMID 22114328.
- ^ Haigis, Marcia C.; Sinclair, David A. (2010-01-01). "Mammalian Sirtuins: Biological Insights and Disease Relevance". Annual Review of Pathology: Mechanisms of Disease. 5 (1): 253–295. doi:10.1146/annurev.pathol.4.110807.092250. ISSN 1553-4006. PMC 2866163. PMID 20078221.
- ^ Ottens, Franziska; Franz, André; Hoppe, Thorsten (2021-02-04). "Build-UPS and break-downs: metabolism impacts on proteostasis and aging". Cell Death & Differentiation. 28 (2): 505–521. doi:10.1038/s41418-020-00682-y. ISSN 1476-5403. PMC 7862225. PMID 33398091.
- ^ Kirana, A.N.; Prafiantini, E.; Hardiany, N.S. (2021-02-22). "Protein intake and loss of proteostasis in the eldery". The Ukrainian Biochemical Journal. 93 (1): 30–39. doi:10.15407/ubj93.01.030.
- ^ Klaips, Courtney L.; Jayaraj, Gopal Gunanathan; Hartl, F. Ulrich (2017-11-10). "Pathways of cellular proteostasis in aging and disease". Journal of Cell Biology. 217 (1): 51–63. doi:10.1083/jcb.201709072. ISSN 0021-9525. PMC 5748993. PMID 29127110.
- ^ Yang, Ling; Licastro, Danilo; Cava, Edda; Veronese, Nicola; Spelta, Francesco; Rizza, Wanda; Bertozzi, Beatrice; Villareal, D.T.; Hotamisligil, G.S.; Holloszy, J.O.; Fontana, Luigi (2016-01-07). "Long-Term Calorie Restriction Enhances Cellular Quality-Control Processes in Human Skeletal Muscle". Cell Reports. 14 (3): 422–428. doi:10.1016/j.celrep.2015.12.042. PMID 26774472.
- ^ Blagosklonny, Mikhail V. (2013-12-15). "Aging is not programmed". Cell Cycle. 12 (24): 3736–3742. doi:10.4161/cc.27188. ISSN 1538-4101. PMC 3905065. PMID 24240128.
- ^ Laplante, Mathieu; Sabatini, D.M. (2012-04-13). "mTOR Signaling in Growth Control and Disease". Cell. 149 (2): 274–293. doi:10.1016/j.cell.2012.03.017. PMC 3331679. PMID 22500797.
- ^ Alers, S.; Loffler, A. S.; Wesselborg, S.; Stork, B. (2012-01-01). "Role of AMPK-mTOR-Ulk1/2 in the Regulation of Autophagy: Cross Talk, Shortcuts, and Feedbacks". Molecular and Cellular Biology. 32 (1): 2–11. doi:10.1128/MCB.06159-11. ISSN 0270-7306. PMC 3255710. PMID 22025673.
- ^ Schumacher, Björn; van der Pluijm, Ingrid; Moorhouse, Michael J.; Kosteas, Theodore; Robinson, Andria Rasile; Suh, Yousin; Breit, Timo M.; van Steeg, Harry; Niedernhofer, Laura J.; van IJcken, Wilfred; Bartke, Andrzej (2008-08-15). Kim, Stuart K. (ed.). "Delayed and Accelerated Aging Share Common Longevity Assurance Mechanisms". PLOS Genetics. 4 (8): e1000161. doi:10.1371/journal.pgen.1000161. ISSN 1553-7404. PMC 2493043. PMID 18704162.
- ^ Papadopoli, David; Boulay, Karine; Kazak, Lawrence; Pollak, Michael; Mallette, Frédérick; Topisirovic, Ivan; Hulea, Laura (2019-07-02). "mTOR as a central regulator of lifespan and aging". F1000Research. 8: 998. doi:10.12688/f1000research.17196.1. ISSN 2046-1402. PMC 6611156. PMID 31316753.
- ^ Fontana, L.; Partridge, L.; Longo, V. D. (2010-04-16). "Extending Healthy Life Span--From Yeast to Humans". Science. 328 (5976): 321–326. Bibcode:2010Sci...328..321F. doi:10.1126/science.1172539. ISSN 0036-8075. PMC 3607354. PMID 20395504.
- ^ Harrison, David E.; Strong, Randy; Sharp, Zelton Dave; Nelson, James F.; Astle, Clinton M.; Flurkey, Kevin; Nadon, Nancy L.; Wilkinson, J. Erby; Frenkel, Krystyna; Carter, Christy S.; Pahor, Marco (2009-07-16). "Rapamycin fed late in life extends lifespan in genetically heterogeneous mice". Nature. 460 (7253): 392–395. Bibcode:2009Natur.460..392H. doi:10.1038/nature08221. ISSN 0028-0836. PMC 2786175. PMID 19587680.
- ^ Sahin, Ergün; DePinho, Ronald A. (June 2012). "Axis of ageing: telomeres, p53 and mitochondria". Nature Reviews Molecular Cell Biology. 13 (6): 397–404. doi:10.1038/nrm3352. ISSN 1471-0072. PMC 3718675. PMID 22588366.
- ^ Wang, Ke; Klionsky, Daniel J (March 2011). "Mitochondria removal by autophagy". Autophagy. 7 (3): 297–300. doi:10.4161/auto.7.3.14502. ISSN 1554-8627. PMC 3359476. PMID 21252623.
- ^ Kroemer, Guido; Galluzzi, Lorenzo; Brenner, Catherine (January 2007). "Mitochondrial Membrane Permeabilization in Cell Death". Physiological Reviews. 87 (1): 99–163. doi:10.1152/physrev.00013.2006. ISSN 0031-9333. PMID 17237344.
- ^ Raffaello, Anna; Rizzuto, Rosario (January 2011). "Mitochondrial longevity pathways". Biochimica et Biophysica Acta (BBA) - Molecular Cell Research. 1813 (1): 260–268. doi:10.1016/j.bbamcr.2010.10.007. PMID 20950653.
- ^ Green, Douglas R.; Galluzzi, Lorenzo; Kroemer, Guido (2011-08-26). "Mitochondria and the Autophagy–Inflammation–Cell Death Axis in Organismal Aging". Science. 333 (6046): 1109–1112. Bibcode:2011Sci...333.1109G. doi:10.1126/science.1201940. ISSN 0036-8075. PMC 3405151. PMID 21868666.
- ^ Bodnar, Andrea G.; Ouellette, Michel; Frolkis, Maria; Holt, Shawn E.; Chiu, Choy-Pik; Morin, Gregg B.; Harley, Calvin B.; Shay, Jerry W.; Lichtsteiner, Serge; Wright, Woodring E. (1998-01-16). "Extension of Life-Span by Introduction of Telomerase into Normal Human Cells". Science. 279 (5349): 349–352. Bibcode:1998Sci...279..349B. doi:10.1126/science.279.5349.349. ISSN 0036-8075. PMID 9454332.
- ^ Collado, Manuel; Blasco, Maria A.; Serrano, Manuel (2007-07-27). "Cellular Senescence in Cancer and Aging". Cell. 130 (2): 223–233. doi:10.1016/j.cell.2007.07.003. ISSN 0092-8674. PMID 17662938. S2CID 18689141.
- ^ Sagiv, Adi; Krizhanovsky, Valery (2013-12-01). "Immunosurveillance of senescent cells: the bright side of the senescence program". Biogerontology. 14 (6): 617–628. doi:10.1007/s10522-013-9473-0. ISSN 1573-6768. PMID 24114507. S2CID 2775067.
- ^ Wang, Chunfang; Jurk, Diana; Maddick, Mandy; Nelson, Glyn; Martin‐Ruiz, Carmen; Zglinicki, Thomas Von (2009). "DNA damage response and cellular senescence in tissues of aging mice". Aging Cell. 8 (3): 311–323. doi:10.1111/j.1474-9726.2009.00481.x. ISSN 1474-9726. PMID 19627270. S2CID 9192359.
- ^ Malaquin, Nicolas; Martinez, Aurélie; Rodier, Francis (2016-09-01). "Keeping the senescence secretome under control: Molecular reins on the senescence-associated secretory phenotype". Experimental Gerontology. 82: 39–49. doi:10.1016/j.exger.2016.05.010. ISSN 0531-5565. PMID 27235851. S2CID 207584394.
- ^ Baker, Darren J.; Wijshake, Tobias; Tchkonia, Tamar; LeBrasseur, Nathan K.; Childs, Bennett G.; van de Sluis, Bart; Kirkland, James L.; van Deursen, Jan M. (2011-11-02). "Clearance of p16 Ink4a -positive senescent cells delays ageing-associated disorders". Nature. 479 (7372): 232–236. Bibcode:2011Natur.479..232B. doi:10.1038/nature10600. ISSN 1476-4687. PMC 3468323. PMID 22048312.
- ^ Behrens, Axel; van Deursen, Jan M.; Rudolph, K. Lenhard; Schumacher, Björn (March 2014). "Impact of genomic damage and ageing on stem cell function". Nature Cell Biology. 16 (3): 201–207. doi:10.1038/ncb2928. ISSN 1476-4679. PMC 4214082. PMID 24576896.
- ^ Rando, T.A.; Chang, H.Y. (2012-01-20). "Aging, Rejuvenation, and Epigenetic Reprogramming: Resetting the Aging Clock". Cell. 148 (1–2): 46–57. doi:10.1016/j.cell.2012.01.003. ISSN 0092-8674. PMC 3336960. PMID 22265401.
- ^ Panda, Alexander; Arjona, Alvaro; Sapey, Elizabeth; Bai, Fengwei; Fikrig, Erol; Montgomery, Ruth R.; Lord, Janet M.; Shaw, Albert C. (2009-06-22). "Human innate immunosenescence: causes and consequences for immunity in old age". Trends in Immunology. 30 (7): 325–333. doi:10.1016/j.it.2009.05.004. ISSN 1471-4906. PMC 4067971. PMID 19541535.
- ^ Franceschi, Claudio; Bonafè, Massimiliano; Valensin, Silvana; Olivieri, Fabiola; Luca, Maria De; Ottaviani, Enzo; Benedictis, Giovanna De (2000). "Inflamm-aging: An Evolutionary Perspective on Immunosenescence". Annals of the New York Academy of Sciences. 908 (1): 244–254. Bibcode:2000NYASA.908..244F. doi:10.1111/j.1749-6632.2000.tb06651.x. ISSN 1749-6632. PMID 10911963. S2CID 1843716.
- ^ Nelson, Glyn; Wordsworth, James; Wang, Chunfang; Jurk, Diana; Lawless, Conor; Martin‐Ruiz, Carmen; Zglinicki, Thomas von (2012). "A senescent cell bystander effect: senescence-induced senescence". Aging Cell. 11 (2): 345–349. doi:10.1111/j.1474-9726.2012.00795.x. ISSN 1474-9726. PMC 3488292. PMID 22321662.
- ^ Lavasani, Mitra; Robinson, Andria R.; Lu, Aiping; Song, Minjung; Feduska, Joseph M.; Ahani, Bahar; Tilstra, Jeremy S.; Feldman, Chelsea H.; Robbins, Paul D.; Niedernhofer, Laura J.; Huard, Johnny (2012-01-03). "Muscle-derived stem/progenitor cell dysfunction limits healthspan and lifespan in a murine progeria model". Nature Communications. 3 (1): 608. Bibcode:2012NatCo...3..608L. doi:10.1038/ncomms1611. ISSN 2041-1723. PMC 3272577. PMID 22215083.
- ^ Kennedy, Brian; Berger, Shelley (2014). "Geroscience: linking aging to chronic disease". Cell. 159 (4): 709–713. doi:10.1016/j.cell.2014.10.039. ISSN 1097-4172. PMC 4852871. PMID 25417146.
- ^ Gems, David; de Magalhães, João Pedro (2021). "The hoverfly and the wasp: A critique of the hallmarks of aging as a paradigm". Ageing Research Reviews. 70: 101407. doi:10.1016/j.arr.2021.101407. ISSN 1568-1637. PMC 7611451. PMID 34271186.