뇌유기체
Cerebral organoid뇌 오르가노이드, 즉 뇌 오르가노이드(brain organoid)는 뇌를 닮은 인공적으로 성장한 체외 미니어처 기관을 묘사한다. 대뇌 오르가노이드는 3차원 회전 생물학적 원료로 만능줄기세포를 배양해 만들어지며, 수개월에 걸쳐 발달한다.[1] 뇌는 이질적인 조직의 극도로 복잡한 시스템이며 다양한 신경세포로 구성되어 있다. 이러한 복잡성은 뇌를 연구하고 뇌가 어떻게 작용하는지를 이해하는데, 특히 신경퇴행성 질환에 관한 한 어려운 일을 하게 만들었다. 체외 신경학적 모델을 만드는 목적은 이러한 질병들을 보다 단순하고 가변적인 공간에서 연구하기 위함이다. 이 3D 모델은 많은 잠재적인 생체내 제약이 없다. 인간과 다른 포유류 모델들 사이의 다양한 생리학은 신경 질환에서 연구 범위를 제한한다. 뇌 오르가노이드는 여러 종류의 신경세포를 포함하고 있으며 뇌에서 관찰된 피질의 부위를 다시 요약하는 해부학적 특징을 가진 합성 조직이다.[2] 대뇌 오르가노이드는 피질 및 맥락막 플렉서스라고 불리는 뉴런 층과 가장 비슷하다. 어떤 경우에는 망막, 뇌막, 해마와 유사한 구조물이 형성될 수 있다.[1][3] 줄기세포는 많은 다른 종류의 조직으로 성장할 수 있는 잠재력을 가지고 있으며, 그들의 운명은 많은 요인에 달려 있다. 아래는 줄기세포를 다양한 신경조직으로 분화시킬 수 있는 화학적 요인을 보여주는 이미지인데, 그 이후 구체적인 유기체 정체성을 생성하는 보다 심도 있는 표는 발표되었다.[4] 뇌 오르가노이드를 배양하는 데 사용되는 줄기세포에도 이와 유사한 기술이 사용된다.[2]
모델 개발
인간 만능줄기세포를 이용해 체외 대뇌 오가노이드(Organoids)를 만들면 연구자들은 인간의 신경조직에 대한 현재의 발달 메커니즘을 요약할 수 있을 뿐만 아니라 인간의 신경질환의 뿌리를 연구할 수 있다. 뇌 오르가노이드는 질병 병리학이 어떻게 작용하는지 이해하는 데 사용되는 조사 도구다. 이 오르가노이드들은 현재의 시험관내 방법이 너무 간단한 반면 설치류나 다른 포유류 모델보다 인간에게 더 많이 적용된다는 실험에 사용될 수 있다. 역사적으로 뇌가 어떻게 작용하는지에 대한 주요한 돌파구는 인간의 뇌 기능의 부상이나 장애를 연구한 결과로서 뇌의 부위가 어떻게 작용하는지 이해하게 되었다. 시험관내 인간의 뇌 모델은 인간의 뇌에 대한 이해에서 다음 파동을 가능하게 할 것이다.[1][5]
컬처링
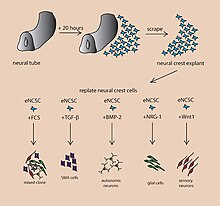
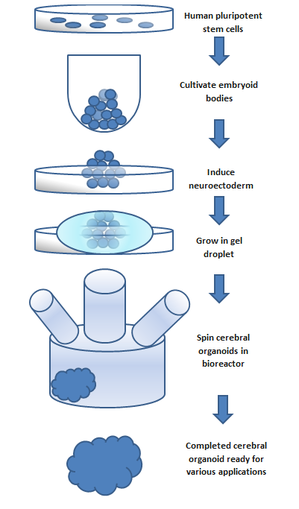
유기체를 만들기 위해, 자연적인 줄기세포로부터 자라난 태아(배아적 특징을 지닌)를 사용한다. 배아는 내막, 중막, 외막의 세 가지 층을 가지고 있다. 각각은 다양한 신체 부위로 변한다. 신경계는 엑토더름(치과 에나멜과 표피에도 기여한다)[5]으로부터 성장한다. 엑토더피 세포를 젤 방울에 넣고 회전하는 생물 거품기로 영양 수프를 떠서 용기에 의해 형성되지 않고 세포 성장을 지지했다. 10일 후에 오르가노이드에 뉴런이 생겼다. 30일 후에 그것은 뇌의 부분과 유사한 부위를 표시했다. 혈액 공급이 부족하면 뇌 오르가노이드의 지름은 약 4mm이며 1년 이상 지속될 수 있다.[3] 일반적인 절차는 5단계로 나눌 수 있다. 첫번째 인간의 전지전능한 줄기세포는 배양된다. 그리고 나서 그들은 발생성 몸체로 배양될 수 있다. 그 다음에 세포 배양균이 신경구조체를 형성하도록 유도된다. 신경구조체는 그 후 매트리겔 방울에서 자란다. 매트리겔은 영양분을 공급하고 신경세포는 증식하여 성장하기 시작한다. 유의할 점은 이러한 세포들이 스스로 조직하는 동안 뇌 오르가노이드 상대방에 있는 특정 뇌 영역의 복제는 서로 다른 발달 단계에서 세포외 신호를 유기체 환경에 추가함으로써 달성된다는 것이다; 이러한 신호들은 세포 분화 패턴에 변화를 일으키는 것으로 발견되어 이를 선도한다. 원하는 뇌 부위의 재집계를 [4]위해 일반적으로 SMAD 억제는 일반적인 뇌 오르가노이드 배양 과정에 사용된다; 최근의 연구는 이 과정의 억제가 뇌 오르가노이드에서 미세 글리아를 발생시킨다는 것을 보여준다.[6] 혈관조직의 부족은 오르가노이드의 성장 가능한 크기를 제한한다는 점에 유의해야 한다. 이것은 오르가노이드 개발의 주요한 한계였다; 그러나 최근, 회전하는 생물 원료를 사용하는 새로운 방법들은 오르가노이드 내부의 세포에 영양소의 이용 가능성을 증가시켰다. 이 마지막 단계는 오르가노이드 개발의 핵심 돌파구였다.[7] 회전하는 생물작용제는 세포 배양과 조직 성장 응용 분야에서 점점 더 많이 사용되어 왔다. 원자로는 정적으로 배양된 세포에 비해 더 빠른 세포 배율, 증가된 세포 배율, 증가된 세포 외 매트릭스 성분을 전달할 수 있다.[8]
이것은 매들린 랭커스터가[1] 약술한 원래의 방법이었고 그 후 개발되고 정제되었다. 새로운 방법들은 뇌혈관 오르가노이드의 개발을 가능하게 하고,[9] 이를 통해 순환을 제공하는 마이크로 펌프가 개발되고 있는데, 이는 조지 M 박사가 이 영상에서 설명한 것이다. 교회다.
구성 요소들
차별화
회전하는 생물작용제 3D 배양법을 이용해 성장한 뇌유기체는 시신경 컵, 해마, 텔렌스펠론 복측부, 등피질 등 다양한 신경조직 유형으로 분화되는 것으로 나타났다.[10] 게다가, 인간의 뇌 오가노이드들은 본질적으로 통합된 빛에 민감한 시신경 컵을 개발할 수 있다는 것을 보여주었다.[11]
신경줄기/생체세포는 스스로 재생할 수 있고 다발성이기 때문에 특이하다. 이것은 신경계의 두 가지 주요 구성 요소인 뉴런과 글리알 세포를 생성할 수 있다는 것을 의미한다. 이들 세포의 운명은 분화 과정에 영향을 미치는 몇 가지 요인에 의해 제어된다. 신경생성세포의 공간적 위치와 시간적 속성은 세포가 뉴런이나 활엽세포를 형성할 경우 영향을 미칠 수 있다. 그리고 나서 추가적인 분화는 세포외 조건과 세포 신호에 의해 제어된다.[12] 신경생성세포가 해마조직, 시신경, 대뇌피질 등 특정 신경조직으로 분화하는 데 필요한 정확한 조건과 자극은 알려지지 않았다. 뇌 오르가노이드는 이러한 과정의 발달 메커니즘을 연구하는 데 사용될 수 있다고 여겨진다.[7]
유전자 발현상
신경생성세포와 줄기세포가 특정 신경조직으로 분화되고 있는지 테스트하기 위해 여러 유전자 표지를 테스트할 수 있다. 만능 단계 중에 존재하는 두 개의 마커는 OCT4와 NANOG이다. 이 두 마커는 오르가노이드의 개발 과정에서 감소한다. 성공적인 신경 유도 SOX1과 PAX6을 주목하는 신경 정체성 표지는 오르가노이드 개발 중에 상향 조정된다. 이러한 표현의 변화는 뇌 오르가노이드의 자가 유도 분화의 경우를 뒷받침한다.[1] 전뇌와 후뇌의 표지도 시험할 수 있다. 전뇌 표식기 FOXG1과 SIX3는 유기체 개발 전반에 걸쳐 고도로 표현된다. 다만 뒷뇌 표식기 EGR2와 ISL1은 초기 존재는 보이나 후기 단계에서는 감소한다. 전뇌발달에 대한 이러한 불균형은 인간의 뇌발달에 있어서 전뇌조직의 발달확대와 유사하다.[1] 오가노이드가 지역적 사양으로 더 발전하는지 테스트하기 위해 대뇌피질과 후두엽에 대한 유전자 표지를 테스트했다. 뇌피질 형태학적으로 뇌피질 형태학적으로 표시된 전뇌마커 FOXG1이 있는 많은 지역도 등피질 정체성을 나타내는 표지자 EMX1에 양성반응이 나타났다. 이러한 특정 부위는 대뇌피질을 가장 먼저 나타내고 후두엽을 나타낸 후 두 부위가 각각 AUTS2, TSHZ2, LMO4 마커로 더욱 지정할 수 있다.[1] 해마, 복측전뇌, 초로이드 플렉서스의 유전적 표지도 뇌 오르가노이드에 존재하지만 이들 지역의 전체적인 구조는 아직 형성되지 않았다.
조직.
뇌 오가노이드도 기능성 뇌피질 뉴런을 갖고 있다. 이 뉴런들은 방사상으로 구성된 피질 판에 형성되어야 한다. 표식기 TBR1은 피질판의 전구체인 프리플레이트에 존재하며, 30일 된 대뇌 오가노이드에 뉴런 표식기인 MAP2와 함께 존재한다. 이 표지는 전판과 유사한 기저 신경층을 나타낸다. 이 세포들은 또한 무차별적으로 중립지대에 인접해 있으며 릴린+양성으로 카잘-레지우스 세포의 존재를 나타낸다. 카잘-레지우스 세포는 피질 판 구조의 생성에 중요하다.[7] 피질판은 대개 후발 뉴런들이 상단 피상층으로 이동하도록 내부적으로 생성된다. 이 조직은 유전자 표식검사를 바탕으로 한 뇌유기체에도 존재한다. 일찍 태어난 뉴런은 표식기 CTIP2를 가지고 있으며, TBR1에 인접하여 프리플레이트 세포를 보여준다. SATB2와 BRN2 마커를 가진 말기 뉴런은 피질 판층 형성을 암시하는 초창기 뉴런보다 전판으로부터 더 멀리 떨어진 피상층에 위치한다. 또한, 75일의 형성 후에 뇌 오르가노이드는 세포가 부족한 지역인 초보적인 한계 영역을 보여준다. 적층 피질판의 형성은 뇌 오르가노이드에서 매우 기초적이며, 오르가노이드에는 적층 II-VI 조직의 형성을 유도하는 단서와 요인이 결여되어 있음을 시사한다.[1] 그러나 뇌 오르가노이드 뉴런은 GFP 체인에 의해 보여지는 바와 같이 축을 형성할 수 있다. GFP 라벨이 부착된 차축은 분기와 성장 원뿔 형성이 복잡한 것으로 나타났다. 게다가, 칼슘 염료 영상촬영은 개별 세포에 Ca2+ 진동과 자발적인 칼슘 서지를 가진 뇌 오르가노이드를 보여주었다. 칼슘 신호는 글루탐산염을 통해 강화되고 테트로도톡신을 통해 억제될 수 있다.[1]
환경과의 상호작용
디시브레인에서는 성장한 인간의 뇌세포가 디지털 시스템에 통합되어 전기생리학적 자극과 녹화를 통해 시뮬레이션된 Pong을 연주했다. 그 세포들은 가상의 게임 세계에 구현되었을 때 "퐁에서 현저하게 향상된 성능을 보여주었다".[13][14][15]
- 주변 조직과의 상호작용
줄기세포에 의해 형성된 개별 국부적 조직이 어떻게 주변 조직과 조화를 이루어 전체 장기로 발전할 수 있는지는 완전히 이해되지 않는다.[16] 그러나 대부분의 조직 분화는 주변 조직과의 상호작용이 필요하며 다양한 분화와 물리적 국소화를 억제하거나 장려하기 위해 분산유도인자에 의존한다는 것이 밝혀졌다.[16] 뇌 유기체 분화는 다소 국부적이다. 앞에서 언급한 전뇌와 후두뇌의 표시자는 물리적으로 국부적이며, 군집 형태로 나타난다. 이것은 하나 이상의 세포가 조직 전체의 무작위 경로와는 반대로 특정 유형으로 분화되면 국소 자극이 방출된다는 것을 암시한다. 피질 로브, 전두엽 피질, 후두엽의 아규격화 표지도 물리적으로 국부적이다. 그러나 해마와 복측전뇌세포는 물리적으로 국부화되지 않고 뇌유기체를 통해 임의로 위치한다.[1] 뇌 오르가노이드는 혈관이 부족하고 가장 안쪽 세포의 영양소 섭취에 의해 크기가 제한된다. 시험관내 영양분 전달 시스템의 통합으로 뇌 오르가노이드 개발의 다음 번 큰 도약을 촉발할 가능성이 높지만 회전하는 바이오 액터와 첨단 3D 비계 기술은 오르가노이드 크기를 증가시킬 수 있다.[17]
어세이
뇌 오가노이드는 질병과 유전자 발현이 연구될 수 있는 모델로서 기능할 수 있는 잠재력을 가지고 있다.[18] 그러나 뇌 오르가노이드 조직을 평가하고 문제의 질병이나 발달 상태를 모형화하는 오르가노이드(Orgoroid)를 만들려면 진단 도구가 필요하다.[19] 개별 환자에서 파생된 뇌 오르가노이드의 병리학을 검사하기 위한 분석으로 transcriptom 분석이 사용되어 왔다.[20] 또한 TUNEL 검정은 뇌 오르가노이드에서 세포사멸의 평가 지표로 연구에 사용되어 왔다.[21] 뇌 오르가노이드를 분석하는 데 사용되는 다른 측정에는 다음이 포함된다.
유전자변형
뇌 오가노이드는 유전자 변형을 통한 유전자 발현을 연구하는 데 사용될 수 있다.[18] 이러한 유전자변형이 전체 오르가노이드에 존재하는 정도는 이러한 유전자변형이 이루어질 때 뇌 오르가노이드의 발달단계에 따라 달라진다; 뇌 오르가노이드의 단일 세포단계에 있을 때와 같이 이러한 변경이 조기에 이루어질수록 이러한 변형이 gr에 영향을 줄 가능성이 더 높다.뇌 오르가노이드에 있는 세포의 섭취하는 [18]부분 이러한 유전자변형이 뇌 오르가노이드 내에 존재하는 정도도 이러한 유전자변형이 이루어지는 과정에 따라 달라진다. 만약 유전 정보가 기계를 통해 하나의 뇌 유기체 세포의 게놈에 투여된다면, 유전자 변형은 복제에 의한 세포에 존재할 것이다.[18] 크리스퍼/카스 9는 이 오래 지속되는 유전자 변형을 할 수 있는 방법이다.[18] 트랜스포존의 사용을 포함하는 시스템은 오래 지속되는 유전자 변형을 생성하기 위한 수단으로도 제안되었다. 그러나 트랜스포존이 세포 게놈과 상호작용하는 정도는 세포마다 다를 수 있으며, 이것은 뇌 유기체 세포들 사이에 가변적인 표현성을 만들어낼 것이다.[18] 그러나 "유전자 화물" 삽입(아데노 관련 바이러스/전기증식 방법 등)을 통해 유전적 변형이 이루어진다면, 뇌 오르가노이드의 세포분열의 각 라운드에 따라 유전적 변형이 덜 존재하는 것으로 밝혀졌다.[18]
계산 방법
연산 방법의 사용은 뇌 오르가노이드 재배 프로세스의 개선을 돕기 위한 수단으로 요구되어 왔다. 또한 현재의 방법으로는 제공할 수 없는 뇌 오르가노이드의 다른 요소(세포 연결 등)의 필요한 세부적인 렌더링을 제공하기 위해 연산 방법의 개발도 요구되어 왔다.e.[19] 세부적인 뇌 유기체 형태학을 모델링하도록 설계된 프로그래밍은 아직 존재하지 않는다.[19]
적용들
세포의 운명 잠재력, 세포 교체 치료, 세포형 특정 게놈 분석과 같이 뇌 유기체 사용을 위한 많은 잠재적 응용이 있다.[17] 또한 뇌 오르가노이드는 신경조직의 발달 시기에 대한 독특한 통찰력을 제공하며 종 간의 차이를 연구하는 도구로 사용될 수 있다.[17] 뇌 오르가노이드에 대한 추가적인 잠재적 적용은 다음을 포함한다.[17]
조직형태생성
뇌 오르가노이드에 관한 조직 형태생식은 척추동물에서 신경기관이 어떻게 형성되는지를 다룬다. 뇌 오르가노이드는 형성을 연구하고, 조절하며, 나아가 그것을 제어하는 메커니즘을 이해하는 체외 도구의 역할을 할 수 있다.[17]
마이그레이션 검사
뇌 오가노이드는 세포이동을 연구하는 데 도움을 줄 수 있다. 신경 유리 세포는 매우 다양한 신경 세포를 덮고 있으며, 그 중 일부는 뉴런 주위를 돈다. 일반적으로 뉴런뿐만 아니라 그들의 움직임을 지배하는 요소들은 뇌 오르가노이드를 이용하여 연구될 수 있다.[5]
클론 계통 추적
클론 혈통 추적은 운명의 매핑의 일부로서, 분화된 조직의 혈통은 전능한 조상으로부터 추적된다. 방사된 국소 자극과 분화의 메커니즘은 뇌 오르가노이드를 모델로 하여 연구할 수 있다.[17] 뇌 오르가노이드의 유전자변형은 혈통추적을 달성하는 수단이 될 수 있다.[18]
이식
뇌 오가노이드는 특정 뇌 부위를 성장시켜 치료제로 신경 탈모 부위에 이식하는 데 사용될 수 있다.[22][23] 그들은 숙주 혈관조영술과 융합할 수 있고 면역학적으로 조용할 수 있다.[24] 어떤 경우에는 이러한 뇌 오르가노이드의 게놈을 먼저 편집해야 할 것이다.[20] 최근의 연구는 성공적인 이식 및 생쥐 뇌에 뇌 오르가노이드를 통합할 수 있었고, 이식 후 세포 분화와 혈관성 발달도 관찰되었다.[25] 뇌 오르가노이드는 구조가 유사하기 때문에 인간의 뇌에서 이식 및 재구축의 기초가 될 수 있다.[25]
약물검사
뇌 오르가노이드는 약물의 효과를 연구하고 초기 안전성과 효능을 검사하기 위해 복잡한 뇌조직의 단순한 모델로 사용될 수 있다. 신경성 질환에 대한 신약 실험은 뇌 오르가노이드에 약물 고투과 검사법을 적용하는 이 방법에서도 나올 수 있다.[20]
질병연구
오르가노이드는 뇌 발달의 중요한 초기 단계를 연구하기 위해 사용될 수 있고, 약물을 테스트하고, 살아있는 세포로 만들 수 있기 때문에 개별 환자를 연구하기 위해 사용될 수 있다.[3] 또한, 혈관형 뇌 오르가노이드의 개발은 향후 뇌졸중 치료를 조사하는 데 사용될 수 있다.[26]
지카 바이러스
지카 바이러스는 기형 유발 효과가 있어 태아 신경계 발달에 결함을 유발하는 것으로 나타났다. 뇌 오르가노이드는 지카 바이러스가 태아의 뇌에 영향을 미치고 어떤 경우에는 소두증을 유발하는 과정을 이해하기 위해 연구에 이용되어 왔다.[20][21] 지카 바이러스에 감염된 뇌 오가노이드는 태아 소두증을 반사하는 미감염자보다 크기가 작은 것으로 밝혀졌다.[20][21] 지카 바이러스에 감염된 뇌 오가노이드에서도 사멸 증가가 발견되었다.[27] 또 다른 연구에서는 이러한 표본들에서 신경 세포 세포(NPC)의 수가 크게 감소했다는 것을 발견했다. NPC인구가 감소하는 두 가지 방법은 세포사망 증가와 세포확산 감소였다. TLR3 수용체 상향 조정은 이러한 감염된 오르가노이드에서 확인되었다. 이 TLR3 수용체 억제는 지카 유도 효과의 일부를 부분적으로 정지시키는 것으로 나타났다.[28] 또한, 지카 바이러스에 감염된 오가노이드에서 루멘 크기가 증가한 것으로 밝혀졌다.[20][21] 각기 다른 성숙 단계에서 지카 바이러스에 감염된 뇌 오르가노이드를 연구한 결과 태아 발육 시 조기 노출이 지카 바이러스 관련 신경학적 선천성 결함의 가능성을 높일 수 있음을 시사한다.[21]
코카인
코카인은 태아 발달에도 기형 유발 효과가 있는 것으로 나타났다. 뇌 오르가노이드는 임신 중 코카인 사용으로 인한 태아 신경학적 결함에 어떤 효소 이소성형이 필요한지를 연구하기 위해 사용되어 왔다.[20] 이러한 효소 중 하나는 시토크롬 P450 이소형 CYP3A5로 결정되었다.[20]
소두증
한 사례에서 소두증 환자에서 성장한 뇌 오르가노이드 성분이 관련 증상을 보여 원인이 지나치게 빠른 발육에 있고, 그 뒤에 뇌의 성장이 더딘 것으로 나타났다. 소두증은 뇌가 약하게 유지되는 발달로 머리가 약해지고 쇠약해진다. 소두증은 조건을 복제하지 않는 마우스 모델에는 적합하지 않다.[3] 이 병의 주된 형태는 소두증 유전자의 균질 돌연변이에 의한 것으로 생각된다. 이 질병은 쥐가 인간이 가지고 있는 대뇌피질 확대에 대한 발달 단계가 부족하기 때문에 쥐 모델에서 번식하기 어렵다. 당연히, 이러한 발달에 영향을 미치는 질병은 처음부터 그것을 가지고 있지 않은 모델에서 나타나기가 불가능할 것이다.[29] 뇌 오가노이드로 사람의 소두증을 모델링하기 위해, 한 그룹의 연구자들은 환자의 피부 섬유질을 채취하여 4개의 잘 알려진 재프로그래밍 인자를 사용하여 재프로그래밍했다. 여기에는 OCT4, SOX2, MYC, KLF4 등이 포함된다. 재프로그래밍된 샘플은 유도 만능 줄기세포로 복제될 수 있었다. 그 세포들은 아래의 뇌 오르가노이드 생성 섹션에서 설명하는 과정을 따라 뇌 오르가노이드로 배양되었다. 그 결과로 생긴 오르가노이드에는 신경생성세포와 작은 조직들의 수가 줄어들었다. 또한 환자 유래 조직은 증류제로 만들어진 신경세포 조직, 방사상 활엽 줄기세포 감소, 뉴런 증가 등을 보여 주었다. 이러한 결과는 소두증의 근본적인 메커니즘이 세포가 뉴런으로 조기 분화하여 방사상 활엽세포의 결손을 남김에 의해 발생한다는 것을 시사한다.[1]
알츠하이머병
알츠하이머병리학은 또한 뇌 오르가노이드로 모델링되었다.[30] 영향을 받은 개인의 만능 줄기세포는 뇌 오르가노이드 생성에 사용되었고 건강한 개인으로부터 합성된 제어 모델과 비교되었다. 영향을 받은 모델에서는 아밀로이드 베타 단백질과 신경섬유질 엉킴으로 인한 플라크와 유사한 구조물이 관찰되어 병의 증상을 유발하는 것으로 밝혀졌다.[31] 이것을 그렇게 정확하게 모형화하려는 이전의 시도는 성공하지 못했으며, 임상 전 뮤린 모델에서 효능에 기초하여 개발된 약물은 인간 실험에 아무런 영향을 주지 않았다.[32]
자폐 스펙트럼 질환
뇌 오가노이드는 자폐증 스펙트럼 장애를 연구하는데도 사용될 수 있다.[33] 한 연구에서 뇌 오르가노이드들은 거시적인 ASD 환자들로부터 파생된 세포로부터 배양되었다.[33] 이러한 뇌 오르가노이드들은 환자에게서 발견되는 ASD 관련 매크로체 표현형의 전형적인 특징을 반영하는 것으로 밝혀졌다.[33] 대뇌혈관확장증을 가진 ASD 환자들의 뇌 오르가노이드를 배양함으로써, 특정 유전자 돌연변이와 표현형 표현 사이에 연결될 수 있었다.[33] 자폐증은 또한 건강한 뇌와 영향을 받는 합성 뇌 오가노이드의 비교를 통해 연구되었다.[34] 두 모델을 관찰한 결과, 영향을 받은 모델에서 더 많은 양의 GABAergic 억제 뉴런을 생성하는 전사 인자 FOXG1의 과도한 억제가 나타났다. 뇌 오르가노이드의 이러한 사용의 중요성은 만약 사실이 입증된다면 그 질병이 치료될 수 있도록 약물의 대상을 식별하는 데 도움이 될 수 있는 흥분/잠시적 불균형 가설에[35] 대한 큰 지지를 추가했다는 것이다.
후생유전학의 분야와 DNA 메틸화가 ASD 개발에 어떤 영향을 미칠지도 최근 몇 년간 관심의 대상이었다. ASD를 가지고 있는 개인으로부터 사후의 신경 샘플을 연구하는 전통적인 방법은 많은 도전을 제기하고 있기 때문에, 후생유전학적 메커니즘이 자폐증의 발달에 미칠 수 있는 잠재적 영향을 연구하는 대체적인 방법으로 뇌 오르가노이드가 제안되어 왔다. ASD 및 후생유전학적 패턴을 검사하기 위해 뇌 오르가노이드 모델을 사용하는 것은 후생유전학적 발달 일정에 관한 통찰력을 제공할 수 있다. 그러나, 뇌 오르가노이드가 배양되는 조건은 유전자 발현에 영향을 미칠 수 있으며, 결과적으로 이 모델을 사용하여 만들어진 관찰에 영향을 미칠 수 있다는 점에 유의해야 한다. 또한, 같은 표본에서 배양된 뇌 오가노이드의 가변성에 대한 우려도 있다.[36] 1차 샘플에서 발견된 후생유전학적 패턴을 뇌 오가노이드들이 재현하는 정도와 정확성에 대한 추가 연구도 필요하다.[36]
기전 저산소증/허혈증
저산소성 전 손상은 인간의 태아 뇌조직의 제한된 가용성과 인간의 피질생식을 연구하기에 부적절한 동물 모델 때문에 연구하기 어려운 상태로 남아 있다. 대뇌 오르가노이드(Organoid)는 태아 병리학을 모델링하고, 코르티코제네시스 동안 저산소증과 다른 신경 세포 유형의 민감성을 비교하는 데 사용될 수 있다. 단백질 반응 경로의 확장으로 인해 중간 생성자가 특히 영향을 받는 것 같다.[37] 저산소증이 뇌 오르가노이드에 세포사멸을 초래해 외부 방사형 글리아와 신경블라스트/불멸성 뉴런이 특히 영향을 받는다는 사실도 관찰됐다.[38]
글리오블라토마스속
전통적인 교모세포 연구 방법에는 한계가 있다. 그러한 제한사항의 한 예는 제한된 샘플 가용성일 것이다. 좀 더 전통적인 접근법을 사용하는 것과 함께 오는 이러한 어려움 때문에, 뇌 오르가노이드들은 뇌암의 발전을 모형화하는 대체 수단으로 이용되어 왔다. 한 연구에서 뇌 오르가노이드는 CRISPR CAS-9를 사용하여 종양과 같은 특성을 반영하도록 시뮬레이션되었다. 이러한 유전자 변형 모델에서 증가된 세포 분열이 관찰되었다. 뇌 오르가노이드는 또한 종양과 불침투성을 연구하기 위해 쥐 모델에도 사용되었다. 동시에, 뇌암의 성장은 뇌 오르가노이드 모델에서 아직 재현할 수 없는 환경적 요인에 의해 영향을 받는다. 뇌 오가노이드는 종양 발달을 담당하는 유전자의 조절 오류에 대한 통찰력을 제공하는 것으로 나타났다.[27]
제한 사항
뇌 오르가노이드는 3D 세포 배양 카운터 파트보다 선호된다. 왜냐하면 그들은 인간의 뇌의 구조를 더 잘 반영할 수 있고, 어느 정도까지는 태아 신피질 발달을 장기간에 걸쳐 반영할 수 있기 때문이다. 대뇌 오르가노이드는 잠재력이 많지만 이들의 배양과 발달에는 한계가 있고 개선해야 할 영역이 있다.[27] 예를 들어 하나의 뇌 오르가노이드(Organoid)를 만드는 데는 몇 달이 걸리며, 이를 분석하는 데 사용되는 방법 또한 시간이 많이 걸린다.[25] 게다가, 뇌 오르가노이드는 혈액 뇌 장벽과 같이 인간의 뇌에 전형적인 구조를 가지고 있지 않다.[27] 이것은 연구할 수 있는 질병의 종류를 제한한다. 그 밖의 제한사항은 다음과 같다.
네크로틱 센터
최근까지 오가노이드의 중심부는 산소와 영양소가 가장 안쪽까지 닿지 못해 괴사하는 것으로 밝혀져 왔다.[26][19] 이것은 뇌 오르가노이드의 생리학적 적용성에 제한을 가한다.[19] 이러한 산소와 영양소의 부족 때문에 신경생성세포는 성장에 한계가 있다.[39] 그러나, 최근의 연구 결과는 뇌 오르가노이드 배양 과정에서, 오르가노이드의 매체 노출을 증가시키기 위해 유체 장치를 사용함으로써 괴사성 센터를 피할 수 있다는 것을 암시한다.[19]
생성 시 신뢰성
서로 다른 문화에 걸친 뇌 오르가노이드의 구조는 가변적인 것으로 밝혀졌다; 획일성을 보장하기 위한 표준화 절차는 아직 일반적인 관행으로 자리잡지 못했다.[26] 뇌 오르가노이드 생산을 개정하기 위한 향후 단계에는 뇌 오르가노이드 생성을 표준화하는 방법을 만드는 것이 포함될 것이다.[26] 제안된 그러한 단계 중 하나는 뇌 오르가노이드가 배양되는 젤의 구성과 두께를 조절하는 것이다; 이것은 뇌 오르가노이드 생산에서 더 큰 신뢰성에 기여할 수 있다.[19] 또한, 사용된 줄기세포의 차이 때문에 뇌 오가노이드 생성의 가변성이 도입된다.[20] 이러한 차이는 제조방법이 다르거나 주계약의 차이에서 발생할 수 있다.[20] 신진대사 스트레스 증가는 오르가노이드 내에서도 발견되었다. 이 대사 스트레스는 오르가노이드의 특수성을 제한하는 것으로 밝혀졌다.[6] 유기체 배양 효율화를 위한 향후 단계에는 한 번에 두 개 이상의 샘플을 분석하는 것이 포함된다.[25]
성숙도
현재 뇌 오르가노이드의 성숙한 시냅스 개발은 사용되는 매체 때문에 한계가 있다.[26] 또한 일부 전기생리학적 특성이 뇌 오르가노이드에서 발달하는 것으로 나타난 반면, 분리되고 구별되는 유기체 영역의 재배는 이러한 전기생리학적 성질의 성숙을 제한하는 것으로 나타났다. 시냅트제네시스 같은 신경분열 연대표에서 발달의 전형적 전기생리학적 신경개발 프로세스의 모델링은 아직 뇌 유기체 모델에서 제안되지 않았다.[6] 뇌 오가노이드들은 태아의 신경 발달 과정에서 일어나는 일을 반영하기 때문에, 그 안에서 얼마나 늦게 발병하는 질병이 나타나는지에 대한 우려가 있어왔다. 향후 개선사항에는 뇌 오가노이드의 신경퇴행성 질환을 재점검하는 방법을 개발하는 것이 포함된다.[25]
윤리학
뇌 오가노이드를 질병의 모델로 삼는 것은 고통 등 감각을 경험하거나 의식을 발달시킬 수 있는 능력을 갖출 수 있기 때문에 윤리적 우려가 제기돼 왔다.[40] 현재 인간 두뇌의 복잡성에 비해 합성된 모델의 단순성을 고려할 때 그럴 가능성은 낮지만,[41] 모델은 빛에 기초한 자극에 반응하는 것으로 나타났기 때문에 현재 모델은 현재 일부 자극에 반응하는 어떤 범위를 가지고 있다. 만약 그러한 감각이 어떤 모델에든 존재한다는 것이 증명될 수 있다면, 그들의 사용에 대한 윤리는 의심스러울 것이다.
2018년 옥스퍼드대 심포지엄 등 애매한 부분을 해결하기 위한 조치가 취해지고 있는데, 이 분야의 전문가와 철학자들, 변호사들이 모여 새로운 기술로 윤리적 우려를 해소하기 위해 노력했다.[42] 마찬가지로 케이스 웨스턴 대학의 브레인스톰과 같은 프로젝트는 두뇌 오가노이드와 협력하는 연구소를 감시하여 향후 가이드라인과 법률이 구축될 수 있는 '철학적 틀의 구축'을 시작하려고 노력함으로써 현장의 진행상황을 관찰하는 것을 목표로 한다.[43] 또한 인간 SC에서 파생된 오르가노이드를 다른 동물 모델에 이식하는 과정에서 동물 모델의 '인문화'가 관심사로 제기되었다.[39]
참고 항목
참조
- ^ a b c d e f g h i j k Lancaster MA, Renner M, Martin CA, Wenzel D, Bicknell LS, Hurles ME, et al. (September 2013). "Cerebral organoids model human brain development and microcephaly". Nature. 501 (7467): 373–9. Bibcode:2013Natur.501..373L. doi:10.1038/nature12517. PMC 3817409. PMID 23995685.
- ^ a b Di Lullo, Elizabeth; Kriegstein, Arnold R. (2017-09-07). "The use of brain organoids to investigate neural development and disease". Nature Reviews Neuroscience. 18 (10): 573–584. doi:10.1038/nrn.2017.107. ISSN 1471-003X. PMC 5667942.
- ^ a b c d "Growing model brains: An embryonic idea". The Economist. 2013-08-31. Retrieved 2013-09-07.
- ^ a b Di Lullo E, Kriegstein AR (October 2017). "The use of brain organoids to investigate neural development and disease". Nature Reviews. Neuroscience. 18 (10): 573–584. doi:10.1038/nrn.2017.107. PMC 5667942. PMID 28878372.
Table 1: Protocols for brain organoid generation
- ^ a b c Purves D, Augustine GJ, Fitzpatrick D, Hall WC, LaMantia AS, White LE, eds. (2007). Neuroscience (4th ed.). New York: W. H. Freeman. ISBN 978-0-87893-697-7.
- ^ a b c Chan WK, Griffiths R, Price DJ, Mason JO (July 2020). "Cerebral organoids as tools to identify the developmental roots of autism". Molecular Autism. 11 (1): 58. doi:10.1186/s13229-020-00360-3. PMC 7359249. PMID 32660622.
- ^ a b c Vogel G (August 2013). "Neurodevelopment. Lab dishes up mini-brains". Science. 341 (6149): 946–7. doi:10.1126/science.341.6149.946. PMID 23990534.
- ^ Reichardt A, Polchow B, Shakibaei M, Henrich W, Hetzer R, Lueders C (14 June 2013). "Large scale expansion of human umbilical cord cells in a rotating bed system bioreactor for cardiovascular tissue engineering applications". The Open Biomedical Engineering Journal. 7 (1): 50–61. doi:10.2174/1874120701307010050. PMC 3706833. PMID 23847691.
- ^ Church G. "The future of genetic codes and BRAIN codes". YouTube. NIHvcast. Retrieved 10 February 2017.
- ^ Bershteyn M, Kriegstein AR (September 2013). "Cerebral organoids in a dish: progress and prospects". Cell. 155 (1): 19–20. doi:10.1016/j.cell.2013.09.010. PMC 5127703. PMID 24074857.
- ^ "Human brain organoids assemble functionally integrated bilateral optic vesicles". Cell Stem Cell. 17 August 2021. doi:10.1016/j.stem.2021.07.010. ISSN 1934-5909.
- ^ Sakayori N, Kikkawa T, Osumi N (October 2012). "Reduced proliferation and excess astrogenesis of Pax6 heterozygous neural stem/progenitor cells". Neuroscience Research. 74 (2): 116–21. doi:10.1016/j.neures.2012.08.004. PMID 22944581.
- ^ Yirka, Bob. "A mass of human brain cells in a petri dish has been taught to play Pong". medicalxpress.com. Retrieved 16 January 2022.
- ^ "Human brain cells in a dish learn to play Pong faster than an AI". New Scientist. Retrieved 26 January 2022.
- ^ Kagan, Brett J.; Kitchen, Andy C.; Tran, Nhi T.; Parker, Bradyn J.; Bhat, Anjali; Rollo, Ben; Razi, Adeel; Friston, Karl J. (3 December 2021). "In vitro neurons learn and exhibit sentience when embodied in a simulated game-world": 2021.12.02.471005. doi:10.1101/2021.12.02.471005. S2CID 244883160.
{{cite journal}}: Cite 저널은 필요로 한다.journal=(도움말) - ^ a b Eiraku M, Takata N, Ishibashi H, Kawada M, Sakakura E, Okuda S, et al. (April 2011). "Self-organizing optic-cup morphogenesis in three-dimensional culture". Nature. 472 (7341): 51–6. Bibcode:2011Natur.472...51E. doi:10.1038/nature09941. PMID 21475194.
- ^ a b c d e f Chambers SM, Tchieu J, Studer L (October 2013). "Build-a-brain". Cell Stem Cell. 13 (4): 377–8. doi:10.1016/j.stem.2013.09.010. PMID 24094317.
- ^ a b c d e f g h Fischer J, Heide M, Huttner WB (2019-12-17). "Genetic Modification of Brain Organoids". Frontiers in Cellular Neuroscience. 13: 558. doi:10.3389/fncel.2019.00558. PMC 6928125. PMID 31920558.
- ^ a b c d e f g Poli D, Magliaro C, Ahluwalia A (2019). "Experimental and Computational Methods for the Study of Cerebral Organoids: A Review". Frontiers in Neuroscience. 13: 162. doi:10.3389/fnins.2019.00162. PMC 6411764. PMID 30890910.
- ^ a b c d e f g h i j Lee CT, Bendriem RM, Wu WW, Shen RF (August 2017). "3D brain Organoids derived from pluripotent stem cells: promising experimental models for brain development and neurodegenerative disorders". Journal of Biomedical Science. 24 (1): 59. doi:10.1186/s12929-017-0362-8. PMC 5563385. PMID 28822354.
- ^ a b c d e Sutarjono B (February 2019). "Can We Better Understand How Zika Leads to Microcephaly? A Systematic Review of the Effects of the Zika Virus on Human Brain Organoids". The Journal of Infectious Diseases. 219 (5): 734–745. doi:10.1093/infdis/jiy572. PMID 30256965.
- ^ Mansour AA, Gonçalves JT, Bloyd CW, Li H, Fernandes S, Quang D, et al. (June 2018). "An in vivo model of functional and vascularized human brain organoids". Nature Biotechnology. 36 (5): 432–441. doi:10.1038/nbt.4127. PMC 6331203. PMID 29658944.
- ^ Daviaud N, Friedel RH, Zou H (November 2018). "Vascularization and Engraftment of Transplanted Human Cerebral Organoids in Mouse Cortex". eNeuro. 5 (6): ENEURO.0219–18.2018. doi:10.1523/ENEURO.0219-18.2018. PMC 6243198. PMID 30460331.
- ^ Lelkes PI, Unsworth BR (2002). "Neuroectodermal Cell Culture: Endocrine Cells". In Atala A, Lanza R (eds.). Methods of tissue engineering (1st ed.). San Diego, CA: Academic Press. p. 381. ISBN 978-0-12-436636-7.
- ^ a b c d e Chen HI, Song H, Ming GL (January 2019). "Applications of Human Brain Organoids to Clinical Problems". Developmental Dynamics. 248 (1): 53–64. doi:10.1002/dvdy.24662. PMC 6312736. PMID 30091290.
- ^ a b c d e Kelava I, Lancaster MA (December 2016). "Dishing out mini-brains: Current progress and future prospects in brain organoid research". Developmental Biology. 420 (2): 199–209. doi:10.1016/j.ydbio.2016.06.037. PMC 5161139. PMID 27402594.
- ^ a b c d Amin, Neal D.; Paşca, Sergiu P. (October 2018). "Building Models of Brain Disorders with Three-Dimensional Organoids". Neuron. 100 (2): 389–405. doi:10.1016/j.neuron.2018.10.007. ISSN 0896-6273.
- ^ Qian, Xuyu; Nguyen, Ha Nam; Jacob, Fadi; Song, Hongjun; Ming, Guo-li (2017-03-15). "Using brain organoids to understand Zika virus-induced microcephaly". Development. 144 (6): 952–957. doi:10.1242/dev.140707. ISSN 0950-1991. PMC 5358105. PMID 28292840.
- ^ Opitz JM, Holt MC (1990). "Microcephaly: general considerations and aids to nosology". Journal of Craniofacial Genetics and Developmental Biology. 10 (2): 175–204. PMID 2211965.
- ^ Gonzalez C, Armijo E, Bravo-Alegria J, Becerra-Calixto A, Mays CE, Soto C (December 2018). "Modeling amyloid beta and tau pathology in human cerebral organoids". Molecular Psychiatry. 23 (12): 2363–2374. doi:10.1038/s41380-018-0229-8. PMC 6594704. PMID 30171212.
- ^ Swerdlow RH (September 2007). "Pathogenesis of Alzheimer's disease". Clinical Interventions in Aging. 2 (3): 347–59. PMC 2685260. PMID 18044185.
- ^ Laurijssens B, Aujard F, Rahman A (September 2013). "Animal models of Alzheimer's disease and drug development". Drug Discovery Today: Technologies. 10 (3): e319-27. doi:10.1016/j.ddtec.2012.04.001. PMID 24050129.
- ^ a b c d "Drug discovery in psychopharmacology: from 2D models to cerebral organoids". Dialogues in Clinical Neuroscience. doi:10.31887/dcns.2019.21.2/jladewig. PMC 6787544. PMID 31636494. Retrieved 2020-10-04.
- ^ Wang H (2018-06-08). "Modeling Neurological Diseases With Human Brain Organoids". Frontiers in Synaptic Neuroscience. 10: 15. doi:10.3389/fnsyn.2018.00015. PMC 6002496. PMID 29937727.
- ^ Rubenstein JL (April 2010). "Three hypotheses for developmental defects that may underlie some forms of autism spectrum disorder". Current Opinion in Neurology. 23 (2): 118–23. doi:10.1097/WCO.0b013e328336eb13. PMID 20087182.
- ^ a b Forsberg SL, Ilieva M, Maria Michel T (January 2018). "Epigenetics and cerebral organoids: promising directions in autism spectrum disorders". Translational Psychiatry. 8 (1): 14. doi:10.1038/s41398-017-0062-x. PMC 5802583. PMID 29317608.
- ^ Pașca AM, Park JY, Shin HW, Qi Q, Revah O, Krasnoff R, et al. (May 2019). "Human 3D cellular model of hypoxic brain injury of prematurity". Nature Medicine. 25 (5): 784–791. doi:10.1038/s41591-019-0436-0. PMC 7020938. PMID 31061540.
- ^ Daviaud N, Chevalier C, Friedel RH, Zou H (2019). "Distinct Vulnerability and Resilience of Human Neuroprogenitor Subtypes in Cerebral Organoid Model of Prenatal Hypoxic Injury". Frontiers in Cellular Neuroscience. 13: 336. doi:10.3389/fncel.2019.00336. PMC 6682705. PMID 31417360.
- ^ a b Chen HI, Wolf JA, Blue R, Song MM, Moreno JD, Ming GL, Song H (October 2019). "Transplantation of Human Brain Organoids: Revisiting the Science and Ethics of Brain Chimeras". Cell Stem Cell. 25 (4): 462–472. doi:10.1016/j.stem.2019.09.002. PMC 7180006. PMID 31585092.
- ^ Lavazza A, Massimini M (September 2018). "Cerebral organoids: ethical issues and consciousness assessment". Journal of Medical Ethics. 44 (9): 606–610. doi:10.1136/medethics-2017-104555. PMID 29491041.
- ^ Quadrato G, Nguyen T, Macosko EZ, Sherwood JL, Min Yang S, Berger DR, et al. (May 2017). "Cell diversity and network dynamics in photosensitive human brain organoids". Nature. 545 (7652): 48–53. Bibcode:2017Natur.545...48Q. doi:10.1038/nature22047. PMC 5659341. PMID 28445462.
- ^ "Human Brain Organoids: the Science, the Ethics". International Neuroethics Society. June 2018.
- ^ Gogol A (October 2018). "A human brain model in a petri dish?". EurekAlert!.