아미노레불린산신타아제
Aminolevulinic acid synthase| 5-올레불산 싱타아제 | |||||||||
|---|---|---|---|---|---|---|---|---|---|
 아미노레불린산신타아제디머, 로도박터캡슐라투스 | |||||||||
| 식별자 | |||||||||
| EC 번호 | 2.3.1.37 | ||||||||
| CAS 번호. | 9037-14-3 | ||||||||
| 데이터베이스 | |||||||||
| 인텐츠 | IntEnz 뷰 | ||||||||
| 브렌다 | 브렌다 입력 | ||||||||
| 엑스퍼시 | 나이스자이메 뷰 | ||||||||
| 케그 | KEG 입력 | ||||||||
| 메타사이크 | 대사통로 | ||||||||
| 프리암 | 프로필 | ||||||||
| PDB 구조 | RCSB PDB PDBe PDBsum | ||||||||
| |||||||||
Aminolevulinic acid synthase (ALA synthase, ALAS, or delta-aminolevulinic acid synthase) is an enzyme (EC 2.3.1.37) that catalyzes the synthesis of δ-aminolevulinic acid (ALA) the first common precursor in the biosynthesis of all tetrapyrroles such as hemes, cobalamins and chlorophylls.[1]반응은 다음과 같다.
- 숙시닐-CoA + 글리신 Δ-aminolevulinic acid + CoA + COA2 + CO
이 효소는 모든 비식물 진핵생물 및 프로테오박테리아의 α-급으로 발현되며, 그것이 촉매하는 반응을 ALA 형성을 위한 셰민 경로라고 부르기도 한다.[2]다른 유기체들은 C5 경로로 알려진 세 가지 효소 경로를 통해 ALA를 생성한다.ALA는 글리신과 숙시닐-CoA의 응결을 통해 합성된다.인간에서 ALA 싱타아제의 전사는 철분이 없을 때 포피린 중간체가 축적되는 것을 방지하기 위해 Fe-binding2+ 원소의 존재에 의해 엄격하게 제어된다.체내에는 두 가지 형태의 ALA 싱타제가 있다.한 형태는 적혈구 전구세포(ALAS2)로 표현되는 반면, 다른 형태(ALAS1)는 전신으로 보편적으로 표현된다.적혈구 형태는 x번 염색체의 유전자에 의해 코딩되는 반면, 다른 형태는 3번 염색체의 유전자에 의해 코딩된다.
X연계 사이더블라스틱 빈혈은 X염색체의 ALA 신타아제 유전자의 돌연변이에 의해 발생하는 반면 다른 유전자의 돌연변이에 의해 발생하는 질병은 없는 것으로 알려져 있다.에리스로이드 특정 ALA 신타아제 유전자의 함수 돌연변이가 증가하면서 X연계 도미노산 프로토폴포피리아로 알려진 이전에 알려지지 않았던 형태의 포르피리아를 유발하는 것으로 최근 밝혀졌다.
효소구조 및 특성
PLP 의존 효소는 아미노산을 다른 자원으로 변형시키는 데 필요하기 때문에 널리 퍼져 있다.[1]ARSA는 유사한 크기의 서브 유닛을 가진 호모디머로 아미노산 사이드 체인인 아르기닌, 트레오닌, 라이신 등으로 구성된 활성 부위가 서브유니티 인터페이스에 존재한다.[1]R. spheroids에서 추출했을 때 단백질은 1600배, 무게는 약 8만 달톤이다.[3]효소 활성은 효소의 원천에 따라 다르다.[3]
반응 메커니즘
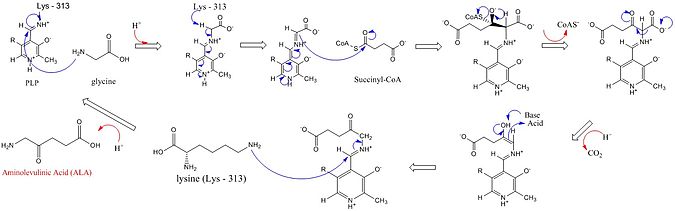
ARSA의 활성 사이트는 세 가지 핵심 아미노산 사이드 체인을 활용한다: Arg-85와 Thr-430 그리고 Lys-313.비록 이 세 개의 아미노산이 이러한 반응이 진행될 수 있도록 확인되었지만, 이 합성에서의 역할이 아래 이미지에 자세히 설명되어 있는 공동 인자 피리독살 5'-인산염(PLP)을 추가하지 않고서는 비활성일 것이다.반응이 시작되기 전에 PLP 공actor는 리신 사이드 체인에 결합하여 글리신 기질에 의한 공격을 촉진하는 쉬프 기지를 형성한다.[4][5][6][7]라이신은 이 메커니즘 동안 일반적인 기지 역할을 한다.[1][8]상세 반응 메커니즘에서 첨가되는 하이드로늄 원자는 ALA 합성을 용이하게 하기 위해 수소 결합을 제공하는 다양한 잔류물에서 나온다.[1]ALA 싱타아제는 보형물 그룹 피리독살 인산염(비타민 b6 파생물질)을 통해 글리신에서 카르복실 그룹을, 숙시닐-CoA에서 CoA를 제거해 아미노가 분자 내 네 번째 탄소 원자에 있기 때문에 Δ-아미노레불린산(dALA)을 형성한다.이 반응 메커니즘은 글리신이 초기에 보존도가 높은 활성 사이트 리신에 의해 감압되어 숙시닐-CoA와 결로 및 CoA 상실로 이어지기 때문에 PLP 공actor를 사용하는 다른 효소에 비해 특히 독특하다.활성 사이트 히스티딘에 의한 중간 카보닐 그룹의 양성화는 카복실 그룹의 상실을 초래한다.마지막 중간은 마침내 ALA를 생산하기 위해 재방송된다.효소와의 ALA의 분리는 효소 반응의 속도 제한 단계로 효소의 느린 순응적 변화에 의존하는 것으로 나타났다.피리독살 인산염의 기능은 전기생성 피리디늄 고리를 전자 싱크대로 활용해 수소 제거를 용이하게 하는 것이다.
생물학적 시스템에서 이 효소의 위치는 그것이 받을 수 있는 피드백을 나타낸다.ALA 싱타아제는 박테리아, 효모, 조류 및 포유류 간, 혈액 세포, 골수에서 발견되었다.동물 세포에서 이 효소의 위치는 미토콘드리아 안에 있다.[3]효소는 수시닐-CoA의 근원 근처에 위치해 있고 헤메 경로의 끝은 헤메 생합성의 시작점과 끝점이 ALA 싱타아제 피드백 역할을 한다는 것을 나타낸다.[3]ALA 싱타아제는 또한 헤민과 포도당에 의해 억제된다.[9]
생물 함수
ALAS1과 ALAS2는 헤메 합성 과정의 첫 번째 단계를 촉진한다.그것은 되돌릴 수 없는 첫 번째 단계고 또한 요율 제한이다.이는 hemes 형성의 시작이 매우 의도적이며 다양한 피드백 영역의 대상이 된다는 것을 의미한다.예를 들어, 두 기질인 옥살로아세테이트와 글리신은 글리콜리시스, TCA 사이클과 같은 다른 필수 생물학적 과정에 의해 고도로 생산되고 활용된다.아래 이미지는 헤메 합성 경로와 ARAS가 수행하는 역할을 보여준다.
질병 관련성
아미노레불린산 신타아제 결핍은 그 과정의 첫 단계를 촉진시키는 일이기 때문에 헤메를 창조할 능력이 부족한 결과를 낳는다.이러한 결핍은 종종 다양한 질병을 일으킬 수 있는 유전적 돌연변이의 결과물이다.그러한 질병 중 하나는 골수에 적혈구가 나타나는 x-연계 시더블라스틱 빈혈이다.[10]이 질병은 특히 ARS2를 위해 암호화된 유전자의 돌연변이와 연관되어 있다.[10]
참조
- ^ a b c d e Hunter, Gregory A.; Ferreira, Gloria C. (November 2011). "Molecular enzymology of 5-Aminolevulinate synthase, the gatekeeper of heme biosynthesis". Biochimica et Biophysica Acta (BBA) - Proteins and Proteomics. 1814 (11): 1467–1473. doi:10.1016/j.bbapap.2010.12.015. PMC 3090494. PMID 21215825.
- ^ Shemin, David; Rittenberg, D (June 18, 1945). "The utilization of glycine for the synthesis of a porphyrin". Journal of Biological Chemistry. 159: 567–568.
- ^ a b c d Beale, S I (June 1978). "δ-Aminolevulinic Acid in Plants: Its Biosynthesis, Regulation, and Role in Plastid Development". Annual Review of Plant Physiology. 29 (1): 95–120. doi:10.1146/annurev.pp.29.060178.000523.
- ^ "ALA synthase". flipper e nuvola. Turin University. Retrieved 10 March 2016.
- ^ Shoolingin-Jordan, Peter M.; Al-Daihan, Sooad; Alexeev, Dmitriy; Baxter, Robert L.; Bottomley, Sylvia S.; Kahari, I.Donald; Roy, Ipsita; Sarwar, Muhammad; Sawyer, Lindsay; Wang, Shu-Fen (Apr 2003). "5-Aminolevulinic acid synthase: mechanism, mutations and medicine". Biochim Biophys Acta. 1647 (1–2): 361–6. doi:10.1016/s1570-9639(03)00095-5. PMID 12686158.
- ^ CHOI, H (July 2004). "Cloning, expression, and characterization of 5-aminolevulinic acid synthase from Rhodopseudomonas palustris KUGB306". FEMS Microbiology Letters. 236 (2): 175–181. doi:10.1016/j.femsle.2004.05.048. PMID 15251194.
- ^ Ferreira, Gloria C.; Neame, Peter J.; Dailey, Harry A. (November 1993). "Heme biosynthesis in mammalian systems: Evidence of a schiff base linkage between the pyridoxal 5′-phosphate cofactor and a lysine residue in 5-aminolevulinate synthase". Protein Science. 2 (11): 1959–1965. doi:10.1002/pro.5560021117. PMC 2142290. PMID 8268805.
- ^ Hunter, Gregory A.; Ferreira, Gloria C. (March 1999). "Lysine-313 of 5-Aminolevulinate Synthase Acts as a General Base during Formation of the Quinonoid Reaction Intermediates". Biochemistry. 38 (12): 3711–3718. doi:10.1021/bi982390w. PMID 10090759.
- ^ Doss M, Sixel-Dietrich F, Verspohl F (1985). ""Glucose effect" and rate limiting function of uroporphyrinogen synthase on porphyrin metabolism in hepatocyte culture: relationship with human acute hepatic porphyrias" (PDF). J Clin Chem Clin Biochem. 23 (9): 505–13. doi:10.1515/cclm.1985.23.9.505. PMID 4067519.
- ^ a b Ajioka, Richard S.; Phillips, John D.; Kushner, James P. (July 2006). "Biosynthesis of heme in mammals". Biochimica et Biophysica Acta (BBA) - Molecular Cell Research. 1763 (7): 723–736. doi:10.1016/j.bbamcr.2006.05.005. PMID 16839620.
외부 링크
- NIH
- Abu-Farha M, Niles J, Willmore W (2005). "Erythroid-specific 5-aminolevulinate synthase protein is stabilized by low oxygen and proteasomal inhibition". Biochem Cell Biol. 83 (5): 620–30. doi:10.1139/o05-045. PMID 16234850.
- Shemin, D; Rittenberg, D (1945). "The Utilization of Glycine for the Synthesis of a Porphyrin". J. Biol. Chem. 159: 567–8.
- 시데로블라스틱 아나미아스 -알라스-2 결함병