와커 프로세스
Wacker processWaker 공정 또는 Hoechst-Wacker 공정(같은 이름의 화학 회사의 이름에서 유래)은 팔라듐이 존재하는 상태에서 에틸렌이 아세트알데히드로 산화되는 것을 말합니다.II)[1] 촉매로서의 염화물.이 화학 반응은 유기팔라듐 화학이 산업 규모로 [2]적용된 최초의 균질 촉매 작용 중 하나였다.
역사
바커 반응은 Smidt [3][4][5]등에 의해 처음 보고되었다.
현재 Waker 공정으로 알려진 화학 공정의 개발은 Waker Chemie에서 [6]1956년에 시작되었습니다.당시 많은 공업용 화합물은 비싸고 환경 친화적인 기술인 탄화칼슘에서 유래한 아세틸렌에서 생산되었다.에소가 쾰른에 새로운 정유소를 건설하고 에틸렌이 더 저렴한 원료가 될 것이라는 인식과 함께 쾰른에 건설하면서 쾰른의 잠재적 용도를 조사하게 되었습니다.후속 연구 노력의 일환으로, 에틸렌 산화물을 찾기 위해 탄소에 대한 팔라듐보다 에틸렌과 산소의 반응이 예상외로 아세트알데히드(단순히 냄새에 기초함)의 형성에 대한 증거를 제시했습니다.이 에틸렌에서 아세트알데히드로의 변환에 대한 더 많은 연구를 통해 1957년 이종 [7]촉매를 이용한 기상 반응을 설명하는 특허가 나왔습니다.한편, Hoechst AG는 경쟁에 참가했고 특허 출원 후 Waker는 Aldehyde GmbH라고 불리는 파트너십을 맺어야 했다.이기종 프로세스는 촉매 불활성화로 인해 결국 실패하였고 1958년에 시범 공장이 가동된 수성 기반 균질 시스템으로 대체되었습니다.적극적인 촉매 용액에 대한 문제는 원자로 및 펌프의 건축 재료로 티타늄(산업용으로 새롭게 사용 가능)을 채택함으로써 해결되었습니다.생산 공장은 1960년에 가동되기 시작했다.
반응 메커니즘
공업용 웨커 공정의 반응 메커니즘(팔라듐을 통한 올레핀 산화)II) 염화물)은 수십 년 동안 상당한 관심을 받아왔다.그 메커니즘의 측면은 여전히 논의되고 있다.다음은 현대식 식에 대한 설명하겠습니다.
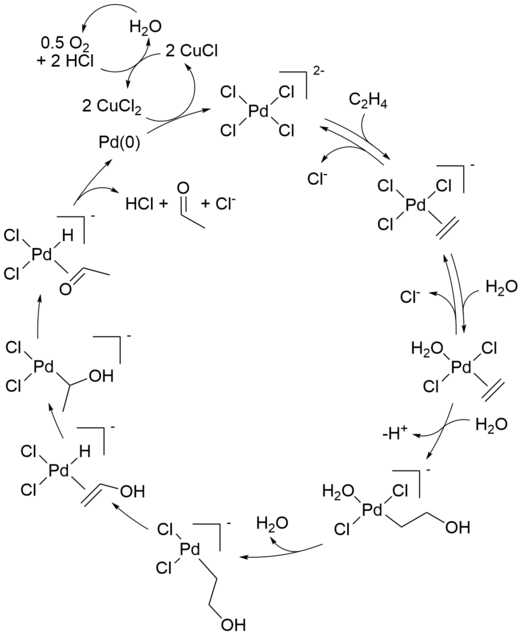
초기 화학량론적 반응은 [9][10]Phillips에 의해 처음 보고되었다.순반응은 다음과 같이 설명할 수도 있습니다.
- [PdCl4]2 − + CH24 + HO2 → CHCHO3 + PD + 2 HCl + 2 Cl−
이 변환 후 Pd(II) 촉매를 재생하는 반응이 발생합니다.
- Pd + 2 CuCl2 + 2 Cl → [PdCl4]2− + 2 CuCl
- 2 CuCl +1/22 O + 2 HCl → 2 CuCl2 + HO2
알켄과 산소만 소비됩니다.구리 미포함)II) 산화제로서의 염화물(Pd(0) 금속(최종 단계에서 Pd(II)의 베타 수소화물 제거 결과)이 침전되어 1사이클 후에 반응이 멈춘다.이 화학량론적 반응은 1894년에 발견되었다.그런 다음 공기, 순수 산소 또는 다른 여러 시약에서 생성된 CuCl-염산 혼합물을 다시 CuCl로2 산화시켜 사이클을 계속할 수 있습니다.
역사 기계학 연구
1960년대의 초기 기계론적 연구는 다음과 같은 몇 가지 핵심 [11][8]사항을 설명했다.
- 이 반응에서는 H/D 교환 효과가 나타나지 않습니다.물에서 CD를 사용한24 실험은 CDCDO를 생성하고3 CHHO를 DO에서23 CH로 실행합니다24.따라서 케토에놀 호변이성화(hautomerization)는 가능한 기계적 단계가 아니다.
- 완전 중수소화 반응물에 대한 운동 동위원소 효과(k /k = 1.07)는 무시할 수 있다.따라서 수소화물 전이는 레이트 결정되지 않는 것으로 추측된다.
- CHD와의222 유의한 경쟁 동위원소 효과(k /k = ~1.9)는 아세트알데히드 생성 전 속도 결정 단계를 의미한다.
- 고농도의 염화물 및 구리(II) 염화물은 새로운 제품인 클로로히드린의 형성을 선호한다.
웨커 프로세스에 대한 많은 역학적 연구는 히드록시팔라디션 단계인 C-O 결합의 형성을 위한 경로에 초점을 맞추고 있다.Henry는 배위 수산화물이 내부([12]합성) 경로인 에틸렌 배위자를 공격한다고 추론했다.나중에 Stille과 동료들에[13][14][15] 의한 입체화학적 연구는 유리 수산화물이 에틸렌 배위자를 공격하는 항첨가 경로를 지지한다.Stille의 실험 조건은 산업 공정 조건과 상당히 다릅니다.정상적인 산업용 웨커 조건(높은 염화물 및 높은 염화구리 농도 제외)을 사용한 다른 연구에서도 친핵성 공격이 항첨가 [16]반응이라고 추정하는 제품이 나왔다.
반응 메커니즘을 [17][18]조사하기 위해 표준 산업 조건(저염산염 농도)에서 동위원소 치환 알릴 알코올에 대한 역학 연구가 수행되었다.그 결과 친핵성 공격은 느린 과정인 반면, 초기 입체화학적 연구를 설명하는 제안된 메커니즘은 친핵성 공격을 빠른 과정으로 가정했다.
후속 입체화학적 연구에 따르면 두 경로 모두 발생하며 염화물 [19][20]농도에 따라 달라지는 것으로 나타났다.그러나 알릴알코올은 이성화 반응에 민감할 수 있고, 표준 웨이커 과정이 아닌 이러한 반응으로부터 다른 입체 이성질체가 형성될 수 있기 때문에 이러한 연구 역시 논란이 되고 있다.
요약하면, 염화물 이온이 촉매를 포화시켜 내부 구조를 저해하기 때문에 염화물 반응 농도(< 1 mol/l, 산업 공정 조건)에서 합성 첨가가 발생하는 반면, 항첨가는 고염산염(> 3 mol/l) 반응 농도 하에서 발생하는 것으로 보인다.그러나, 이러한 경로 전환의 정확한 경로와 이유는 아직 알려지지 않았다.
웨커 프로세스 메커니즘을 더욱 복잡하게 만드는 것은 염화 구리의 역할에 대한 질문입니다.대부분의 이론은 구리가 올레핀 산화 메커니즘에서 역할을 하지 않는다고 가정했다.그러나 Stangl과 Jira의[21] 실험에서 클로로히드린 형성은 염화 구리 농도에 의존한다는 것이 밝혀졌다.호소카와와[22] 동료의 연구 결과, 염화 구리가 함유된 결정화 제품이 나왔으며, 올레핀 산화에 순수하지 않은 역할을 할 수 있음을 알 수 있었다.마지막으로, 구리 공동 촉매가 검출되지 않은 Comas-Vives 등의 초기 연구가 바람직한 경로였다.이 경로는 나중에 Anderson과 Sigman의 [24]무동 실험으로 확인되었다.구리가 없는 조건에서 양성자 의존성이 없는 다른 운동 속도 법칙이 발견되었으며, 이는 소량의 구리 공동 촉매도 이 화학에서 순수하지 않은 역할을 할 수 있다는 가능성을 나타낸다.이러한 작업은 Waker 프로세스 메커니즘의 그림을 복잡하게 만들지만, 누군가는 아마도 이것과 관련된 화학이 반응 조건에 민감할 수 있고, 여러 다른 반응 경로가 작용하고 있을 수 있다는 것을 추론해야 할 것이다.
웨커 공정의 또 다른 주요 단계는 산소에서 염화물로 수소를 이동시키고 C-O 이중 결합을 형성하는 것입니다.이 단계는 일반적으로 순환 4원 전이 상태에서 소위 β-수소화 제거를 통해 진행되는 것으로 생각된다.
실리코[25][26][27] 연구에서 이 반응 단계의 전이 상태는 바람직하지 않으며 대체 환원 제거 반응 메커니즘이 작용하고 있다고 주장한다.제안된 반응 단계는 촉매 역할을 하는 용액에서 물 분자의 도움을 받을 수 있습니다.
산업 공정
아세트알데히드 생산에는 1단계 공정과 2단계 공정의 두 가지 경로가 상용화된다.
1단계 프로세스
에텐과 산소는 현재 약 130 °C 및 400 [28]kPa의 반응탑에서 동시에 통과된다.촉매는 PdCl2 및 CuCl2 수용액입니다.아세트알데히드는 추출 증류 후 분별 증류를 통해 정제된다.물을 추출 증류함으로써 아세트알데히드(클로로메탄, 클로로에탄, 이산화탄소)보다 비등점이 낮은 빛의 끝을 제거하고 아세트알데히드,[28] 크로톤알데히드, 염화 아세트데히드 등의 물 및 고비등 부산물을 아세트알데히드와 함께 바닥에서 배출한다.촉매의 부식성 때문에 원자로는 내산성 세라믹 재료로 라이닝되어 있으며 튜브는 티타늄으로 되어 있다.
2단계 프로세스
2단계 공정에서는 반응과 산화가 관상형 원자로에서 분리된다.1단계 공정과 달리 산소 대신 공기를 사용할 수 있습니다.에틸렌은 105–110 °C 및 900–1000 [28]kPa에서 촉매와 함께 원자로를 통과한다.아세트알데히드를 포함한 촉매용액을 플래시 증류하여 분리한다.촉매는 공기를 산화매체로 하여 1000 kPa의 산화반응기에서 산화된다.산화 촉매 용액을 분리하여 원자로로 반송한다.공기 중의 산소는 완전히 소모되고 배기는 불활성 가스로 순환됩니다.아세트알데히드 – 수증기 혼합물을 반응열을 이용하여 아세트알데히드 60~90%로 사전 농축하여 배출수를 Flash Tower로 되돌려 촉매 농도를 유지한다.이어서 조아세트알데히드의 2단계 증류를 실시한다.제1단계에서는 클로로메탄, 클로로에탄, 이산화탄소 등의 저비등 물질을 분리한다.제2단계에서는 물과 염화아세탈데히드, 아세트산 등 고 끓는 부산물을 제거하고 아세트알데히드를 순수한 형태로 [28]머리 위에서 얻는다.촉매의 부식성으로 인해 촉매와 접촉하는 기기는 티타늄으로 라이닝됩니다.
1단계 공정과 2단계 공정 모두 아세트알데히드 수율은 [28]약 95%로 생산비용은 거의 동일하다.묽은 가스를 2단계 방식으로 사용하는 이점은 높은 투자 비용으로 균형을 이룬다.두 방법 모두 염화 탄화수소, 염화 아세탈데히드 및 아세트산을 부산물로 생산한다.일반적으로 방법의 선택은 원자재와 에너지 상황뿐만 아니라 합리적인 가격에 산소를 이용할 수 있는지에 따라 결정된다.일반적으로 에텐의 100개 부분은 다음을 제공합니다.
- 아세트알데히드 95부
- 1.9 부분 염소화 알데히드
- 1.1 미변환 에텐
- 0.8 parts 이산화탄소
- 0.7부 아세트산
- 0.1부 클로로메탄
- 0.1부 염화 에틸
- 0.3부 에탄, 메탄, 크로톤알데히드
기타 마이너 사이드 제품
쓰지와커 산화
Waker Process의 등장은 보다 복잡한 터미널 올레핀에 대한 반응의 효용성과 적용 가능성에 대한 많은 조사를 촉진시켰다.츠지와커의 산화는 팔라듐이다.II) 이러한 올레핀의 카르보닐 화합물로의 촉매 변환.클레멘트와 셀비츠는[29] 수용성 DMF를 용매로 사용하면 1-도데센을 2-도데카논으로 산화시킬 수 있다는 사실을 최초로 밝혀냈고, 이는 물에서 고차 올레핀의 불용성 문제를 해결했다.Fahey는[30] DMF 대신 3-메틸술폴란을 용매로 사용하면 3,3-Dimethylbut-1-ene의 산화 수율이 증가했다고 언급했다.Tsuji는[31] 2년 후 여러 관능기를 가진 말단 올레핀의 선택적 산화에 셀비츠 조건을 적용하여 복합 [32]기질 합성에 그 효용을 입증했다.반응의 추가적인 발전은 반응의 선택성에 대처하기 위한 다양한 촉매 시스템으로 이어졌으며, 또한 비수성 핵 친핵체에 의한 분자간 및 분자내 산화의 도입으로 이어졌다.
위치선택성
마르코프니코프 가산
Tsuji-Wacker 산화는 Waker 공정 조건 하에서 말단 올레핀을 해당하는 메틸케톤으로 산화시킨다.Waker 공정과 거의 동일하게 제안된 촉매 사이클[33](그림 1)은 PdCl과2 두 개의 염화 음이온을 PdCl로 복합화한4 후 물과 알켄에 대한 두 개의 염화 배위자 교환을 거쳐 Pd(Cl2)(HO2)(알켄) 복합체를 형성한다.다음으로 물 분자는 마르코프니코프 방식으로 외구 메커니즘을 통해 올레핀을 회귀적으로 공격하여 보다 열역학적으로 안정된 Pd(Cl2)(-CH-CHOH-R2) 착체를 형성한다.염화물 배위자를 3좌표 팔라듐 착체에 해리시킴으로써 β-수소화물 제거를 촉진하고, 그 후 1,2-수소 이동 삽입으로 Pd(Cl2)(-CHOR-CH3) 착체를 생성한다.이는 β-수소화물 제거를 통해 케톤을 방출하고 후속 환원 제거는 HCl, 물 및 팔라듐(0)을 생성한다.마지막으로 팔라듐(0)을 2당량의 Cu(II)Cl에2 의해2 PdCl로 재산화하고, 이를 O에 의해2 재산화시킬 수 있다.
말단 올레핀의 산화는 일반적으로 마르코프니코프 케톤 생성물을 제공하지만, 기질이 알데히드를 선호하는 경우(아래에서 논의됨) 마르코프 위치선택성을 시행하기 위해 다른 배위자를 사용할 수 있다.스파르테인(Sparteine)을 리간드로 사용하면 팔라듐 착체와 기질 간의 입체적 상호작용을 최소화하기 위해 말단 탄소에서의 뉴클레오팔라디케이션을 선호한다.[34]키녹스 결합 팔라듐 촉매는 기질에 지시기가 있을 때 케톤 형성에 유리하도록 사용된다(그림 2, B).[35]이러한 기질이 Pd(Quinox)에 결합하는 경우(OOtBu)의 배위 포화상태로 유도기의 결합을 방해하여 마르코프니코프 생성물을 생성한다.이 배위자의 효율은 또한 음이온성 TBHP가 옥사졸린에 결합하는 것을 선호하고 올레핀 좌표가 [36]퀴놀린에 결합하는 것을 선호하는 전자 특성에도 기인한다.
Anti-Markovnikov 첨가제
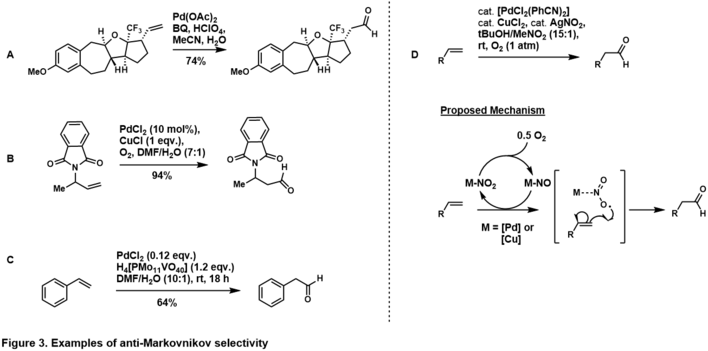
알데히드에 대한 반마르코브니코프 첨가 선택성은 [37]기판의 고유한 스테레오 일렉트로닉스를 이용하여 달성할 수 있습니다.homo-allylic(i.e. 그림 3, A)[38]고 알릴 자리에 터미널 olefin에(i.e. 그림 3, B)[39]그룹을 감독하는 배치는 다음과 같은은anti-Markovnikov 탄소에 물 공격은 m을 생성하는 데는 촉매 순환에서 감독한 그룹은 팔라듐은 복잡해 chelates에서 시사한anti-Markovnikov 알데히드 제품을 선호하는그 ore힘역학적으로 안정된 팔라다사이클.항마르코브니코프 선택성은 스티레닐 기질(그림 3, C)[40]에서도 관찰되며, 물이 항마르코브니코프를 공격한 후 아마도 γ-팔라듐-스티렌4 착체를 통해 관찰된다.Namboothiri,[41] Feringa [37]및 Muzart의 [42]리뷰에서 기판 제어, 올레핀의 안티마르코브니코프 쓰지-와커 산화의 더 많은 예가 제시되어 있다.
그루브스와 동료들은 팔라듐 질산염 시스템을 사용하여 스테레오 전자적으로 편향되지 않은 단자 올레핀의 반마르코브니코프 산화를 위한 길을 닦았다([43]그림 2, D).그의 시스템에서 말단 올레핀은 촉매-제어 경로를 통해 높은 선택성으로 알데히드로 산화되었다.이 메커니즘은 현재 조사 중이지만[41], 아질산염 래디칼이 말단 탄소에 첨가되어 열역학적으로 안정된 2차 래디칼을 생성한다는 증거가 있습니다.Grubbs는 이 방법론을 더 복잡하고 편향되지 않은 [44][45]올레핀으로 확장했습니다.
범위
산소핵친위체
친핵성 알코올을 가진 올레핀의 분자간 산화는 전형적으로 케탈을 생성하며, 친핵성 유전자로 카르본산을 가진 올레핀의 팔라듐 촉매 산화는 비닐산 또는 알리산 카르본산염을 처리한다.디올의 경우, 알케인과의 반응은 전형적으로 케탈을 생성하는 반면, 전자 인출기를 가진 올레핀의 반응은 아세탈을 [46]형성하는 경향이 있다.
카르본산 및 알코올을 공여체로 하는 디엔의 팔라듐 촉매 분자간 산화는 1,4 부가 생성물을 제공한다.시클로헥사디엔(그림 4, A)의 경우, Backvall은 제품의 입체화학적 결과가 LiCl [47]농도에 따라 다르다는 것을 발견했다.이 반응은 먼저 아세테이트를 친핵체로 하는 디엔의 항핵합체화를 통해 Pd(OAc)(벤조퀴논)(알릴) 복합체를 생성함으로써 진행된다.LiCl의 부재는 트랜스-1,4-adduct를 주는 트랜스 아세테이트 입체화학을 제공하기 위해 내부 구 환원 제거를 유도한다.LiCl의 존재는 높은 결합 친화성으로 인해 아세테이트를 염화물로 대체하고, 이는 팔라듐에 대한 외구 아세테이트 공격을 강제하며, 시스 아세테이트 입체 화학을 통해 cis-1,4-adduct를 제공한다.분자내 산화환화: 2-(2-시클로헥세닐)페놀은 대응하는 디히드로벤조프란으로 환화([48]그림4, B), 1-시클로헥사디엔 아세트산은 아세트산이 존재하는 상태에서 대응하는 락톤-아세테이트1,4 부가물(그림4, C)[49]로 환화되며, 시스성 제어된다.
질소 친핵체
올레핀의 산화적 아민은 일반적으로 아미드 또는 이미드와 함께 전도됩니다; 아민은 산성 매질에 의해 양성자화되거나 촉매 화학이 [46]일어나도록 하기 위해 금속 중심을 너무 단단하게 결합하는 것으로 생각됩니다.이러한 질소 친핵성 물질은 분자간 반응과 분자내 반응 모두에 적합한 것으로 확인되었으며, 몇 가지 예는 다음과 같다(그림 5, A,[50] B[51]).
레퍼런스
- ^ de에서 일부 번역:바커-베르파렌.
- ^ Elscenbroich, C. "Organmetallics" (2006) Wiley-VCH: 와인하임. ISBN978-3-527-29390-2
- ^ J. Smidt, W. Hafner, R. Jira, J. Sedlmeier, R. Sieber, Rütinger 및 H. Kojer, Angew.화학, 1959, 71, 176–182. doi:10.1002/ange.19590710503
- ^ W. Hafner, R. Jira, J. Sedlmeier, J. Smidt, Chem.1962년, 95년, 1575년-1581년
- ^ J. Smidt, W. Hafner, R. Jira, R. Sieber, J. Sedlmeier, A.사벨, 앙주화학 회사Ed. Engl., 1962, 1, 80~88
- ^ 에틸렌의 아세트알데히드 - 와인커 공정의 발견에 관한 회고전 Reinhard Jira Angew. 화학 회사 2009년 8월 48일 9034–9037 도이:10.1002/anie. 200903992
- ^ J. Smidt, W. Hafner, J. Sedlmeier, R. Jira, R. R. Rottinger(컨스퍼트 f. elktrochem).Ind.) DE 1 049845, 1959, Anm. 04.01.1957.
- ^ a b J. A. Keith, P. M. Henry (2009). "The Mechanism of the Wacker Reaction: A Tale of Two Hydroxypalladations". Angew. Chem. Int. Ed. 48 (48): 9038–9049. doi:10.1002/anie.200902194. PMID 19834921.
{{cite journal}}: CS1 maint: 작성자 파라미터 사용(링크) - ^ F. C. Phillips, Am.화학, J., 1894, 16, 255~277
- ^ F. C. Phillips, Z.Anorg. Chem., 1894, 6, 213–228.
- ^ 헨리, 패트릭 M.유기합성을 위한 유기팔라듐화학 핸드북; Negishi, E., Ed.; Wiley & Sons: New York, 2002; p 2119.ISBN 0-471-31506-0
- ^ P.M. 헨리, J.Am화학, Soc., 1964, 86, 3246–3250
- ^ 제임스, D.E., 스틸, J.K.J. 오르가노메트입니다 화학, 1976, 108, 401. doi:10.1021/ja00423a028
- ^ 스틸, J.K. 디바카루미, R.J. 오가노메트 화학, 1979, 169, 239;
- ^ 제임스, D.E., 하인즈, L.F. 스틸, J.K. J. Am. Chem. Soc., 1976, 98, 1806 doi:10.1021/ja00423a027
- ^ 벡발, J.E., 애커마크, B., 융그렌, S.O., J.Am. Chem. Soc., 1979, 101, 2411. doi:10.1021/ja00503a029
- ^ Zaw, K, Rautens, M. 그리고 Henry P.M.유기금속, 1985, 4, 1286–1296
- ^ 완 W.K., 조 K., 헨리 P.M.유기금속학, 1988, 7, 1677-1683
- ^ Francis, J.W., Henry, P.M. Organmetalics, 1991, 10, 3498.doi:10.1021/om00056a019
- ^ Francis, J.W., Henry, P.M. Organmetalics, 1992, 11, 2832.doi:10.1021/om00044a024
- ^ H. Stangl and R. Jira, 4면체 Lett., 1970, 11, 3589–3592
- ^ T. 호소카와, T. 노무라, S.-I.무라하시, J. 오르가노메트화학, 1998, 551, 387–389
- ^ Comas-Vives, A., 스털링, A., Ujaque, G., Lledos, A., Chem.Euro. J., 2010, 16, 8738-8747.doi:10.1002/chem. 200903522
- ^ 앤더슨, B.J., 키스, J.A. 그리고 시그만, M.S. J. Am.화학, Soc., 2010, 132, 11872-11874
- ^ J. A. 키스, J. 옥스가드, W. A. 고다드, III J. Am. 화학: Soc., 2006, 128, 3132 – 3133; doi: 10.1021/ja0533139
- ^ H. E. 호세이니, S. A. 베이라마바디, A.Morsali 및 M. R. Housaindokht, J. Mol. Structure. (THECOEM), 2010, 941, 138–143
- ^ P. L. Theofanis 및 W. A. Goddard, III 유기금속학, 2011, 30, 4941 – 4948; doi: 10.1021/om200542w
- ^ a b c d e Marc Eckert; Gerald Fleischmann; Reinhard Jira; Hermann M. Bolt; Klaus Golka. "Acetaldehyde". Ullmann's Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH. doi:10.1002/14356007.a01_031.pub2.
- ^ Clement, William H.; Selwitz, Charles M. (January 1964). "Improved Procedures for Converting Higher α-Olefins to Methyl Ketones with Palladium Chloride". The Journal of Organic Chemistry. 29 (1): 241–243. doi:10.1021/jo01024a517. ISSN 0022-3263.
- ^ Fahey, Darryl R.; Zeuch, Ernest A. (November 1974). "Aqueous sulfolane as solvent for rapid oxidation of higher .alpha.-olefins to ketones using palladium chloride". The Journal of Organic Chemistry. 39 (22): 3276–3277. doi:10.1021/jo00936a023. ISSN 0022-3263.
- ^ Tsuji, Jiro; Shimizu, Isao; Yamamoto, Keiji (August 1976). "Convenient general synthetic method for 1,4- and 1,5-diketones by palladium catalyzed oxidation of α-allyl and α-3-butenyl ketones". Tetrahedron Letters. 17 (34): 2975–2976. doi:10.1016/s0040-4039(01)85504-0. ISSN 0040-4039.
- ^ Tsuji, Jiro (1984). "Synthetic Applications of the Palladium-Catalyzed Oxidation of Olefins to Ketones". Synthesis. 1984 (5): 369–384. doi:10.1055/s-1984-30848. ISSN 0039-7881.
- ^ Kurti, Laszlo; Czako, Barbara (2005). Strategic Applications of named Reactions in Organic Synthesis. 525 B Street, Suite 1900, San Diego, California 92101-4495, USA: Elsevier Academic Press. p. 474. ISBN 978-0-12-429785-2.
{{cite book}}: CS1 유지보수: 위치(링크) - ^ Balija, Amy M.; Stowers, Kara J.; Schultz, Mitchell J.; Sigman, Matthew S. (March 2006). "Pd(II)-Catalyzed Conversion of Styrene Derivatives to Acetals: Impact of (−)-Sparteine on Regioselectivity". Organic Letters. 8 (6): 1121–1124. doi:10.1021/ol053110p. ISSN 1523-7060. PMID 16524283.
- ^ Michel, Brian W.; Camelio, Andrew M.; Cornell, Candace N.; Sigman, Matthew S. (2009-05-06). "A General and Efficient Catalyst System for a Wacker-Type Oxidation Using TBHP as the Terminal Oxidant: Application to Classically Challenging Substrates". Journal of the American Chemical Society. 131 (17): 6076–6077. doi:10.1021/ja901212h. ISSN 0002-7863. PMC 2763354. PMID 19364100.
- ^ Michel, Brian W.; Steffens, Laura D.; Sigman, Matthew S. (June 2011). "On the Mechanism of the Palladium-Catalyzed tert -Butylhydroperoxide-Mediated Wacker-Type Oxidation of Alkenes Using Quinoline-2-Oxazoline Ligands". Journal of the American Chemical Society. 133 (21): 8317–8325. doi:10.1021/ja2017043. ISSN 0002-7863. PMC 3113657. PMID 21553838.
- ^ a b Dong, Jia Jia; Browne, Wesley R.; Feringa, Ben L. (2014-11-03). "Palladium-Catalyzed anti-Markovnikov Oxidation of Terminal Alkenes". Angewandte Chemie International Edition. 54 (3): 734–744. doi:10.1002/anie.201404856. ISSN 1433-7851. PMID 25367376.
- ^ Miller, D. G.; Wayner, Danial D. M. (April 1990). "Improved method for the Wacker oxidation of cyclic and internal olefins". The Journal of Organic Chemistry. 55 (9): 2924–2927. doi:10.1021/jo00296a067. ISSN 0022-3263.
- ^ Stragies, Roland; Blechert, Siegfried (October 2000). "Enantioselective Synthesis of Tetraponerines by Pd- and Ru-Catalyzed Domino Reactions". Journal of the American Chemical Society. 122 (40): 9584–9591. doi:10.1021/ja001688i. ISSN 0002-7863.
- ^ Wright, Joseph A.; Gaunt, Matthew J.; Spencer, Jonathan B. (2006-01-11). "Novel Anti-Markovnikov Regioselectivity in the Wacker Reaction of Styrenes". Chemistry - A European Journal. 12 (3): 949–955. doi:10.1002/chem.200400644. ISSN 0947-6539. PMID 16144020.
- ^ a b Baiju, Thekke Veettil; Gravel, Edmond; Doris, Eric; Namboothiri, Irishi N.N. (September 2016). "Recent developments in Tsuji-Wacker oxidation". Tetrahedron Letters. 57 (36): 3993–4000. doi:10.1016/j.tetlet.2016.07.081. ISSN 0040-4039.
- ^ Muzart, Jacques (August 2007). "Aldehydes from Pd-catalysed oxidation of terminal olefins". Tetrahedron. 63 (32): 7505–7521. doi:10.1016/j.tet.2007.04.001. ISSN 0040-4020.
- ^ Wickens, Zachary K.; Morandi, Bill; Grubbs, Robert H. (2013-09-13). "Aldehyde-Selective Wacker-Type Oxidation of Unbiased Alkenes Enabled by a Nitrite Co-Catalyst" (PDF). Angewandte Chemie International Edition. 52 (43): 11257–11260. doi:10.1002/anie.201306756. ISSN 1433-7851. PMID 24039135.
- ^ Wickens, Zachary K.; Skakuj, Kacper; Morandi, Bill; Grubbs, Robert H. (2014-01-13). "Catalyst-Controlled Wacker-Type Oxidation: Facile Access to Functionalized Aldehydes" (PDF). Journal of the American Chemical Society. 136 (3): 890–893. doi:10.1021/ja411749k. ISSN 0002-7863. PMID 24410719.
- ^ Kim, Kelly E.; Li, Jiaming; Grubbs, Robert H.; Stoltz, Brian M. (2016-09-30). "Catalytic Anti-Markovnikov Transformations of Hindered Terminal Alkenes Enabled by Aldehyde-Selective Wacker-Type Oxidation" (PDF). Journal of the American Chemical Society. 138 (40): 13179–13182. doi:10.1021/jacs.6b08788. ISSN 0002-7863. PMID 27670712.
- ^ a b Hartwig, John F. (2010). Organotransition Metal Chemistry: From Bonding to Catalysis. USA: University Science Books. pp. 717–734. ISBN 978-1-891389-53-5.
- ^ Baeckvall, Jan E.; Bystroem, Styrbjoern E.; Nordberg, Ruth E. (November 1984). "Stereo- and regioselective palladium-catalyzed 1,4-diacetoxylation of 1,3-dienes". The Journal of Organic Chemistry. 49 (24): 4619–4631. doi:10.1021/jo00198a010. ISSN 0022-3263.
- ^ Hosokawa, Takahiro; Miyagi, Shyogo; Murahashi, Shunichi; Sonoda, Akio (July 1978). "Oxidative cyclization of 2-allylphenols by palladium(II) acetate. Changes in product distribution". The Journal of Organic Chemistry. 43 (14): 2752–2757. doi:10.1021/jo00408a004. ISSN 0022-3263.
- ^ Baeckvall, Jan E.; Granberg, Kenneth L.; Andersson, Pher G.; Gatti, Roberto; Gogoll, Adolf (September 1993). "Stereocontrolled lactonization reactions via palladium-catalyzed 1,4-addition to conjugated dienes". The Journal of Organic Chemistry. 58 (20): 5445–5451. doi:10.1021/jo00072a029. ISSN 0022-3263.
- ^ Timokhin, Vitaliy I.; Stahl, Shannon S. (December 2005). "Brønsted Base-Modulated Regioselectivity in the Aerobic Oxidative Amination of Styrene Catalyzed by Palladium". Journal of the American Chemical Society. 127 (50): 17888–17893. doi:10.1021/ja0562806. ISSN 0002-7863. PMID 16351120.
- ^ Larock, Richard C.; Hightower, Timothy R.; Hasvold, Lisa A.; Peterson, Karl P. (January 1996). "Palladium(II)-Catalyzed Cyclization of Olefinic Tosylamides". The Journal of Organic Chemistry. 61 (11): 3584–3585. doi:10.1021/jo952088i. ISSN 0022-3263. PMID 11667199.