헤일로리딘
Halohydrin유기 화학에서 헤일로리딘(Haloalaine 또는 β-halo 알코올)은 할로겐과 히드록실(hydroxyl)이 인접한 탄소 원자에 결합되는 기능 그룹이며, 그렇지 않으면 수소 또는 하이드로카르빌 그룹(예: 2-cloroethanol, 3-cloropropane-1,2-diol)만 포함한다.[1]이 용어는 포화 모티브에만 적용되며, 2-클로로페놀과 같은 화합물은 일반적으로 후일로 간주되지 않는다.일부 클로로 무수인(예: 프로필렌 클로로 무수인)의 메가톤은 폴리머의 전구체로 매년 생산된다.
헤일로 무수는 존재하는 할로겐에 따라 클로로 무수, 브로모 무수, 플루오로 무수 또는 이오도 무수로 분류할 수 있다.
합성
from alkenes
헤일로 무수는 일반적으로 알켄을 할로겐으로 처리하여 물이 있는 곳에서 조제한다.[2]반응은 할로겐 첨가 반응과 유사하게 전기영양 첨가제의 한 형태로, 새로 추가된 X와 OH 그룹은 트랜스 구성으로 남겨두고 안티 첨가 작업을 진행한다.에틸렌에서 에틸렌 클로로아딘으로의 전환을 위한 화학 방정식은 다음과 같다.
- HC2=CH2 + Cl2 + HO2 → H2(OH)C-CHCl2 + HCl
브롬화를 원할 때는 사이드 제품이 적게 생산되기 때문에 브롬보다 N-브로모수치니미드(NBS)를 선호할 수 있다.
에폭시데스로부터
할로리딘은 또한 에폭시드와 하이드로할산 또는 금속 할라이드의 반응으로부터 준비될 수 있다.[3]
이러한 반응은 두 가지 중요한 에폭시드인 에피클로로무딘과 프로필렌옥사이드에[citation needed] 클로로무딘 전구체의 생산을 위한 산업적 규모로 생성된다.한때 에틸렌산화물의 전구체로 2클로로에탄올이 대규모로 생산되기도 했으나, 지금은 에틸렌의 직접 산화에 의해 2클로로에탄올이 준비되고 있다.[4]
2-클로로산으로부터
2-클로로카복시산은 2-클로로알코올에 대해 리튬 알루미늄 하이드라이드를 사용하여 줄일 수 있다.필요한 2-클로로카복시산은 헬-볼하르트-젤린스키 할로겐화 등 다양한 방법으로 얻는다. 2-클로로프로피온산은 프로피오닐 염화물의 염소화에 이어 염화 2-클로로프로피오닐의 가수 분해에 의해 생산된다.항산화(S)-2-염소프로피온산 및 여러 가지 관련 화합물은 디아조트화를 통해 아미노산으로부터 조제할 수 있다.[5]
반응
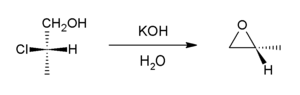
염기 후광 무수체가 있으면 내부 S2 반응을 통해 에폭시드를 형성한다N.산업적으로 기초는 수산화칼슘인 반면, 실험실에서는 수산화칼륨이 자주 사용된다.
이 반응은 에폭시드로부터의 형성 반응의 역행이며 윌리엄슨 에테르 합성의 변종이라고 볼 수 있다.전세계 프로필렌 산화물 공급의 대부분은 이 경로를 통해 발생한다.[6]
그러한 반응은 보다 복잡한 과정의 기초를 형성할 수 있는데, 예를 들어 에폭시드 형성은 다르젠스 반응의 핵심 단계 중 하나이다.
할로겐화 헤일로무딘
히드록실 그룹에 인접한 복수의 보석 할로겐을 함유하고 있는 2,2,2-트리클로로에탄올과 같은 화합물은 유사한 화학물질을 보유하고 있기 때문에 헤일로리딘(단, 엄격히 말하면 IUPAC 정의에 실패함)으로 간주될 수 있다.특히 그들은 또한 분자 내 사이클화를 거치며 이할로포시 그룹을 형성한다.이들 종은 모두 반응성이 높으며 총체적으로 유용하며, 조크-리브 반응, 바젤리니 반응, 코리-링크 반응의 기초를 형성한다.[7]
안전
다른 기능 그룹과 마찬가지로, 후광 무수체의 위험은 거의 무제한의 화합물의 일부를 형성할 수 있기 때문에 일반화하기가 어렵다. 각 구조는 서로 다른 약리학을 가지고 있다.일반적으로 단순한 저분자량 화합물은 알킬링제라는 이유로 독성 및 발암성(예: 2-클로로에탄올, 3-MCPD)인 경우가 많다.이 반응성은 예를 들어 항암제 미토브로니톨에 잘 사용될 수 있다.다수의 합성 코르티코스테로이드에는 플루오로리딘 모티브(트리암시놀론, 덱사메타손)가 있다.
미스노머스
그들의 다소 선정적인 이름에도 불구하고 에피클로로무딘과 유황 클로로무딘은 헤일로무딘이 아니다.
참고 항목
참조
- ^ IUPAC, 화학용어 종합편찬, 제2편.("금책")(1997년).온라인 수정 버전: (2006–) "할로리딘". doi:10.1351/골드북.H02727
- ^ William Reusch. "Addition Reactions of Alkenes". Virtual Textbook of Organic Chemistry. Archived from the original on 2012-12-14.
{{cite web}}:외부 링크 위치work= - ^ Bonini, Carlo; Righi, Giuliana (1994). "Regio- and Chemoselective Synthesis of Halohydrins by Cleavage of Oxiranes with Metal Halides". Synthesis. 1994 (3): 225–238. doi:10.1055/s-1994-25445.
- ^ Liu, Gordon Y. T.; Richey, W. Frank; Betso, Joanne E.; Hughes, Brian; Klapacz, Joanna; Lindner, Joerg (2014). "Chlorohydrins". Ullmann's Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH. doi:10.1002/14356007.a06_565.pub2.
- ^ Koppenhoefer, Bernhardt; Schurig, Volker (1988). "(S)-2-Chloroalkanoic Acids of High Enantiomeric Purity from (S)-2-Amino Acids: (S)-2-Chloropropanoic Acid". Organic Syntheses. 66: 151. doi:10.15227/orgsyn.066.0151.
- ^ 2002년 웨인하임 와일리VCH가 발표한 Uwe Wie Wie Wichen, Yörg Lindner "Propilen Oxide".doi:10.1002/14356007.a22_239 조항 온라인 게시 날짜: 2000년 6월 15일
- ^ Snowden, T.S. (28 February 2012). "Recent applications of gem-dichloroepoxide intermediates in synthesis". Arkivoc. 2012 (2): 24–40. doi:10.3998/ark.5550190.0013.204.