시스-트랜스 이성질체
Cis–trans isomerism

기하 이성질체라고도 알려진 시스-트랜스 이성질체는 분자 내의 특정 원자 배열을 설명합니다. 접두사 "cis"와 "trans"는 각각 라틴어에서 온 것으로 "의 이쪽"과 "의 다른 쪽"입니다.[1] 화학의 맥락에서 시스는 작용기(치환체)가 어떤 평면의 같은 면에 있다는 것을 나타내는 반면, 그들이 반대(횡)하는 면에 있다는 것을 전달합니다. Cis-트랜스 이성질체는 입체 이성질체, 즉 동일한 공식을 갖지만 3차원 공간에서 다른 방향에 있는 작용기를 갖는 분자 쌍입니다. 시스 및 트랜스 이성질체는 유기 분자 및 무기 배위 복합체에서 모두 발생합니다. 시스 및 트랜스 디스크립터는 대부분의 개방 사슬 단일 결합 구조와 같이 두 기하학적 형태가 쉽게 상호 변환되는 형태적 이성질체의 경우에 사용되지 않으며 대신 "syn" 및 "anti" 용어가 사용됩니다.
IUPAC에 따르면, "기하 이성질체"는 "시스-트랜스 이성질체"의 더 이상 쓸모없는 동의어입니다.[2]
시스트랜스 또는 기하학적 이성질체는 구성 이성질체의 한 유형으로 분류됩니다.[3]
유기화학
일반적으로 시스-트랜스 입체 이성질체는 이중 결합 또는 고리 구조를 포함합니다. 두 경우 모두 채권의 회전이 제한되거나 방지됩니다.[4] 치환기의 방향이 같은 경우에는 디아스테레오머를 시스라고 하고, 치환기의 방향이 반대인 경우에는 디아스테레오머를 트랜스라고 합니다. 시스-트랜스 이성질체를 나타내는 작은 탄화수소의 예는 but-2-ene입니다. 또 다른 예는 1,2-디클로로사이클로헥산입니다.
  |   |
| 트랜스-1,2- dich클로로사이클로헥산 | 시스-1,2- dich로시클로헥산 |
물리적 성질의 비교
Cis와 트랜스 이성질체는 뚜렷한 물리적 특성을 가지고 있습니다. 그들의 다양한 모양은 쌍극자 모멘트, 끓는점, 특히 녹는점에 영향을 미칩니다.
 |  |
| 시스-2-펜텐 | 트랜스-2-펜텐 |
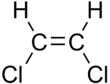 |  |
| cis-1,2-dichloroethene | 트랜스-1,2-dich클로로에텐 |
이러한 차이는 pent-2-ene과 같은 직선 사슬 알켄의 끓는점의 경우와 마찬가지로 매우 적을 수 있습니다. pent-2-ene은 시스 이성질체에서 37°C, 트랜스 이성질체에서 36°C입니다.[5] 1,2-디클로로에텐과 같이 극성 결합이 존재하면 시스 이성질체와 트랜스 이성질체의 차이는 더 커질 수 있습니다. 이 경우 시스 이성질체의 끓는점은 60.3℃이고, 트랜스 이성질체의 끓는점은 47.5℃입니다.[6] 시스 이성질체에서 두 개의 극성 C-Cl 결합 쌍극자 모멘트가 결합하여 전체 분자 쌍극자를 생성하여 런던 분산력을 더하고 끓는점을 높이는 분자 간 쌍극자-쌍극자 힘(또는 키솜 힘)이 있습니다. 반면, 트랜스 이성질체에서는 두 개의 C-Cl 결합 모멘트가 상쇄되고 분자가 순영 쌍극자 모멘트를 갖기 때문에 이러한 현상이 일어나지 않습니다(그러나 0이 아닌 사중극자 모멘트를 갖기는 합니다).
 |  |
| 시스부텐디오산 (말레산) | 트랜스부텐디오산 (fum산) |
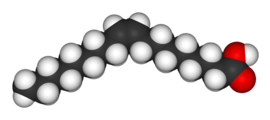 |  |
| 시스-9-옥타데센산 (올레산) | 트랜스-9-옥타데센산 (엘레이딘산) |
부텐디오산의 두 이성질체의 다른 성질은 종종 매우 다릅니다.
| 말레산 | 푸마르산 | |
|---|---|---|
| 색. | 하얀색 | 하얀색 |
| 녹는점, °C | 130 | 286 |
| 수용성, g/L | 788 | 7 |
| 산 해리 상수, pKa1 | 1.90 | 3.03 |
극성은 강한 분자간 힘이 끓는점을 높이면서 상대 끓는점을 결정하는 데 핵심입니다. 마찬가지로 대칭성은 분자의 극성을 변경하지 않더라도 고체 상태에서 더 나은 패킹을 허용하기 때문에 상대 용융점을 결정하는 데 핵심적입니다. 이것의 또 다른 예는 올레산과 엘라이딕산의 관계인데, 시스 이성질체인 올레산은 녹는점이 13.4°C로 상온에서 액체인 반면, 트랜스 이성질체인 엘라이딕산은 녹는점이 43°C로 훨씬 높습니다. 그리고 실온에서 고체입니다.
따라서 극성이 적고 대칭성이 높은 트랜스알켄은 끓는점이 낮고 녹는점이 높으며, 일반적으로 극성이 많고 대칭성이 낮은 시스알켄은 끓는점이 높고 녹는점이 낮습니다.
이중 결합의 결과인 기하 이성질체의 경우, 특히 두 치환기가 같은 경우에는 일반적인 경향이 유지됩니다. 이러한 경향은 시스 이성질체에 있는 치환기의 쌍극자가 합쳐져서 전체 분자 쌍극자를 생성하기 때문일 수 있습니다. 트랜스 이성질체에서 치환기의 쌍극자는 분자의 반대쪽에 있기 때문에 취소됩니다. 트랜스 이성질체는 또한 cis 대응물보다 밀도가 낮은 경향이 있습니다.[citation needed]
일반적인 경향으로, 트랜스알켄은 일반적으로 시스알켄보다 더 대칭적이기 때문에, 불활성 용매에 대한 용해도가 더 높고 용해도가 더 낮은 경향이 있습니다.[8]
NMR 분광법으로 측정된 인접 결합 상수(3JHH)는 트랜스(범위: 12~18Hz, 일반: 15Hz)의 경우 시스(범위: 0~12Hz, 일반: 8Hz) 이성질체보다 큽니다.[9]
안정성.
일반적으로 비순환 시스템의 경우 트랜스 이성질체가 시스 이성질체보다 더 안정적입니다. 이러한 차이는 시스 이성질체에 있는 치환기들의 불리한 입체 상호작용에 기인합니다. 따라서 트랜스 이성질체는 발열이 덜하여 열화학적 안정성이 더 높음을 나타냅니다.[8] Benson 열 형성 그룹 부가성 데이터 세트에서 시스 이성질체는 1.10 kcal/mol 안정성 패널티를 받습니다. 이 규칙에는 1,2-dif루오로에틸렌, 1,2-dif플루오로디아젠(FN= nf) 및 기타 할로겐 및 산소 substit 에틸렌과 같은 예외가 있습니다. 이 경우 시스 이성질체가 트랜스 이성질체보다 더 안정적입니다.[10] 이 현상을 시스 효과라고 합니다.[11]
E-Z 표기법

원칙적으로 치환기가 2개 이상인 알켄에는 시스-트랜스 표기법을 사용해서는 안 됩니다. 대신 절대 구성을 위해 CIP(Cahn-Ingold-Prelog) 우선 순위 규칙을 사용하는 대체자의 우선 순위를 기준으로 E-Z 표기법을 사용합니다. IUPAC 표준 명칭 E와 Z는 모든 경우에 명확하므로, 어떤 그룹이 시스 또는 트랜스로 식별되는지에 대한 혼란을 피하기 위해 트라이- 및 테트라-치환된 알켄에 특히 유용합니다.
Z(독일어 주삼멘에서 유래)는 "함께"를 의미합니다. E(독일 entgen에서 유래)는 "반대"라는 의미로 "반대"를 의미합니다. 즉, Z는 서로 높은 우선순위의 그룹 c를 가지며 E는 서로 높은 우선순위의 그룹 trans를 갖습니다. 분자 구성이 E 또는 Z로 지정되는지 여부는 CIP 규칙에 의해 결정됩니다. 원자 번호가 높을수록 우선 순위가 높습니다. 이중 결합에 있는 두 개의 원자 각각에 대해 각 치환기의 우선순위를 결정해야 합니다. 우선 순위가 높은 두 대체품이 같은 쪽에 있으면 배열이 Z이고 반대쪽에 있으면 배열이 E입니다.
시스-트랜스 및 E-Z 시스템은 알켄의 다른 그룹을 비교하기 때문에 Z가 시스에 해당하고 E가 트랜스에 해당한다는 것은 엄격하게 사실이 아닙니다. 예를 들어, 트랜스-2-클로로부트-2-엔(but-2-엔 골격에 있는 두 메틸기 C1과 C4는 서로 트랜스임)은 (Z)-2-클로로부트-2-엔(C1과 C4는 반대이기 때문에 염소와 C4는 함께 있습니다)입니다.
무기화학
Cis-트랜스 이성질체는 무기 화합물에서도 발생할 수 있습니다.
디아제네스
디아제네스(및 이와 관련된 디포스페네스)는 시스-트랜스 이성질체를 나타낼 수도 있습니다. 유기 화합물과 마찬가지로 시스 이성질체는 일반적으로 둘 중 더 반응성이 강하며, 알켄과 알킨을 알칸으로 환원시킬 수 있는 유일한 이성질체이지만, 트랜스 이성질체는 알켄을 환원시키기 위해 수소를 정렬시킬 수 없지만, 다른 이유로 시스 이성질체는 다르게 형성될 수 있습니다.
  |   |
| 트랜스 diaz렌 | 시스 diaz렌 |
코디네이션 콤플렉스
팔면체 또는 정사각형 평면 기하학이 있는 배위 복합체도 시스-트랜스 이성질체를 나타낼 수 있습니다.

예를 들어, 1893년 알프레드 베르너가 설명한 바와 같이 정사각형 평면 Pt(NH3)2Cl의2 이성질체는 두 개가 있습니다. 시스 이성질체로, 전체 이름은 시스-다이아민디클로로플라티눔(cis-diamine dichloroplatinum)이다.II)는 1969년 Barnett Rosenberg에 의해 항종양 활성을 갖는 것으로 나타났으며, 현재는 cisplatin이라는 짧은 이름으로 알려진 화학요법 약물입니다. 반면 트랜스 이성질체(트랜스플라틴)는 유용한 항암 활성이 없습니다. 각각의 이성질체는 트랜스 효과를 이용하여 합성하여 어떤 이성질체가 생성되는지 제어할 수 있습니다.
화학식 MXY의42 8면체 복합체에 대해서도 2개의 이성질체가 존재합니다. (여기서 M은 금속 원자이고, X와 Y는 서로 다른 두 종류의 리간드입니다.) 시스 이성질체에서 두 개의 Y 리간드는 90°로 서로 인접하며, 왼쪽의 시스-[Co(NH3)4Cl2]+의 녹색에 표시된 두 개의 염소 원자에 대해서도 마찬가지입니다. 오른쪽에 표시된 트랜스 이성질체에서 두 개의 Cl 원자는 중심 Co 원자의 반대쪽에 있습니다.
팔면체 MXY33 복합체에서 관련된 이성질체 유형은 서로 다른 수의 리간드가 시스 또는 트랜스인 얼굴-경락(또는 fac-mer) 이성질체입니다. 금속 카르보닐 화합물은 적외선 분광법을 사용하여 인자로 특성화할 수 있습니다.
참고 항목
참고문헌
- ^ 찰턴 T. Lewis, Charles Short, 라틴어 사전 (Clarendon Press, 1879) 시스 입문
- ^ IUPAC, 화학 용어 해설서, 2ded. ("Gold Book") (1997). 온라인 수정 버전: (2006–) "기하학 이성질체". doi:10.1351/goldbook.G02620
- ^ Hunt, Ian. "Stereochemistry". University of Calgary. Retrieved 3 November 2023.
- ^ Reusch, William (2010). "Stereoisomers Part I". Virtual Textbook of Organic Chemistry. Michigan State University. Retrieved 7 April 2015.
- ^ "Chemicalland values". Chemicalland21.com. Retrieved 2010-06-22.
- ^ CRC Handbook of Chemistry and Physics (60th ed.). 1979–1980. p. C-298.
- ^ Ouellette, Robert J.; Rawn, J. David (2015). "Alkenes and Alkynes". Principles of Organic Chemistry. pp. 95–132. doi:10.1016/B978-0-12-802444-7.00004-5. ISBN 978-0-12-802444-7.
- ^ a b March, Jerry (1985). Advanced Organic Chemistry, Reactions, Mechanisms and structure (3rd ed.). p. 111. ISBN 978-0-471-85472-2.
- ^ Williams, Dudley H.; Fleming, Ian (1989). "Table 3.27". Spectroscopic Methods in Organic Chemistry (4th rev. ed.). McGraw-Hill. ISBN 978-0-07-707212-4.
- ^ Bingham, Richard C. (1976). "The stereochemical consequences of electron delocalization in extended π systems. An interpretation of the cis effect exhibited by 1,2-disubstituted ethylenes and related phenomena". J. Am. Chem. Soc. 98 (2): 535–540. doi:10.1021/ja00418a036.
- ^ Craig, N. C.; Chen, A.; Suh, K. H.; Klee, S.; Mellau, G. C.; Winnewisser, B. P.; Winnewisser, M. (1997). "Contribution to the Study of the Gauche Effect. The Complete Structure of the Anti Rotamer of 1,2-Difluoroethane". J. Am. Chem. Soc. 119 (20): 4789. doi:10.1021/ja963819e.




