주사전자현미경
Scanning electron microscope주사전자현미경(SEM)은 전자집중빔으로 표면을 주사해 샘플의 이미지를 만드는 전자현미경의 일종이다.전자는 샘플의 원자와 상호작용하여 샘플의 표면 지형과 구성에 대한 정보를 포함하는 다양한 신호를 생성합니다.전자빔은 래스터 스캔 패턴으로 스캔되며 빔의 위치가 검출된 신호의 세기와 결합되어 이미지를 생성합니다.가장 일반적인 SEM 모드에서 전자빔에 의해 들뜬 원자에 의해 방출되는 2차 전자는 2차 전자 검출기(Everhart-)를 사용하여 검출된다.손리 검출기).검출할 수 있는 2차 전자의 수와 신호 강도는 무엇보다도 샘플 지형에 따라 달라집니다.일부 SEM은 1나노미터 이상의 분해능을 얻을 수 있습니다.
샘플은 기존 SEM의 고진공 상태 또는 가변 압력 또는 환경 SEM의 저진공 또는 습윤 상태, 특수 기기로 [1]광범위한 극저온 또는 고온에서 관찰된다.
역사
스캔 전자 현미경의 초기 역사에 대한 설명은 맥멀런에 [2][3]의해 제시되었다.맥스 놀은 전자빔 [4]스캐너를 사용하여 채널링 콘트라스트를 보여주는 50mm 물체-필드 폭의 사진을 만들었지만, 1937년[5] 매우 작은 래스터를 분쇄되고 미세하게 초점을 맞춘 전자빔으로 스캔하여 고해상도의 현미경을 발명한 사람은 만프레드 폰 아르덴이었다.아르덴은 투과전자현미경(TEM)의 분해능을 넘어 TEM의 실제 이미징에 고유한 색수차에 대한 실질적인 문제를 완화하기 위해 전자빔의 스캔을 적용했다.그는 또한 최초의 고해상도 [7]SEM 구축과 함께 [6]SEM의 다양한 검출 모드, 가능성 및 이론에 대해 논의했다.더 많은 작업이 Zworykin [8]그룹에 의해 보고되었고, 1950년대와 1960년대[9][10][11][12] 초에 Charles Oattley가 이끄는 캠브리지 그룹이 마침내 1965년에 "Steoroscan"이라는 첫 번째 상업용 악기를 마케팅하게 되었고, 이것은 DuPont에 전달되었습니다.
원칙과 능력
SEM이 이미지를 생성하기 위해 사용하는 신호는 샘플 내의 다양한 깊이에 있는 원자와 전자 빔의 상호작용에서 발생합니다.2차 전자(SE), 반사 또는 후방 산란 전자(BSE), 특징적인 X선 및 빛(CATODL) 및 흡수 전류(시방 전류) 및 투과 전자를 포함한 다양한 유형의 신호가 생성된다.2차 전자 검출기는 모든 SEM에서 표준 장비이지만 단일 기계에 다른 모든 가능한 [citation needed]신호에 대한 검출기가 있는 경우는 드물다.
2차 전자는 50eV 정도의 매우 낮은 에너지를 가지며, 이는 고체 물질에서 평균 자유 경로를 제한합니다.따라서 SE는 시료 표면의 상위 수 나노미터에서만 빠져나갈 수 있습니다.2차 전자로부터의 신호는 1차 전자 빔의 충격 지점에서 매우 국소적인 경향이 있으므로 1nm 미만의 분해능으로 샘플 표면의 이미지를 수집할 수 있습니다.후방 산란 전자(BSE)는 시료에서 탄성 산란에 의해 반사되는 빔 전자입니다.SE보다 에너지가 훨씬 높기 때문에 시료 내 깊은 곳에서 나타나기 때문에 BSE 영상의 해상도가 SE 영상보다 낮다.단, BSE 신호의 강도는 시료의 원자 번호(Z)와 강하게 관련되기 때문에 특성 X선에서 만들어진 스펙트럼과 함께 분석 SEM에 BSE가 자주 사용된다.BSE 이미지는 샘플 내 다른 요소의 분포에 대한 정보를 제공할 수 있지만 식별 정보는 제공할 수 없습니다.생물학적 시료와 같은 가벼운 원소로 주로 구성된 샘플에서 BSE 이미징은 직경 5nm 또는 10nm의 콜로이드 금면역라벨을 촬영할 수 있으며, 그렇지 않으면 [13]2차 전자상에서는 검출이 어렵거나 불가능합니다.전자빔이 시료에서 내부 셸 전자를 제거하여 고에너지 전자가 셸을 채우고 에너지를 방출할 때 특징적인 X선이 방출된다.이러한 특징적인 X선의 에너지 또는 파장은 에너지 분산형 X선 분광법 또는 파장 분산형 X선 분광법으로 측정할 수 있으며 표본 내 원소의 풍부함을 확인하고 측정하여 분포를 매핑하는 데 사용됩니다.
매우 좁은 전자빔으로 인해 SEM 마이크로그래프는 [14]시료의 표면구조를 이해하는 데 유용한 특징적인 3차원 외관을 갖는 큰 자계심도를 가진다.이것은 위에 나온 꽃가루의 현미경으로 알 수 있다.약 10배(강력한 핸드렌즈와 맞먹음)에서 최고 광현미경의 약 250배인 500,000배 이상까지 광범위한 배율이 가능합니다.
샘플 준비
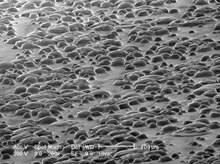
SEM 시료는 시료 단계에 들어갈 수 있을 정도로 작아야 하며 고진공 조건과 고에너지 전자빔에 견딜 수 있도록 전기전도율을 높이고 안정시키기 위해 특별한 준비가 필요할 수 있다.샘플은 일반적으로 도전성 접착제를 사용하여 검체 홀더 또는 스터브에 단단하게 부착됩니다.SEM은 반도체 웨이퍼 결함 분석에 광범위하게 활용되며 제조사들은 300mm 반도체 웨이퍼의 어떤 부분도 검사할 수 있는 기기를 만든다.대부분의 기기에는 해당 크기의 물체를 45°로 기울일 수 있는 챔버가 있으며 360° [citation needed]회전을 지속적으로 제공합니다.
비전도성 검체는 전자빔에 의해 스캔될 때, 특히 2차 전자 이미징 모드에서 스캔 결함 및 기타 영상 아티팩트를 일으킵니다.SEM에서의 기존 이미징의 경우 시료는 적어도 표면에서 전기적으로 전도성이 있어야 하며 정전하가 축적되지 않도록 전기적으로 접지되어야 한다.금속 물체는 세척 및 검체 스터브에 전도성 장착을 제외하고는 SEM을 위한 특별한 준비가 거의 필요하지 않습니다.비전도성 재료는 일반적으로 저진공 스패터 코팅 또는 고진공 증발로 시료에 퇴적된 전기 전도성 재료의 초박막 코팅으로 코팅됩니다.현재 시료 코팅에 사용되는 도전성 재료는 금, 금/팔라듐 합금, 백금, 이리듐, 텅스텐, 크롬, 오스뮴 [13]및 흑연이다.중금속으로 코팅하면 원자번호(Z)가 낮은 샘플의 신호/노이즈비가 증가할 수 있습니다.이러한 개선은 고Z 물질에 대한 2차 전자 방출이 [citation needed]증가하기 때문에 발생합니다.
일부 생물학적 샘플에 대한 코팅의 대안은 OTO 염색 방법(O-osmium tetroxide, T-thiocarbohydrazide, O-osmium)[15][16]을 사용하여 오스뮴 함침으로 재료의 부피 전도성을 높이는 것이다.
환경 SEM(ESEM) 또는 SEM 작동의 저전압 모드를 사용하여 코팅하지 않고 비전도성 시료를 촬영할 수 있습니다.ESEM 기기에서는 검체를 비교적 고압의 챔버에 배치하고 전자 광학 컬럼을 차동 펌핑하여 전자총의 진공 상태를[clarification needed] 적절히 낮춥니다.ESEM의 샘플 주위의 고압 영역은 전하를 중화시키고 2차 전자 [citation needed]신호를 증폭합니다.저전압 SEM은 일반적으로 낮은 가속전위에서도 높은 1차 전자휘도와 작은 스폿 크기를 생성할 수 있는 전계방출총(FEG)이 있는 계측기에서 전도됩니다.비전도성 시료의 충전을 방지하기 위해 입사 빔 전류가 0.3 – 4 kV의 [citation needed]가속 전압에서 가장 자주 충족되는 조건인 나가는 2차 및 후방 산란 전자 전류의 합과 동일하도록 작동 조건을 조정해야 한다.
후방 산란 전자로 촬상하거나 정량적인 X선 미세분석을 할 때 생체 및 재료 시료 양쪽에 거울처럼 연마된 수지 내 매립을 사용할 수 있다.
아래 설명된 환경 SEM에서는 주요 준비 기법이 필요하지 않지만, 일부 생물학적 시료는 고정의 이점을 얻을 수 있다.
생물학적 시료
SEM의 경우 시료실은 고진공 상태이므로 시료를 완전히 건조시켜야 한다.나무[17], 뼈, 깃털, 건조 곤충 또는 껍데기(달걀 껍질 포함)와 같은 단단하고 건조한 물질은 더 이상 치료하지 않고도 검사할 수 있지만, 살아있는 세포와 조직 및 전체, 부드러운 신체 유기체는 구조를 보존하고 안정시키기 위해 화학적 고정이 필요합니다.
고정은 보통 글루타르알데히드와 같은 완충 화학 고정제 용액에 배양하여 수행되며, 때로는 포름알데히드[18][19][20] 및 기타 [21]고정제와 조합하여 수행되며, 선택적으로 사산화 [18]오스뮴과 사후 고정화됩니다.그런 다음 고정된 조직이 탈수된다.공기 건조는 붕괴와 수축을 일으키기 때문에 일반적으로 세포 내의 물을 에탄올이나 아세톤과 같은 유기 용매로 대체하고 임계점 [22]건조로 이들 용매를 액체 이산화탄소 등의 과도 유체로 대체함으로써 달성됩니다.초임계 상태일 때 이산화탄소가 최종적으로 제거되므로 건조 중에 시료 내에 기액 계면이 존재하지 않습니다.
건조 시료는 보통 에폭시 수지나 전기 전도성 양면 접착 테이프 등의 접착제를 사용하여 시료 스터브에 장착하고, 현미경으로 검사하기 전에 금 또는 금/팔라듐 합금으로 스패터 코팅합니다.생체 내부 초미세 구조에 대한 정보가 이미징을 위해 노출될 경우 샘플을 (마이크로톰으로) 분할할 수 있습니다.
SEM에 저온 현미경 검사를 위한 콜드 스테이지가 설치되어 있는 경우에는 저온 주사 전자 현미경을 사용하여 저온 고정 [18]시료를 실시할 수 있다.동결고정 시료는 내부구조를 드러내기 위해 특수장치에서 진공상태에서 저온가공하여 스패터코팅한 후 [23]동결상태에서 SEM 저온단위로 이송할 수 있다.저온 주사 전자 현미경법(LT-SEM)은 얼음이나 지방과[24][25] [26]같은 온도에 민감한 물질의 이미징에도 적용할 수 있습니다.
동결-파쇄, 동결-에칭 또는 동결-브레이크(freeze-fracturing), 동결-에칭 또는 동결-브레이크(freeze-and-break)는 지질막 및 그 내장 단백질을 "페이스 온" 관점에서 검사하는 데 특히 유용한 조제 방법이다.제제방법은 지질양층 속에 포함된 단백질을 밝혀낸다.
자재
시료의 후방 산란 전자 이미징, 정량적 X선 분석 및 X선 매핑을 위해서는 표면을 연마하고 초평활 표면을 연마해야 하는 경우가 많습니다.WDS 또는 EDS 분석을 거친 시료에는 탄소 코팅이 되어 있는 경우가 많습니다.일반적으로 금속은 전도성이 있고 접지 경로를 제공하기 때문에 SEM에 이미징하기 전에 코팅되지 않습니다.
프랙토그래피는 광현미경이나 일반적으로 SEM으로 할 수 있는 골절된 표면에 대한 연구입니다.골절된 표면을 적절한 크기로 절단하여 유기성 잔류물을 청소한 후 SEM에서 볼 수 있도록 시료 홀더에 장착한다.
집적회로는 집속이온빔(FIB) 또는 SEM에서 보기 위한 다른 이온빔 밀링계기로 절단할 수 있다.첫 번째 경우 SEM은 FIB에 통합되어 프로세스 결과의 고해상도 이미징이 가능합니다.
금속, 지질 시료 및 집적회로도 모두 SEM에서 볼 수 있도록 화학적으로 연마할 수 있다.
무기 박막의 고배율 이미징을 위해서는 특별한 고해상도 코팅 기술이 필요합니다.
스캔 프로세스 및 이미지 형성
전형적인 SEM에서는 텅스텐 필라멘트 캐소드를 갖춘 전자총에서 전자빔이 열전사된다.텅스텐은 일반적으로 열전자총에 사용됩니다. 왜냐하면 텅스텐은 모든 금속 중 가장 높은 녹는점과 가장 낮은 증기압을 가지고 있기 때문에 전자 방출을 위해 전기적으로 가열될 수 있고 비용도 저렴하기 때문입니다.다른 유형의 전자방출체로는 표준 텅스텐 필라멘트 SEM에 사용할 수 있는 란타넘 헥사보라이드(LaB
6) 캐소드 또는 텅스텐 단결정 방사체를 사용하는 냉음극형 또는 열지원 숏키형일 수 있는 필드방출총(FEG)이 있다.산화 지르코늄으로 코팅된 결정들
일반적으로 0.2keV에서 40keV 범위의 에너지를 갖는 전자빔은 직경 약 0.4nm에서 5nm의 지점에 1~2개의 콘덴서 렌즈에 의해 초점이 맞춰집니다.빔은 전자 칼럼의 스캔 코일 쌍 또는 디플렉터 플레이트 쌍을 통과합니다(일반적으로 최종 렌즈). 빔은 빔을 x축과 y축으로 편향시켜 샘플 표면의 직사각형 영역에서 래스터 방식으로 스캔합니다.
1차 전자빔이 샘플과 상호작용할 때, 전자는 상호작용 부피로 알려진 시료의 눈물방울 모양의 부피 내에서 무작위 산란과 흡수를 반복하여 에너지를 잃게 되며, 이는 표면으로 100nm 미만에서 약 5µm까지 확장된다.상호작용 부피의 크기는 전자의 착륙 에너지, 시료의 원자 번호 및 시료의 밀도에 따라 달라진다.전자빔과 샘플 간의 에너지 교환은 탄성 산란에 의한 고에너지 전자 반사, 비탄성 산란에 의한 2차 전자 방출 및 전자파 방사 방출을 초래하며, 각각은 전문 검출기에 의해 검출될 수 있다.시료에 의해 흡수된 빔 전류를 검출하여 시료 전류의 분포를 영상화하는 데 사용할 수도 있다.컴퓨터 모니터(또는 빈티지 모델의 경우 음극선 튜브)에 밝기의 변화로 표시되는 신호를 증폭하기 위해 다양한 유형의 전자 증폭기가 사용됩니다.컴퓨터 비디오 메모리의 각 화소는 현미경에서 검체상의 빔의 위치와 동기화되므로, 그 결과 화상은 검체의 주사 영역으로부터 방출되는 신호의 강도의 분포 맵이 된다.오래된 현미경은 필름에 이미지를 담았지만, 대부분의 현대 기기는 디지털 이미지를 수집합니다.

확대
SEM의 배율은 약 10~[27]300,000회 범위에서 약 6차 배율로 제어할 수 있습니다.광전자현미경이나 투과전자현미경과 달리 SEM의 이미지 확대는 대물렌즈의 배율에 의한 기능이 아닙니다.SEM에는 콘덴서와 대물 렌즈가 있을 수 있지만, 그 기능은 빔을 한 지점에 초점을 맞추는 것이지 시료를 촬영하는 것이 아닙니다.전자총이 충분히 작은 직경의 빔을 발생시킬 수 있다면 SEM은 원칙적으로 콘덴서나 대물렌즈 없이도 작동할 수 있지만 매우 다용도하거나 매우 높은 분해능을 달성하지는 못할 수 있다.SEM에서는 주사 프로브 현미경과 마찬가지로 표시장치상의 래스터의 비율과 시료상의 래스터의 치수에 의해 배율이 이루어진다.표시화면의 크기가 일정하다고 가정하면 시료상의 래스터 크기를 줄임으로써 배율이 높아지며, 그 반대도 마찬가지이다.따라서 배율은 x, y 스캔 코일에 공급되는 전류 또는 x, y 디플렉터 플레이트에 공급되는 전압에 의해 제어되며, 렌즈 출력에 의해 제어되지 않습니다.
2차 전자 검출
가장 일반적인 이미징 모드는 빔 전자와의 비탄성 산란 상호작용에 의해 시료 원자의 전도 또는 원자가 대역에서 방출되는 저에너지(<50 eV) 2차 전자를 수집한다.낮은 에너지 때문에 이 전자들은 샘플 [14]표면보다 몇 나노미터 아래에서 발생합니다.전자는 에버하트에 의해 검출됩니다.Thornley 검출기,[28] 콜렉터-시크틸레이터-광전자 증배 시스템의 일종입니다.2차 전자는 먼저 약 +400V에서 전기적으로 바이어스된 그리드로 끌어당겨 수집되고, 그 후 약 +2,000V로 바이어스된 형광체 또는 섬광기로 가속된다.가속된 2차 전자는 이제 섬광기가 섬광(카토루미네센스)을 방출할 정도로 에너지가 충분하며, 이는 광파이프와 시료실 벽의 창을 통해 SEM 칼럼 외부의 광전자 증배관에 전달된다.광전자 증배관에 의해 증폭된 전기 신호 출력은 아날로그 비디오 디스플레이에서 보고 촬영할 수 있는 2차원 강도 분포로 표시되며 아날로그-디지털 변환 후 디지털 이미지로 표시 및 저장된다.이 프로세스는 래스터 스캔 프라이머리 빔에 의존합니다.신호의 밝기는 검출기에 도달하는 2차 전자의 수에 따라 달라집니다.빔이 표면에 수직으로 샘플에 들어가면 활성화된 영역은 빔의 축을 중심으로 균일하고 샘플 내에서 특정 수의 전자가 "탈출"됩니다.입사각이 증가함에 따라 상호작용 부피가 증가하고 빔 한쪽의 "회피" 거리가 감소하여 샘플에서 더 많은 2차 전자가 방출됩니다.따라서 가파른 표면과 가장자리는 평평한 표면보다 밝기 때문에 이미지가 잘 정의되고 입체적으로 나타납니다.0.5nm 미만의 2차 전자 이미지 분해능 신호를 사용할 수 있습니다.
후방 산란 전자 검출
후방산란전자(BSE)는 전자빔에서 발생하는 고에너지 전자로 구성되며, 시료 원자와의 탄성산란 상호작용에 의해 시료 상호작용 부피에서 반사되거나 후방산란된다.무거운 원소(원자번호가 높음)는 가벼운 원소(원자번호가 낮음)보다 더 강하게 전자를 후방 산란하기 때문에 이미지에서는 더 밝게 보이기 때문에 BSE는 다른 화학조성을 [14]가진 영역 간의 대비를 검출하기 위해 사용됩니다.에버하트-일반적으로 시료의 한쪽에 위치한 손리 검출기는 후방 산란 전자의 검출에 비효율적이다. 왜냐하면 그러한 전자는 검출기에 의해 경사진 고체 각도에서 거의 방출되지 않으며 양의 바이어스 검출 그리드는 더 높은 에너지 BSE를 끌어들이는 능력이 거의 없기 때문이다.전용 후방 산란 전자 검출기는 전자 빔과 동심원인 "도넛" 유형의 배열로 표본 위에 배치되어 고체 수집 각도를 극대화한다.BSE 검출기는 일반적으로 섬광기 또는 반도체 유형이다.검출기의 모든 부분이 빔을 중심으로 대칭적으로 전자를 수집하기 위해 사용되면 원자 번호 대비가 생성된다.단, 강력한 지형 대비는 비대칭 지향성 BSE 검출기를 사용하여 시료 위 한 쪽에서 후방 산란 전자를 수집함으로써 생성된다. 그 결과 대조도는 해당 측면에서 지형 조명으로 나타난다.반도체 검출기는 생성되는 콘트라스트의 유형과 그 방향을 제어하기 위해 전환하거나 전환할 수 있는 방사형 세그먼트로 만들 수 있습니다.
후방 산란 전자는 시료의 결정학적 구조를 결정하는 데 사용할 수 있는 전자 후방 산란 회절(EBSD) 이미지를 형성하기 위해서도 사용할 수 있다.
반도체 빔-주입 분석
SEM 프로브의 특성인 에너지 전자로 인해 반도체 물질의 광학 및 전자 특성을 조사하는데 독특하게 적합합니다.SEM 빔에서 나오는 고에너지 전자는 전하 캐리어를 반도체로 주입합니다.따라서 빔 전자는 원자가 대역에서 전도 대역으로 전자를 촉진하여 에너지를 손실하고 구멍을 남깁니다.
직접 밴드갭 재료에서 이러한 전자-홀 쌍의 재조합은 음극 발광으로 이어집니다. 샘플이 p-n 접합부에 존재하는 것과 같은 내부 전계를 포함할 경우 캐리어의 SEM 빔 주입에 의해 전자빔 유도 전류(EBIC)가 흐릅니다.음극 발광과 EBIC는 "빔 주입" 기술로 불리며, 특히 나노 규모의 특징과 결함을 연구하기 위해 반도체의 광전자 거동을 매우 강력하게 탐색합니다.
음극 발광

고에너지 전자에 의해 들뜬 원자가 바닥 상태로 돌아왔을 때 발생하는 빛의 방출인 음극 발광은 UV 유도 형광과 유사하며, 황화 아연이나 형광 염료와 같은 일부 물질은 두 가지 현상을 모두 보인다.지난 수십 년간 음극선 발광은 텔레비전 수상기와 컴퓨터 CRT 모니터에서 음극선 튜브의 내부 표면에서 나오는 빛으로 가장 흔하게 경험되었습니다.SEM에서 CL검출기는 시료에 의해 방출되는 모든 빛을 수집하거나 시료에 의해 방출되는 파장을 해석하여 발광 스펙트럼 또는 시료에 의해 방출되는 음극 발광 분포의 화상을 실제 색으로 표시할 수 있다.
X선 미세 분석
에너지 분산형 X선 분광법 또는 파장 분산형 X선 분광법을 갖춘 SEM에서도 전자와 시료의 상호작용에 의해 발생하는 특징적인 X선을 검출할 수 있다.X선 신호의 분석을 사용하여 분포를 매핑하고 샘플 내 원소의 농도를 추정할 수 있습니다.
SEM의 해결
SEM은 카메라가 아니며 검출기는 CCD 어레이나 필름처럼 연속적으로 이미지를 형성하지 않습니다.광학계와 달리 분해능은 회절 한계, 렌즈 또는 거울의 섬세도 또는 검출기 어레이 분해능에 의해 제한되지 않는다.초점 광학은 크고 거칠 수 있으며 SE 검출기는 주먹 크기이며 전류를 단순히 감지합니다.대신 SEM의 공간 분해능은 전자 반점의 크기에 따라 달라지며, 이는 다시 전자의 파장과 스캔 빔을 생성하는 전자 광학 시스템 모두에 따라 달라집니다.분해능은 전자빔과 상호작용하는 표본 물질의 부피인 상호작용 부피의 크기에 의해서도 제한된다.스폿 크기와 상호작용 부피는 모두 원자 사이의 거리에 비해 크기 때문에 SEM의 분해능은 투과전자현미경(TEM)으로 가능한 개별 원자를 촬영하기에 충분히 높지 않습니다.그러나 SEM은 검체의 비교적 넓은 영역을 촬영할 수 있는 기능, 벌크 재료(박막이나 박막뿐 아니라)를 촬영할 수 있는 기능, 검체의 구성 및 특성을 측정하는 데 사용할 수 있는 다양한 분석 모드 등 보완적인 이점이 있습니다.계측기에 따라 분해능은 1nm에서 20nm 사이일 수 있습니다.2009년 현재 세계에서 가장 높은 분해능의 재래식( can30 kV) SEM은 2차 전자 [29]검출기를 사용하여 0.4 nm의 지점 분해능에 도달할 수 있다.
환경 SEM
기존의 SEM에서는 기체 대기가 빠르게 확산되어 전자빔을 감쇠시키기 때문에 진공 상태에서 샘플을 촬영해야 했습니다.따라서 습윤 생물학적 샘플이나 오일 함유 암석 등 상당한 양의 증기를 생성하는 샘플은 건조되거나 저온 냉동되어야 합니다.접착제 건조 또는 합금 용융, 액체 수송, 화학 반응 및 고체 공기 가스 시스템과 같은 상전이를 수반하는 프로세스는 일반적으로 기존의 고진공 SEM에서는 관찰할 수 없습니다.Environmental SEM(ESEM; 환경 SEM)에서는 챔버는 공기에서 배출되지만 수증기는 포화압력 부근에 유지되며 잔류압력은 상대적으로 높은 상태로 유지됩니다.이를 통해 물이나 기타 휘발성 물질이 포함된 시료를 분석할 수 있습니다.ESEM을 통해 살아있는 곤충의 관찰이 [30]가능해졌다.
1980년대[31][32] 후반 ESEM의 첫 번째 상용 개발로 저압 가스 환경(예: 1~50 Torr 또는 0.1~6.7 kPa)과 높은 상대 습도(최대 100%)에서 표본을 관찰할 수 있었다.이는 수증기 존재 하에서 작동할 수 있는 2차 전자[33][34] 검출기의 개발과 전자 빔 경로에서 압력 제한 개구부를 사용하여 샘플 챔버에서 진공 영역(총과 렌즈 주변)을 분리함으로써 가능했다.최초의 상용 ESEM은 1988년 미국의 ElectroScan Corporation에 의해 생산되었습니다.ElectroScan은 1996년에 [35]Philips(나중에 FEI Company에 전자 광학 사업부를 매각)에 인수되었습니다.
ESEM은 탄소나 금으로 코팅할 필요가 없기 때문에 비금속 및 생물학적 재료에 특히 유용합니다.코팅되지 않은 플라스틱과 엘라스토머는 코팅되지 않은 생물학적 샘플과 마찬가지로 정기적으로 검사할 수 있습니다.코팅은 되돌리기 어려울 수 있고 샘플 표면에 작은 특징이 숨겨져 결과 값을 떨어뜨릴 수 있기 때문에 유용합니다.중금속 코팅의 경우 X선 분석이 어렵기 때문에 기존 SEM에서는 탄소 코팅이 일상적으로 사용되지만 ESEM에서는 코팅되지 않은 비전도성 시료에 대해 X선 미세 분석을 수행할 수 있습니다. 단, ESEM 아티팩트에 대한 일부 특정 정보는 X선 분석에 도입됩니다.ESEM은 형사소송 또는 민사소송에서 나온 독특한 샘플의 전자현미경 검사에 선호될 수 있으며, 법의학적 분석은 여러 다른 전문가에 의해 반복되어야 할 수 있다.ESEM 또는 다른 액상전자현미경법으로 [36]액체 중의 시료를 연구할 수 있다.
전송 SEM
SEM은 얇은 시료 [37]섹션 아래에 적절한 검출기를 삽입하는 것만으로 전송 모드에서도 사용할 수 있습니다.디텍터는 밝은 필드, 어두운 필드 및 중간 필드부터 높은 각도 고리형 다크 필드까지 세그먼트화된 디텍터에 사용할 수 있습니다.계측의 차이에도 불구하고, 이 기술은 여전히 일반적으로 스캔 투과 전자 현미경 검사(STEM)라고 불립니다.
SEM 색상
전자 현미경은 SEM이 픽셀당 단일 값을 생성하기 때문에 자연스럽게 컬러 이미지를 생성하지 않습니다. 이 값은 빔이 (x, y) 픽셀 위치를 목표로 할 때 스캔의 짧은 시간 동안 검출기에 의해 수신된 전자 수에 해당합니다.
이 단일 숫자는 보통 각 픽셀에 대해 회색 레벨로 나타나며 흑백 [38]이미지를 형성합니다.그러나 컬러 전자 현미경 이미지를 [39]얻기 위해 여러 가지 방법이 사용되었습니다.
단일 디텍터를 사용하여 잘못된 색상 표시
- 평면 합성 이미지(일반적으로 BSE):
색상을 얻는 가장 쉬운 방법은 색상 룩업 테이블을 사용하여 이 단일 숫자에 임의의 색상을 연관짓는 것입니다(즉, 각 회색 수준은 선택한 색으로 대체됩니다).이 방법을 false color라고 합니다.BSE 영상에서 [40]검체의 다양한 위상을 더 잘 구별하기 위해 거짓 색상이 수행될 수 있습니다.
- 질감이 있는 표면 이미지:
단순히 각 회색 레벨을 색으로 대체하는 대신, 경사 빔에 의해 관찰된 샘플을 사용하여 대략적인 지형 이미지를 만들 수 있습니다("단일 SEM 이미지에서 포토메트릭 3D 렌더링" 섹션 참조).그런 다음 3D 렌더링 알고리즘으로 이러한 지형을 처리하여 표면 텍스처를 보다 자연스럽게 렌더링할 수 있습니다.
SEM 이미지 컬러링
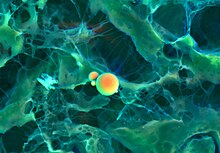
게시된 SEM 영상은 인공적으로 [40]색칠되는 경우가 많습니다.이는 미적 효과, 구조 명확화 또는 실제적인 외관을 표본에 추가하기 위해 수행될 수 있으며 일반적으로 [41]표본에 대한 정보를 추가하지 않는다.
색칠은 사진 편집 소프트웨어를 사용하여 수동으로 수행하거나 기능 감지 또는 객체 지향 [42]분할을 사용하여 전용 소프트웨어를 사용하여 반자동으로 수행할 수 있습니다.
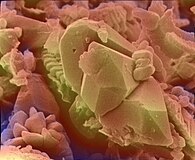
꽃가루를 스캔하는 Cobaea의 SEM 이미지
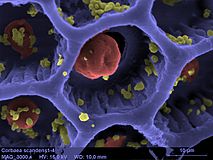
Tradescantia 꽃가루와 수술의 컬러 SEM 이미지
여러 전자 검출기를 사용하여 색채를 생성
일부 구성에서는 [43]여러 디텍터를 사용하여 픽셀당 더 많은 정보가 수집됩니다.
일반적인 예로서 2차 전자검출기와 후방 산란 전자검출기가 중첩되어 [44][45]각 검출기에 의해 포착된 각 화상에 색상이 할당되며 색상이 성분의 밀도와 관련된 복합색 화상의 최종 결과가 된다.이 방법은 밀도 의존형 색 SEM(DDC-SEM)으로 알려져 있습니다.DDC-SEM에 의해 생성된 마이크로그래프는 지형 정보를 유지하며, 이는 2차 전자 검출기에 의해 더 잘 포착되어 후방 산란 전자 [46][47]검출기에 의해 얻어진 밀도에 관한 정보와 결합됩니다.
생성된 광자에 기반한 분석 신호
시료에서 방출되는 광자의 에너지 측정은 분석 능력을 얻기 위한 일반적인 방법이다.예를 들어 (예를 들어) 지질 표본에서 전자 유도 발광의 강도와 스펙트럼을 분석하는 소자 분석 및 음극 발광 현미경(CL) 시스템에 사용되는 에너지 분산 X선 분광(EDS) 검출기가 그 예이다.이러한 검출기를 사용하는 SEM 시스템에서는 이러한 추가 신호를 컬러 코딩하고 단일 컬러 이미지로 중첩하여 표본의 다양한 구성 요소 분포의 차이를 명확하게 보고 비교할 수 있도록 하는 것이 일반적입니다.선택적으로 표준 2차 전자상을 1개 이상의 조성채널과 결합할 수 있으므로 시료의 구조 및 조성을 비교할 수 있다.이러한 이미지는 원본 신호 데이터의 완전한 무결성을 유지하면서 만들 수 있으며, 이는 어떠한 방식으로도 수정되지 않습니다.
SEM에서의 3D
SEM은 SPM과 달리 자연스럽게 3D 영상을 제공하지 않지만 다음과 같이 다른 방법으로 SEM을 사용하여 3D 데이터를 얻을 수 있습니다.
스테레오 쌍에서 3D SEM 재구성
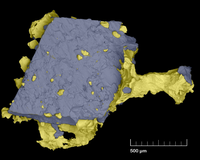
- 사진 측량법은 SEM [40]이미지에 3차원을 가져오는 가장 정확한 도량형 방법입니다.광도 측정법(다음 단락)과 달리, 사진 측량법은 삼각 측량법을 사용하여 절대 높이를 계산합니다.단점은 텍스처가 최소인 경우에만 작동하며 두 개의 다른 각도에서 두 개의 이미지를 획득해야 한다는 것입니다. 즉, 틸트 스테이지를 사용해야 합니다.(Photogrammetry는 동일한 쌍의 왼쪽 이미지와 오른쪽 이미지 사이의 각 픽셀에 대한 이동(또는 "비교")을 계산하는 소프트웨어 작업입니다.이러한 차이는 국지적인 높이를 반영한다.
4 사분원 검출기에서 "쉐이딩에서 형상"에 의한 광도 측정 3D SEM 재구성
이 방법에서는 일반적으로 4 사분원 BSE 검출기(한 제조업체, 3-세그먼트 검출기)를 사용합니다.현미경은 동일한 시료의 4개의 이미지를 동시에 생성하므로 시료를 기울일 필요가 없습니다.이 방법은 검체의 기울기가 합리적인 [40]범위 내에서 도량형 3D 치수를 제공한다.현재(2018년) 대부분의 SEM 제조업체는 3D 이미지를 실시간으로 [49]계산할 수 있는 독점 소프트웨어와 함께 이러한 내장 또는 옵션인 4사분원 BSE 디텍터를 제공합니다.
그 외의 어프로치에서는, 최적의 예측 알고리즘과 같이, 보다 고도의(때로는 GPU를 필요로 하는) 방법을 사용하고 있습니다.또한 컴퓨팅 파워에 대한 요구가 높기 때문에 훨씬 뛰어난 결과를[50] 얻을 수 있습니다.
모든 경우에서 이 접근방식은 기울기의 통합에 의해 작동하므로 수직 경사 및 돌출은 무시됩니다. 예를 들어, 전체 구가 평탄한 위에 있는 경우 위쪽 반구보다 조금 더 높게 나타나 구 정점의 고도가 잘못됩니다.이 효과의 중요도는 샘플에 대한 BSE 검출기의 각도에 따라 달라지지만, 이러한 검출기는 일반적으로 전자 빔 주위에 위치하기 때문에 이 효과는 매우 일반적이다.
단일 SEM 이미지에서 광도 측정 3D 렌더링
이 방법을 사용하려면 사선 저각 조명으로 얻은 SEM 영상이 필요합니다.그레이 레벨은 기울기로 해석되며, 기울기는 시료 지형을 복원하기 위해 통합됩니다.이 방법은 시각 강화와 물체의 형태와 위치 검출에 흥미롭지만, 사진 측량 [40]같은 다른 방법과는 달리 수직 높이는 보통 보정될 수 없습니다.
쉐이딩 알고리즘의 쉐이핑을 사용하여 이전부터의 SEM 3D 재구성을 실시.
다른 유형의 3D SEM 재구성
- 전자-재료 인터랙티브[51][52] 모델을 사용한 역재구성
- 단일 2D 파일을 사용하여 다중 해상도 재구성:고품질 3D 이미징은 다공질 미디어의 복잡성을 드러내는 궁극적인 솔루션이 될 수 있지만, 이를 입수하는 데는 비용과 시간이 많이 소요됩니다.한편, 고품질의 2D SEM 영상은 널리 이용 가능합니다.최근에는 3D 모델을 개발하기 위해 2D 영상을 직접 사용하는 새로운 3단계 멀티스케일 멀티 해상도 재구성 방법이 제시되고 있다.섀넌 엔트로피와 조건부 시뮬레이션을 기반으로 한 이 방법은 사용 가능한 대부분의 고정 재료에 사용할 수 있으며 몇 개의 얇은 [53][54][55]단면만 사용하여 다양한 확률적 3D 모델을 구축할 수 있습니다.
- 이온마모성SEM(IA-SEM)은 갈륨의 집속빔을 이용해 시료표면을 20나노미터씩 반복적으로 깎아내는 나노급 3차원 영상법이다.그런 다음 노출된 각 표면을 스캔하여 3D 영상을 [56][57]컴파일합니다.
3D SEM의 응용 프로그램
한 가지 가능한 적용은 얼음 결정의 거칠기를 측정하는 것입니다.이 방법은 가변 압력 환경 SEM과 SEM의 3D 기능을 결합하여 개별 얼음 결정면의 거칠기를 측정하고 이를 컴퓨터 모델로 변환하여 [58]모델에 대한 추가 통계 분석을 실행할 수 있습니다.기타 측정에는 프랙탈 치수, 금속 파단 표면 검사, 재료 특성, 부식 측정, 나노 스케일 치수 측정(단계 높이, 부피, 각도, 평탄도, 베어링 비율, 공평도 등)[citation needed]이 포함됩니다.
SEM은 또한 아연 이온과 지방산의 [59]복합체 형성과 같이 노화로 인한 그림의 표면 안정성에 대한 위협을 식별하기 위해 미술 보존가들에 의해 사용된다.법의학자들은 미술품 위조를 발견하기 위해 SEM을 사용한다.
SEM 이미지 갤러리
다음은 SEM을 사용하여 촬영한 이미지의 예입니다.
정상적인 혈액순환의 SEM 이미지.이것은 SEM 마이크로그래프의 일반적인 대상인 적혈구의 오래된 소음 마이크로그래프입니다.
고대 유리 조각에 안티몬이 풍부한 영역의 후방 산란 전자(BSE) 이미지.박물관은 귀중한 유물을 비파괴적인 방법으로 연구하기 위해 SEM을 사용합니다.
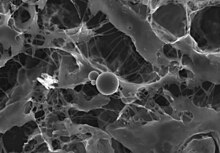
양파 조각의 안쪽 표면에서 나온 표피 세포.샤그린 같은 세포벽 아래에서 세포질에 떠 있는 핵과 작은 세포소기관들을 볼 수 있다.란타노이드 오염 샘플의 이 BSE 이미지는 사전 고정, 탈수, 스패터링 없이 촬영되었습니다.
잎 밑면에 있는 기공의 SEM 이미지.
「 」를 참조해 주세요.
- 전자 현미경 검사 응용 프로그램
- 전자 현미경 검사
- 에너지 분산형 X선 분광법
- 음극 발광 현미경
- 포렌식 엔지니어링
- 법의학
- 표면 분석 방법 목록
- 현미경 검사
- Turnip Town의 Tenny Ted (세계에서 가장 작은 책은 읽으려면 스캔 전자 현미경이 필요합니다.)
- 투과전자현미경법(TEM)
레퍼런스
- ^ Stokes, Debbie J. (2008). Principles and Practice of Variable Pressure Environmental Scanning Electron Microscopy (VP-ESEM). Chichester: John Wiley & Sons. ISBN 978-0470758748.
- ^ McMullan, D. (2006). "Scanning electron microscopy 1928–1965". Scanning. 17 (3): 175–185. doi:10.1002/sca.4950170309. PMC 2496789.
- ^ McMullan, D. (1988). "Von Ardenne and the scanning electron microscope". Proc Roy Microsc Soc. 23: 283–288.
- ^ Knoll, Max (1935). "Aufladepotentiel und Sekundäremission elektronenbestrahlter Körper". Zeitschrift für Technische Physik. 16: 467–475.
- ^ GB 511204, Manfred, von Ardenne, "전자현미경 개선", 1939-08-15 출판
- ^ von Ardenne, Manfred (1938). "Das Elektronen-Rastermikroskop. Theoretische Grundlagen". Zeitschrift für Physik (in German). 109 (9–10): 553–572. Bibcode:1938ZPhy..109..553V. doi:10.1007/BF01341584.
- ^ von Ardenne, Manfred (1938). "Das Elektronen-Rastermikroskop. Praktische Ausführung". Zeitschrift für Technische Physik (in German). 19: 407–416.
- ^ Zworykin VA, Hillier J, Snyder RL(1942) 주사 전자 현미경.ASTM Bull 117, 15-23
- ^ McMullan, D. (1953). "An improved scanning electron microscope for opaque specimens". Proceedings of the IEE - Part II: Power Engineering. 100 (75): 245–256. doi:10.1049/pi-2.1953.0095.
- ^ Oattley CW, Nixon WC, Pease RFW(1965) 스캔 전자 현미경 검사.Adv Electronics Phys 21, 181–247.
- ^ Smith KCA, Oatley, CW (1955). "The scanning electron microscope and its fields of application". British Journal of Applied Physics. 6 (11): 391–399. Bibcode:1955BJAP....6..391S. doi:10.1088/0508-3443/6/11/304.
{{cite journal}}: CS1 maint: 여러 이름: 작성자 목록(링크) - ^ Wells OC(1957) 스캐닝 전자 현미경의 구성과 섬유 연구에 대한 적용.케임브리지 대학 박사 학위 논문
- ^ a b Suzuki, E. (2002). "High-resolution scanning electron microscopy of immunogold-labelled cells by the use of thin plasma coating of osmium". Journal of Microscopy. 208 (3): 153–157. doi:10.1046/j.1365-2818.2002.01082.x. PMID 12460446.
- ^ a b c Goldstein, G. I.; Newbury, D. E.; Echlin, P.; Joy, D. C.; Fiori, C.; Lifshin, E. (1981). Scanning electron microscopy and x-ray microanalysis. New York: Plenum Press. ISBN 978-0-306-40768-0.
- ^ Seligman, Arnold M.; Wasserkrug, Hannah L.; Hanker, Jacob S. (1966). "A new staining method for enhancing contrast of lipid-containing membranes and droplets in osmium tetroxide-fixed tissue with osmiophilic thiocarbohydrazide (TCH)". Journal of Cell Biology. 30 (2): 424–432. doi:10.1083/jcb.30.2.424. PMC 2106998. PMID 4165523.
- ^ Malick, Linda E.; Wilson, Richard B.; Stetson, David (1975). "Modified Thiocarbohydrazide Procedure for Scanning Electron Microscopy: Routine use for Normal, Pathological, or Experimental Tissues". Biotechnic & Histochemistry. 50 (4): 265–269. doi:10.3109/10520297509117069. PMID 1103373.
- ^ Conrad, Cyler; Jones, Emily Lena; Newsome, Seth D.; Schwartz, Douglas W. (2016). "Bone isotopes, eggshell and turkey husbandry at Arroyo Hondo Pueblo". Journal of Archaeological Science: Reports. 10: 566–574. doi:10.1016/j.jasrep.2016.06.016.
- ^ a b c Jeffree, C. E.; Read, N. D. (1991). "Ambient- and Low-temperature scanning electron microscopy". In Hall, J. L.; Hawes, C. R. (eds.). Electron Microscopy of Plant Cells. London: Academic Press. pp. 313–413. ISBN 978-0-12-318880-9.
- ^ Karnovsky, M. J. (1965). "A formaldehyde-glutaraldehyde fixative of high osmolality for use in electron microscopy" (PDF). Journal of Cell Biology. 27 (2): 1A–149A. JSTOR 1604673.
- ^ Kiernan, J. A. (2000). "Formaldehyde, formalin, paraformaldehyde and glutaraldehyde: What they are and what they do". Microscopy Today. 2000 (1): 8–12. doi:10.1017/S1551929500057060.
- ^ Russell, S. D.; Daghlian, C. P. (1985). "Scanning electron microscopic observations on deembedded biological tissue sections: Comparison of different fixatives and embedding materials". Journal of Electron Microscopy Technique. 2 (5): 489–495. doi:10.1002/jemt.1060020511.
- ^ Chandler, Douglas E.; Roberson, Robert W. (2009). Bioimaging : current concepts in light and electron microscopy. Sudbury, Mass.: Jones and Bartlett Publishers. ISBN 9780763738747.
- ^ Faulkner, Christine; et al. (2008). "Peeking into Pit Fields: A Multiple Twinning Model of Secondary Plasmodesmata Formation in Tobacco". Plant Cell. 20 (6): 1504–18. doi:10.1105/tpc.107.056903. PMC 2483367. PMID 18667640.
- ^ Wergin, W. P.; Erbe, E. F. (1994). "Snow crystals: capturing snow flakes for observation with the low-temperature scanning electron microscope". Scanning. 16 (Suppl. IV): IV88.
- ^ Barnes, P. R. F.; Mulvaney, R.; Wolff, E. W.; Robinson, K. A. (2002). "A technique for the examination of polar ice using the scanning electron microscope". Journal of Microscopy. 205 (2): 118–124. doi:10.1046/j.0022-2720.2001.00981.x. PMID 11879426.
- ^ Hindmarsh, J. P.; Russell, A. B.; Chen, X. D. (2007). "Fundamentals of the spray freezing of foods—microstructure of frozen droplets". Journal of Food Engineering. 78 (1): 136–150. doi:10.1016/j.jfoodeng.2005.09.011.
- ^ "Ultra-high Resolution Scanning Electron Microscope SU9000".
- ^ Everhart, T. E.; Thornley, R. F. M. (1960). "Wide-band detector for micro-microampere low-energy electron currents" (PDF). Journal of Scientific Instruments. 37 (7): 246–248. Bibcode:1960JScI...37..246E. doi:10.1088/0950-7671/37/7/307.
- ^ 히타치, 세계 최고 해상도 FE-SEM 출시나노테크 2011년 5월 31일
- ^ Takaku, Yasuharu; Suzuki, Hiroshi; Ohta, Isao; Tsutsui, Takami; Matsumoto, Haruko; Shimomura, Masatsugu; Hariyama, Takahiko (7 March 2015). "A 'NanoSuit' surface shield successfully protects organisms in high vacuum: observations on living organisms in an FE-SEM". Proceedings of the Royal Society of London B: Biological Sciences. 282 (1802): 20142857. doi:10.1098/rspb.2014.2857. ISSN 0962-8452. PMC 4344158. PMID 25631998.
- ^ Danilatos, G. D. (1988). "Foundations of environmental scanning electron microscopy". Advances in Electronics and Electron Physics Volume 71. Advances in Electronics and Electron Physics. Vol. 71. pp. 109–250. doi:10.1016/S0065-2539(08)60902-6. ISBN 9780120146710.
- ^ 미국 특허 4823006, 다닐라토스, 제라시모스 D. 및 루이스, 조지 C., "환경 스캔 전자 현미경을 위한 통합 전자 광학/차동 펌프/이미징 신호 검출 시스템"은 1989년 4월 18일 발행되었다.
- ^ Danilatos, G. D. (1990). Theory of the Gaseous Detector Device in the ESEM. Advances in Electronics and Electron Physics. Vol. 78. pp. 1–102. doi:10.1016/S0065-2539(08)60388-1. ISBN 9780120146789.
- ^ 미국 특허 4785182, Mancuso, James F., Maxwell, William B. 및 Danilatos, Gerasimos D, 1988년 11월 15일 발행.
- ^ 전자현미경 1990년대 역사 sfc.fr
- ^ de Jonge, N.; Ross, F.M. (2011). "Electron microscopy of specimens in liquid". Nature Nanotechnology. 6 (8): 695–704. Bibcode:2003NatMa...2..532W. doi:10.1038/nmat944. PMID 12872162.
- ^ Klein, Tobias; Buhr, Egbert; Frase, Carl G. (2012). TSEM: A Review of Scanning Electron Microscopy in Transmission Mode and Its Applications. Advances in Imaging and Electron Physics. Vol. 171. pp. 297–356. doi:10.1016/B978-0-12-394297-5.00006-4. ISBN 9780123942975.
- ^ Burgess, Jeremy (1987). Under the Microscope: A Hidden World Revealed. CUP Archive. p. 11. ISBN 978-0521399401.
- ^ "Showing your true colors, 3D and color in electron microscopy in Lab News magazine".
- ^ a b c d e Mignot, Christophe (2018). "Color (and 3D) for Scanning Electron Microscopy". Microscopy Today. 26 (3): 12–17. doi:10.1017/S1551929518000482.
- ^ "Introduction to Electron Microscopy" (PDF). FEI Company. p. 15. Retrieved 12 December 2012.
- ^ "Next Monday, Digital Surf to Launch Revolutionary SEM Image Colorization". AZO Materials. 22 January 2016. Retrieved 23 January 2016.
- ^ Antonovsky, A. (1984). "The application of colour to SEM imaging for increased definition". Micron and Microscopica Acta. 15 (2): 77–84. doi:10.1016/0739-6260(84)90005-4.
- ^ Danilatos, G.D. (1986). "Colour micrographs for backscattered electron signals in the SEM". Scanning. 9 (3): 8–18. doi:10.1111/j.1365-2818.1986.tb04287.x.
- ^ Danilatos, G.D. (1986). "Environmental scanning electron microscopy in colour". Journal of Microscopy. 142: 317–325. doi:10.1002/sca.4950080104.
- ^ Bertazzo, S.; Gentleman, E.; Cloyd, K. L.; Chester, A. H.; Yacoub, M. H.; Stevens, M. M. (2013). "Nano-analytical electron microscopy reveals fundamental insights into human cardiovascular tissue calcification". Nature Materials. 12 (6): 576–583. Bibcode:2013NatMa..12..576B. doi:10.1038/nmat3627. hdl:10044/1/21901. PMC 5833942. PMID 23603848.
- ^ Bertazzo, Sergio; Maidment, Susannah C. R.; Kallepitis, Charalambos; Fearn, Sarah; Stevens, Molly M.; Xie, Hai-nan (9 June 2015). "Fibres and cellular structures preserved in 75-million–year-old dinosaur specimens". Nature Communications. 6: 7352. Bibcode:2015NatCo...6.7352B. doi:10.1038/ncomms8352. PMC 4468865. PMID 26056764.
- ^ 3.4GHz의 i7 2600 CPU에서 MountainsMap SEM 버전 7.4를 사용한 스테레오 SEM 재구성
- ^ Butterfield, Nicholas; Rowe, Penny M.; Stewart, Emily; Roesel, David; Neshyba, Steven (16 March 2017). "Quantitative three-dimensional ice roughness from scanning electron microscopy". Journal of Geophysical Research: Atmospheres. 122 (5): 3023–3025. Bibcode:2017JGRD..122.3023B. doi:10.1002/2016JD026094.
- ^ Butterfield, Nicholas; Rowe, Penny M.; Stewart, Emily; Roesel, David; Neshyba, Steven (16 March 2017). "Quantitative three-dimensional ice roughness from scanning electron microscopy". Journal of Geophysical Research: Atmospheres. 122 (5): 3025–3041. Bibcode:2017JGRD..122.3023B. doi:10.1002/2016JD026094.
- ^ Baghaei Rad, Leili (2007). Computational Scanning Electron Microscopy. International Conference on Frontiers of Characterization and Metrology. Vol. 931. p. 512. Bibcode:2007AIPC..931..512R. doi:10.1063/1.2799427.
- ^ Baghaei Rad, Leili; Downes, Ian; Ye, Jun; Adler, David; Pease, R. Fabian W. (2007). "Economic approximate models for backscattered electrons". Journal of Vacuum Science and Technology. 25 (6): 2425. Bibcode:2007JVSTB..25.2425B. doi:10.1116/1.2794068.
- ^ Tahmasebi, Pejman; Javadpour, Farzam; Sahimi, Muhammad (2015). "Multiscale and multiresolution modeling of shales and their flow and morphological properties". Scientific Reports. 5: 16373. Bibcode:2015NatSR...516373T. doi:10.1038/srep16373. PMC 4642334. PMID 26560178.
- ^ Tahmasebi, Pejman; Javadpour, Farzam; Sahimi, Muhammad (2015). "Three-Dimensional Stochastic Characterization of Shale SEM Images". Transport in Porous Media. 110 (3): 521–531. doi:10.1007/s11242-015-0570-1.
- ^ Tahmasebi, Pejman; Sahimi, Muhammad (2012). "Reconstruction of three-dimensional porous media using a single thin section". Physical Review E. 85 (6): 066709. Bibcode:2012PhRvE..85f6709T. doi:10.1103/PhysRevE.85.066709. PMID 23005245.
- ^ Murphy, GE; Lowekamp, BC; Zerfas, PM (August 2010). "Ion-abrasion scanning electron microscopy reveals distorted liver mitochondrial morphology in murine methylmalonic acidemia". Journal of Structural Biology. 171 (2): 125–32. doi:10.1016/j.jsb.2010.04.005. PMC 2885563. PMID 20399866.
- ^ "Multimedia Gallery - 3-D Imaging of Mammalian Cells With Ion-Abrasion SEM NSF - National Science Foundation". www.nsf.gov.
- ^ Butterfield, Nicholas; Rowe, Penny M.; Stewart, Emily; Roesel, David; Neshyba, Steven (16 March 2017). "Quantitative three-dimensional ice roughness from scanning electron microscopy". Journal of Geophysical Research: Atmospheres. 122 (5): 3023–3041. Bibcode:2017JGRD..122.3023B. doi:10.1002/2016JD026094.
- ^ Hermans, Joen; Osmond, Gillian; Loon, Annelies van; Iedema, Piet; Chapman, Robyn; Drennan, John; Jack, Kevin; Rasch, Ronald; Morgan, Garry; Zhang, Zhi; Monteiro, Michael (June 2018). "Electron Microscopy Imaging of Zinc Soaps Nucleation in Oil Paint". Microscopy and Microanalysis. 24 (3): 318–322. doi:10.1017/S1431927618000387. ISSN 1431-9276.
외부 링크
| 라이브러리 리소스 정보 주사전자현미경법 |
- 일반
- StuffWorks 구조 – 스캔 전자 현미경 구조
- SEM 사용법 배우기– SEM 사용을 원하는 사용자를 위한 온라인 학습 환경.호주 현미경에서 제공
- 가상 SEM – sparkler – 스캔 전자 현미경(SEM)의 인터랙티브 시뮬레이션
- 멀티채널 컬러 SEM 이미징– BSE 탑재
- DDC-SEM 이미지 예시
- Karlsruhe 응용과학대학 주사전자현미경
- 전자현미경을 포함한 다양한 종류의 현미경에 대한 애니메이션 및 설명(파리수드 대학)
- 역사
- 이미지들
- Rippel Electron Microscope 설비 Dartmouth College의 수십 개의 SEM 이미지(대부분 생물학적)
- 모스크바 눈병 연구소의 SEM 이미지를 염색하는 란타노이드.

















![3D surface reconstruction of a (Ra = 3 µm) roughness calibration sample (as used to calibrate profilometers), from 2 scanning electron microscope images tilted by 15° (top left). The calculation of the 3D model (bottom right) takes about 1.5 second[48] and the error on the Ra roughness value calculated is less than 0.5%.](http://upload.wikimedia.org/wikipedia/commons/thumb/f/f5/3D_surface_reconstruction_from_2_scanning_electron_microscope_images.gif/337px-3D_surface_reconstruction_from_2_scanning_electron_microscope_images.gif)


















