염증성 근섬유아세포종양
Inflammatory myofibroblastic tumour| 염증성 근섬유아세포종양 | |
|---|---|
| 기타 이름 | 상피염성 근섬유아세포육종[1] |
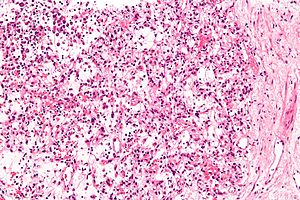 | |
| 신장의 염증성 근섬유아세포 종양의 현미경 사진.신장 생검이요H&E 염색. | |
염증성 근섬유아세포종양(IMT)은 신체의 [2]거의 모든 장기와 조직을 지탱하는 결합조직을 형성하는 중배엽세포의 희귀한 종양이다.IMT는 이전에는 염증성 의사 [3]종양으로 불렸다.하지만 현재, 염증성 의사 종양인 연부 조직 종양의 염증성myofibroblastic 종양 형질 세포 육아종,xanthomatous 의사 종양, 혼자 있기를 좋아하는 비만 세포 육아종 선동 fibrosarcoma,[4]pseudosarcomatousmyofibroblastic 확산, myofibroblastoma 선동 m를 포함하고 이질적 큰 그룹을 가리킨다이봐.섬유 조직 세포 [5]증식 및 결합 [4]조직 세포에서 발생하는 다른 종양.염증성 의사 종양은 방추세포로 이루어진 공통 현미경적 외관과 만성 또는 덜 일반적으로 급성 염증 [6][7]조직을 채우는 백혈구의 두드러진 존재를 공유하는 다양한 신생물 및 비종양성 조직 병변에 적용되는 총칭이다.
염증성 근섬유아세포성 종양은 처음에는 폐에서 가장 자주 발병하고 거의 모든 장기 시스템이나 조직에서 덜 흔히 발생하는 양성 종양으로 간주되었다.그러나 시간이 지남에 따라 종양이 국소 조직으로 전이되거나 말단 조직으로 전이되거나 치료 후 재발하거나 악성 염색체 이상을 가진 종양 세포로 구성된 IMT 사례가 발생했다.따라서 세계보건기구, 2013년 및 현재 문헌에서는 염증성 근섬유아세포 종양을 중간 악성 잠재성을[7] 가진 종양 또는 거의 전이되지 않는 [2]종양으로 일반적으로 설명한다.2020년 세계보건기구(WHO)는 IMT를 중간(희귀 전이) 섬유아세포 및 [8]근섬유아세포 종양의 범주에 특정 종양 형태로 재분류했다.모든 사건에서,[9] IMT는 미국에서 2009년에 150-200명의 환자가 발생했다고 보고된 희귀 종양이다.
IMT손상 일반적으로, 그리고 정의된다, 크게 보다 길다 특별한 세포 즉myofibrolastic 스핀들 cells,[7]는 섬유 아세포와 부드러운 근육 세포( 보근육 섬유 모세포)의 출현 병합하는 미세한 외모, 보통은 보통 지정된 fibrob뿐만 아니라 종양 조직, 그리고 정상적인 조직에서 발생하고 있다.명동ts.[10] 그러나 일부 IMF 사례의 병변은 방추세포의 [11]작은 구성 요소만을 가진 상피세포 시트(둥근 모양일 수 있음)에 의해 지배된다.이러한 특성을 가진 종양은 상피염성 근섬유아세포육종(EIMS)[3][11][12]이라고 불리는 IMT의 아형으로 간주된다.
IMT와 EIMS의 종양은 지속적으로 소염성 백혈구를 포함하고 있으며, 대부분의 경우 무지외성 림프종 키나제(ALK)[13]의 활성 부분을 포함하는 것과 같이 매우 비정상적인 종양 유발(암을 유발하는) 융합 단백질을 발현하는 종양 세포를 포함하고 있다.이러한 염증, 유전적 이상 또는 둘 다 IMT의 발달에 기여하는지는 분명하지 않지만, 이러한 유전적 이상에 의해 만들어진 융합 단백질의 활동을 차단하는 약물이 질병을 [14]치료하는데 유용할 수 있다.
징후 및 증상
IMT는 소아나 청소년에게[13] 발생하고 폐, 장간, 대망막 또는 심장, 간, 비장, 췌장, 대장, 소장, 정자, 전립선, 자궁, 안와, 말초 또는 중추신경계 신경, 뇌수막, 척수 또는 기타 [7]부위에 나타나는 종양으로 간주되었다.하지만 92명의 환자는 감시, 역학에 의해 누적의 좀 더 최근의 소급 적용되는 공부하고 국립 암 연구소의 엔드 결과(SEER)프로그램 피크 현상으로 질병 발병의 평균 연령은 47.4년 0으로 4,36건으로 40세 을에서 50살;중년층.(41명 64년)전체 c도 발견~하듯이es. 본 연구에서 가장 흔한 종양 발생 부위는 하지와 엉덩이(22%), 하지와 어깨(12%), 머리, 얼굴, 목(9%)[7]이었다.25명의 환자를 대상으로 한 또 다른 최근 연구에서 가장 흔한 IMT 부위는 복부(환자 40%)와 폐/흉벽(32%)이었다.[13]또한 개별 IMT 환자는 방광, 항문관 및 상막 공간(즉, 비인두, 중이, 부비강, 근막하, 익상구개포사 [2]등 수막과 인접한 부위)에 존재하는 것으로 보고되었다.조사된 환자 모집단에 따라 다양한 연령과 장기/조직 분포: 일반적으로 거의 모든 연령의 개인과 거의 모든 장기 또는 조직 부위에 나타날 수 있다.IMT는 가장 일반적으로 단일 부위에 국한된 종양으로 나타나지만, 종양세포가[7] ALK 융합 [13]단백질을 발현하는 경우 최대 5% 또는 최대 10%의 원위부 전이와 관련될 수 있다.종양의 크기는 1~25cm(평균 6.5cm)이며, 3분의 2는 1.5~6.[7]5cm이다.드문 경우지만 종양은 자연적으로 [3][15]퇴보했다.
IMT를 가진 개인은 종양 위치에 따라 광범위한 증상(예: 통증, 붓기, 종괴, 장기 기능 장애 등)을 보인다.이 사람들 중 1/3은 발열, 오한, 식은땀,[2] 그리고 체중 감소와 같은 전신 염증 증상을 가지고 있다.IMT의 드문 사례는 a) 조직성 폐렴, b) Mycobacterium avium interacellure 또는 Corynebacterium equi(폐렴을 일으키는 박테리아)에 의한 감염을 가진 개인에게 발병했다.Campylobacter jejuni(위장염의 원인)리시니바실루스 스페이커스(이전에는[16] 폐 감염 및 패혈증의 희귀 원인인 바실루스 스페이커스)[17][18]Coxiella burneti(Q열 유발), Epstein-Barr 바이러스(감염성 단핵증 및 Epstein-Bar 바이러스 관련 림프구증 악성질환 유발), 및 대장균 관련 간정맥의 폐색성 정맥염, 또는 c) 이전 복부 수술, 외상, 뇌심막 션트.ge.[19] IMT에 대한 이러한 질병 관계의 관계([20]즉, 원인 또는 단순한 연관성)는 알려져 있지 않다.
분자 이상
IMT의 50~60%와 EIMS의 모든 경우에 있는 종양세포는 ALK 유전자의 체세포 재조합에 의해 만들어진 비정상적인 ALK 단백질을 발현한다.ALK, 즉 무아플라스틱 림프종 키나제(단백질 키나제 B라고도 함)는 ALK [21]유전자에 의해 생성된다.IMT에서 ALK 유전자는 동일 또는 다른 염색체 상의 다른 부위에 위치한 유전자와 결합해 새로운 유전자의 일부와 ALK의 [22]활성을 코드하는 ALK 유전자의 일부로 이루어진 키메라 유전자를 형성한다.이 키메라 유전자는 과도한 ALK 활성을 가진 융합 단백질을 과잉 생산한다.ALK는 직간접적으로 PI3K/AKT/mTOR, Ras GTPase, ERKs, Janus kinase, STAT 단백질 및 기타 세포 시그널링 요소를 자극하는 세린/트레오닌 특이 단백질 키나제이다.이러한 요소의 활성화는 세포 성장, 증식, 생존 및 기타 종양 촉진 [23][24]행동을 자극합니다.이 염색체 전위의 예로서 위치 23(2p23으로 표기)에서 염색체 2의 단팔 또는 "p"에 위치한 ALK 유전자는 위치 13(17q23)에서 염색체 17의 긴팔의 CLTC 유전자와 결합하여 t(2;17q23)로 표기되지 않은 키메라 유전자를 형성한다.이 키메라 유전자는 제어되지 않은 ALK 세린/트레오닌 특이 단백질 키나아제 [14][25]활성을 가진 CLTC-ALK 융합 단백질을 만든다.는 AKT IMT에서 발견되는 작업대와 합쳐지면서 다른 유전자:TFG, DCTN1, EML4, TPM3,[3]TPM4,[25]ATIC[26][27]RANBP2[28](대부분의 전부는 아니더라도 RAMB2-ALK 비현실적인 유전자 IMT[3]의 비상 관리 정보 시스템 형태로 발생한다), CARS1,[11][29]과 SEC31L1을 포함한다.[30]IMT 사례에서 ROS1의 적극적인 부분(중간 주파 변성기의 경우 10%, 코딩에 세포 gro을 도모하는로는 티로신 인산화 효소 발견된 다른 비현실적인 유전자 표현할 수 있다.wth), PDGFRB(암 발달을 촉진할 수 있는 단백질 코드), NTRK(암 발달을 촉진할 수 있는 수용체 티로신 키나제 코드)는 다른 유전자와 결합한다.이러한 키메라 유전자의 융합 단백질 생성물은 ALK 융합 단백질 생성물과 마찬가지로 과잉 생산되고, 과잉 활성되어 IMT의 발달에 [2]기여할 수 있다.
진단.
IMT의 종양에 대한 조직병리학적 검사는 일반적으로 점액성 배경(즉, 젤라틴 형태의 무코다당류와 비황화 글리코사미노글리칸을 포함하는 배경 매트릭스)에서 근섬유아세포 시트를 드러낸다. 매트릭스는 염증 세포, 특히 때때로 에오소피세포와 혼합되는 림프구를 포함한다.호중구IMT의 상피 모양의 염증성myofibroblastic 육종 하위 유형은 점액성의(즉 보라 색을 결합 조직 적절히 H&의 일반적인 붉은 외모에 비해, E, 스테인드와 현미경으로 검사를 파란 것으로 보인다), 아교, 혹은 종합myxoid-collagenous 행렬,<5%스핀들 안에 유상핀 둥근 세포로 시트를 보여 준다. 세포,그리고 대부분의 경우 호중구 또는 적은 빈도로 작은 림프구 또는 호산구로 구성된 염증세포가 침투한다; 혈장세포는 소수의 EIMS 사례에서만 발생한다.IMT[2] 케이스의 50~60%, EIMS 케이스의[3] 100% 종양 내 종양세포는 ALK 융합단백질을 발현한다.이 세포들에서는 다른 유전적 이상이 발생한다.ALK 융합 단백질의 존재 및 기타 유전적 이상(다음 절 참조)을 검사하면 IMT [31]진단에 도움이 됩니다.
치료
많은 정보원은 국소적인 IMT를 모든 종양 [7][13]조직을 완전히 절제하여 치료할 것을 권고한다.국소적인 종양 재발도 마찬가지로 전절제술로 치료될 수 있다.이 식이요법에 방사선이나 전신 화학요법을 추가하는 것은 거의 지지하지 않는다.절제할 수 없거나 접근할 수 없는 부위, 다초점 또는 전이된 종양은 공격적인 치료 [32]요법으로 치료된다.
한 소급 연구에서 59명의 IMT 환자(모두 25세 미만)가 수술로 치료되었다. 31명은 수술 후 잔여 질환이 없었다. 이들 환자 중 4명은 국소 재발이 있었고, 3명은 다시 수술로 치료되었고 1명은 수술과거 1명은 수술과 화학치료를 받았다.19명은 수술 후 미세한 잔존 질환을 앓고 있었다.수술 후 이들 환자 중 6명은 고용량 코르티코스테로이드, 5명은 빈블라스틴+메토트렉세이트 화학요법, 3명은 ALK 억제제, 2명은 비노렐빈+저용량 시클로헥시미드 또는 Ifospamide 기반 화학요법, 1명은 시클로포스파미드+빈치리스틴+액토마이신 화학요법으로 치료했다.이 19명의 환자 중 4명이 완전반응, 8명의 부분반응, 5명의 안정질환, 2명의 진행성질환을 가지고 있었다.수술 후 거시적 질환이 있는 환자는 9명, 이 중 5명은 빈크리스틴+메토트렉세이트, 2명은 ALK 억제제를, 1명은 고용량 코르티코스테로이드 또는 Ifosfamide 기반 화학요법을 받았다.이 9명의 환자들 중 아무도 완전한 반응을 보이지 않았고, 6명은 부분적인 반응을 보였으며, 1명은 꾸준한 질병을 보였으며, 2명은 진행성 질환을 가지고 있었다.59명의 환자 중 사망자는 없었다.다양한 약물요법들은 ALK 억제제로 치료된 환자들이 반응 [2]시간이 더 긴 경향을 보였지만 효과에서 거의 차이를 보이지 않았다.또 다른 소급 연구는 아드리아마이신 기반 화학요법 요법에 대한 17명의 환자(22-46세, 중위수 나이 32세)의 반응을 평가했다.Adriamycin 단독, Adriamycin + Ifosfamide 또는 Adriamicin + 기타 화학요법 약물.완전한 반응을 보인 환자는 없었고, 8명의 환자가 부분 반응을 보였으며, 4명의 환자가 꾸준한 질병을 보였으며, 5명의 환자가 진행성 질환을 가지고 있었다.무진행 생존과 전체 생존 기간은 각각 6.6개월과 21.2개월이었다.연구는 또한 메트렉세이트 + 빈블라스틴, 메트렉세이트 + 비노렐빈 또는 빈블라스틴 + 비노렐빈으로 치료된 9명의 환자(12-31세, 중앙 연령 16세)를 평가했다. 환자 2명은 완전한 반응을 얻었고, 3명은 부분 반응을 얻었으며, 2명은 꾸준한 질병을 얻었으며, 2명은 진행성 질환에 도달하지 못했다.전체 생존기간은 83.4개월이었다.연구는 아드리아마이신 기반 및 메토트렉세이트/빈블라스틴/비노렐빈 요법이 IMT에서 높은 활성도를 보인다는 결론을 내렸다. 평가된 환자 수가 적기 때문에 어떤 요법이 가장 [13]효과적인지에 대한 결론을 내릴 수 없었다.
ALK 억제제의 효과를 이전 단락에서 설명한 다른 치료법과 비교한 보고서 외에도, 여러 보고서는 주로 ALK 억제제로 치료된 소수의 IMT 환자에 초점을 맞추고 있다.유럽 암 연구 및 치료 기구는 수술 및/또는 약물 치료 후 지속성 및/또는 전이성 질환을 가진 12명의 ALK 양성 IMT 성인에 대한 ALK 억제제 crizotinib의 영향을 평가했다. 2명의 환자는 완전한 반응을 보였고, 4명은 부분 반응을 보였으며, 5명은 꾸준한 질환을 보였으며, 진행성 질환을 가진 사람은 없었다.이들 환자 중 9명은 최소 1년 무진행 생존을 했지만 1명의 환자가 이 [33]질환으로 사망했다.이전에 발표된 모든 연령의 IMT 환자를 검토한 결과, 1) 사전 치료 없이 4명의 환자(단초점 3, 다초점 질환 1)가 크리조티닌에 대한 완전한 반응을 보였고 2) 수술 후 지속적인 질환을 가지고 있고 이전에 화학 요법으로 치료한 환자 2명(단초점, 다초점 질환 1)이 부분 반응을 보였다.crizotinib에 대해서는 이전에 corticosteroid, prednisone으로 치료받은 환자 1명이 crizotinib에 진행성 질환을 계속 가지고 있었고 3) 수술 후 진행성 질환 환자 6명(다초점 또는 단초점 질환 접근 불능 부위로 인한)은 완전한 반응(2건), 부분 반응(2건), 안정적인 질환(1건)을 보였다.또는 crizotinib에 대한 반응으로 진행성 질환(1건).inhibitors[3]또 다른 연구는 ALK 억제제는 종양(5건), 외과 종양 제거는 ALK 억제제 순 제거 수술. 순으로 치료된 29일 소아과 환자(17년으로 나이 15개월)검토 두명의 진행성 질환으로 이crizotinib-treated 환자들의 2세대를 완전한 반응 근처 ALK다. (12건) 또는 수술하지 않은 ALK 억제제.ALK 억제제 치료 종료 후 환자 12명 완전반응 14명, 안정질환 2명, 재발 2명 등이었다.후자의 두 환자는 crizotinib(1건) 또는 2세대 ALK 억제제인 ceritinib(1건)[14]로 퇴행에 대한 완전한 반응을 얻었다.전이성 또는 수술 불가능한 ALK 양성 IMT를 가진 14명의 소아 환자를 대상으로 한 연구는 crizotinib로 치료하였다: 5명의 환자가 완전한 반응을 얻었고 7명의 부분 반응이 있었으며 2명의 안정적인 질병이 있었다.연구 기간(2-63개월) 동안 진행성 [34]질환이 발생한 환자는 없었다.수많은 의학사 연구들이 ALK 억제제로 [35][14][25][36]처리된 IMT에서 유사한 결과를 가져왔다.그러나, ALK 억제제는 심각한 부작용을 가지고 있다; 연구에서, crizotinib 치료는 폐렴, 원인 불명의 발열, 심장마비, 패혈증, 복부 농양, 급성 신부전, 비정상적인 심전도(즉, QT 연장)[33]의 발생과 관련이 있었다.AKT뿐만 아니라 ROS1 및 NRTK에서 활성인 티로신 키나아제 억제제인 엔트렉티닙은 ROS1, NRTK [37]및/또는 ALK 융합 [38]단백질을 발현하는 IMT 환자 개개인에게 임상적으로 유의한 활성을 보였다.
「 」를 참조해 주세요.
레퍼런스
- ^ "Inflammatory myofibroblastic tumor Genetic and Rare Diseases Information Center (GARD) – an NCATS Program". rarediseases.info.nih.gov. Retrieved 28 June 2019.
- ^ a b c d e f g Casanova M, Brennan B, Alaggio R, Kelsey A, Orbach D, van Noesel MM, Corradini N, Minard-Colin V, Zanetti I, Bisogno G, Gallego S, Merks JH, De Salvo GL, Ferrari A (March 2020). "Inflammatory myofibroblastic tumor: The experience of the European pediatric Soft Tissue Sarcoma Study Group (EpSSG)". European Journal of Cancer. 127: 123–129. doi:10.1016/j.ejca.2019.12.021. PMID 32007712. S2CID 211012731.
- ^ a b c d e f g Theilen TM, Soerensen J, Bochennek K, Becker M, Schwabe D, Rolle U, Klingebiel T, Lehrnbecher T (April 2018). "Crizotinib in ALK+ inflammatory myofibroblastic tumors-Current experience and future perspectives". Pediatric Blood & Cancer. 65 (4): e26920. doi:10.1002/pbc.26920. PMID 29286567. S2CID 3395900.
- ^ a b Ajani MA, Fatunla EO, Onakpoma FA, Salami AA (2020). "Inflammatory Pseudotumor: A 20-Year Single Institutional Experience". Advanced Biomedical Research. 9: 68. doi:10.4103/abr.abr_48_20. PMC 8012865. PMID 33816387.
- ^ Savvidou OD, Sakellariou VI, Papakonstantinou O, Skarpidi E, Papagelopoulos PJ (2015). "Inflammatory myofibroblastic tumor of the thigh: presentation of a rare case and review of the literature". Case Reports in Orthopedics. 2015: 814241. doi:10.1155/2015/814241. PMC 4402203. PMID 25945274.
- ^ Gleason BC, Hornick JL (April 2008). "Inflammatory myofibroblastic tumours: where are we now?". Journal of Clinical Pathology. 61 (4): 428–37. doi:10.1136/jcp.2007.049387. PMID 17938159.
- ^ a b c d e f g h Fu GX, Xu CC, Yao NF, Gu JZ, Jiang HL, Han XF (July 2019). "Inflammatory myofibroblastic tumor: A demographic, clinical and therapeutic study of 92 cases". Mathematical Biosciences and Engineering : MBE. 16 (6): 6794–6804. doi:10.3934/mbe.2019339. PMID 31698588.
- ^ Sbaraglia M, Bellan E, Dei Tos AP (April 2021). "The 2020 WHO Classification of Soft Tissue Tumours: news and perspectives". Pathologica. 113 (2): 70–84. doi:10.32074/1591-951X-213. PMC 8167394. PMID 33179614.
- ^ Webb TR, Slavish J, George RE, Look AT, Xue L, Jiang Q, Cui X, Rentrop WB, Morris SW (March 2009). "Anaplastic lymphoma kinase: role in cancer pathogenesis and small-molecule inhibitor development for therapy". Expert Review of Anticancer Therapy. 9 (3): 331–56. doi:10.1586/14737140.9.3.331. PMC 2780428. PMID 19275511.
- ^ "spindle cells - Google Search". www.google.com. Retrieved 2021-11-22.
- ^ a b c Mariño-Enríquez A, Wang WL, Roy A, Lopez-Terrada D, Lazar AJ, Fletcher CD, Coffin CM, Hornick JL (January 2011). "Epithelioid inflammatory myofibroblastic sarcoma: An aggressive intra-abdominal variant of inflammatory myofibroblastic tumor with nuclear membrane or perinuclear ALK". The American Journal of Surgical Pathology. 35 (1): 135–44. doi:10.1097/PAS.0b013e318200cfd5. PMID 21164297. S2CID 40339168.
- ^ Telugu RB, Prabhu AJ, Kalappurayil NB, Mathai J, Gnanamuthu BR, Manipadam MT (May 2017). "Clinicopathological Study of 18 Cases of Inflammatory Myofibroblastic Tumors with Reference to ALK-1 Expression: 5-Year Experience in a Tertiary Care Center". Journal of Pathology and Translational Medicine. 51 (3): 255–263. doi:10.4132/jptm.2017.01.12. PMC 5445201. PMID 28415158.
- ^ a b c d e f Baldi GG, Brahmi M, Lo Vullo S, Cojocaru E, Mir O, Casanova M, Vincenzi B, De Pas TM, Grignani G, Pantaleo MA, Blay JY, Jones RL, Le Cesne A, Frezza AM, Gronchi A, Collini P, Dei Tos AP, Morosi C, Mariani L, Casali PG, Stacchiotti S (November 2020). "The Activity of Chemotherapy in Inflammatory Myofibroblastic Tumors: A Multicenter, European Retrospective Case Series Analysis". The Oncologist. 25 (11): e1777–e1784. doi:10.1634/theoncologist.2020-0352. PMC 7648357. PMID 32584482.
- ^ a b c d Craig E, Wiltsie LM, Beaupin LK, Baig A, Kozielski R, Rothstein DH, Li V, Twist CJ, Barth M (February 2021). "Anaplastic lymphoma kinase inhibitor therapy in the treatment of inflammatory myofibroblastic tumors in pediatric patients: Case reports and literature review". Journal of Pediatric Surgery. doi:10.1016/j.jpedsurg.2021.02.004. PMID 33676744. S2CID 232140059.
- ^ Matsubayashi H, Uesaka K, Sasaki K, Shimada S, Takada K, Ishiwatari H, Ono H (October 2019). "A Pancreatic Inflammatory Myofibroblastic Tumor with Spontaneous Remission: A Case Report with a Literature Review". Diagnostics (Basel, Switzerland). 9 (4): 150. doi:10.3390/diagnostics9040150. PMC 6963339. PMID 31627359.
- ^ Isaacson P, Jacobs PH, Mackenzie AM, Mathews AW (September 1976). "Pseudotumour of the lung caused by infection with Bacillus sphaericus". Journal of Clinical Pathology. 29 (9): 806–11. doi:10.1136/jcp.29.9.806. PMC 476182. PMID 977782.
- ^ Castagnola E, Fioredda F, Barretta MA, Pescetto L, Garaventa A, Lanino E, Micalizzi C, Giacchino R, Dini G (June 2001). "Bacillus sphaericus bacteraemia in children with cancer: case reports and literature review". The Journal of Hospital Infection. 48 (2): 142–5. doi:10.1053/jhin.2001.0995. PMID 11428882.
- ^ Banerjee C, Bustamante CI, Wharton R, Talley E, Wade JC (August 1988). "Bacillus infections in patients with cancer". Archives of Internal Medicine. 148 (8): 1769–74. doi:10.1001/archinte.1988.00380080059017. PMID 3401098.
- ^ Karnak I, Senocak ME, Ciftci AO, Cağlar M, Bingöl-Koloğlu M, Tanyel FC, Büyükpamukçu N (June 2001). "Inflammatory myofibroblastic tumor in children: diagnosis and treatment". Journal of Pediatric Surgery. 36 (6): 908–12. doi:10.1053/jpsu.2001.23970. PMID 11381424.
- ^ "Inflammatory myofibroblastic tumor Genetic and Rare Diseases Information Center (GARD) – an NCATS Program".
- ^ "AKT1 AKT serine/threonine kinase 1 [Homo sapiens (human)] - Gene - NCBI". www.ncbi.nlm.nih.gov. Retrieved 2021-11-22.
- ^ Amador C, Feldman AL (March 2021). "How I Diagnose Anaplastic Large Cell Lymphoma". American Journal of Clinical Pathology. 155 (4): 479–497. doi:10.1093/ajcp/aqab012. PMID 33686426.
- ^ Ducray SP, Natarajan K, Garland GD, Turner SD, Egger G (July 2019). "The Transcriptional Roles of ALK Fusion Proteins in Tumorigenesis". Cancers. 11 (8): 1074. doi:10.3390/cancers11081074. PMC 6721376. PMID 31366041.
- ^ Martorana F, Motta G, Pavone G, Motta L, Stella S, Vitale SR, Manzella L, Vigneri P (2021). "AKT Inhibitors: New Weapons in the Fight Against Breast Cancer?". Frontiers in Pharmacology. 12: 662232. doi:10.3389/fphar.2021.662232. PMC 8118639. PMID 33995085.
- ^ a b c Cao Z, Gao Q, Fu M, Ni N, Pei Y, Ou WB (February 2019). "Anaplastic lymphoma kinase fusions: Roles in cancer and therapeutic perspectives". Oncology Letters. 17 (2): 2020–2030. doi:10.3892/ol.2018.9856. PMC 6341817. PMID 30675269.
- ^ "ATIC 5-aminoimidazole-4-carboxamide ribonucleotide formyltransferase/IMP cyclohydrolase [Homo sapiens (Human)] – Gene – NCBI".
- ^ Debiec-Rychter M, Marynen P, Hagemeijer A, Pauwels P (October 2003). "ALK-ATIC fusion in urinary bladder inflammatory myofibroblastic tumor". Genes, Chromosomes & Cancer. 38 (2): 187–90. doi:10.1002/gcc.10267. PMID 12939746. S2CID 40569327.
- ^ Ma Z, Hill DA, Collins MH, Morris SW, Sumegi J, Zhou M, Zuppan C, Bridge JA (May 2003). "Fusion of ALK to the Ran-binding protein 2 (RANBP2) gene in inflammatory myofibroblastic tumor". Genes, Chromosomes & Cancer. 37 (1): 98–105. doi:10.1002/gcc.10177. PMID 12661011. S2CID 23427194.
- ^ "SEC31A SEC31 homolog A, COPII coat complex component [Homo sapiens (Human)] – Gene – NCBI".
- ^ Panagopoulos I, Nilsson T, Domanski HA, Isaksson M, Lindblom P, Mertens F, Mandahl N (March 2006). "Fusion of the SEC31L1 and ALK genes in an inflammatory myofibroblastic tumor". International Journal of Cancer. 118 (5): 1181–6. doi:10.1002/ijc.21490. PMID 16161041.
- ^ Hou TC, Wu PS, Huang WY, Yang YT, Tan KT, Liu SH, Chen YJ, Chen SJ, Su YW (March 2020). "Over expression of CDK4 and MDM2 in a patient with recurrent ALK-negative mediastinal inflammatory myofibroblastic tumor: A case report". Medicine. 99 (12): e19577. doi:10.1097/MD.0000000000019577. PMC 7220190. PMID 32195970.
- ^ "UpToDate".
- ^ a b Schöffski P, Sufliarsky J, Gelderblom H, Blay JY, Strauss SJ, Stacchiotti S, Rutkowski P, Lindner LH, Leahy MG, Italiano A, Isambert N, Debiec-Rychter M, Sciot R, Van Cann T, Marréaud S, Nzokirantevye A, Collette S, Wozniak A (June 2018). "Crizotinib in patients with advanced, inoperable inflammatory myofibroblastic tumours with and without anaplastic lymphoma kinase gene alterations (European Organisation for Research and Treatment of Cancer 90101 CREATE): a multicentre, single-drug, prospective, non-randomised phase 2 trial". The Lancet. Respiratory Medicine. 6 (6): 431–441. doi:10.1016/S2213-2600(18)30116-4. PMID 29669701. S2CID 5000248.
- ^ Mossé YP, Voss SD, Lim MS, Rolland D, Minard CG, Fox E, Adamson P, Wilner K, Blaney SM, Weigel BJ (October 2017). "Targeting ALK With Crizotinib in Pediatric Anaplastic Large Cell Lymphoma and Inflammatory Myofibroblastic Tumor: A Children's Oncology Group Study". Journal of Clinical Oncology. 35 (28): 3215–3221. doi:10.1200/JCO.2017.73.4830. PMC 5617123. PMID 28787259.
- ^ Mittal A, Gupta A, Dhamija E, Barwad A, Rastogi S (March 2021). "Sustained complete response on crizotinib in primary lung inflammatory myofibroblastic tumor – Case report and literature review". Monaldi Archives for Chest Disease = Archivio Monaldi per le Malattie del Torace. 91 (3). doi:10.4081/monaldi.2021.1586. PMID 33794589.
- ^ Zhang C, Wang Z, Zhuang R, Guo X, Feng Y, Shen F, Liu W, Zhang Y, Tong H, Sun W, Liu J, Wang G, Dai C, Lu W, Zhou Y (2020). "Efficacy and Resistance of ALK Inhibitors in Two Inflammatory Myofibroblastic Tumor Patients with ALK Fusions Assessed by Whole Exome and RNA Sequencing". OncoTargets and Therapy. 13: 10335–10342. doi:10.2147/OTT.S270481. PMC 7568619. PMID 33116613.
- ^ Ambati SR, Slotkin EK, Chow-Maneval E, Basu EM (2018). "Entrectinib in Two Pediatric Patients With Inflammatory Myofibroblastic Tumors Harboring ROS1 or ALK Gene Fusions". JCO Precision Oncology. 2 (2): 1–6. doi:10.1200/PO.18.00095. PMC 7594679. PMID 33134769.
- ^ Bonvini P, Rossi E, Zin A, Manicone M, Vidotto R, Facchinetti A, Tombolan L, Affinita MC, Santoro L, Zamarchi R, Bisogno G (2021). "Case Report: Circulating Tumor Cells as a Response Biomarker in ALK-Positive Metastatic Inflammatory Myofibroblastic Tumor". Frontiers in Pediatrics. 9: 652583. doi:10.3389/fped.2021.652583. PMC 8116882. PMID 33996693.
외부 링크
- ^ DEMIR, Omer Faruk 등폐염증성 근섬유아세포종양의 외과적 치료 결과.흉부의학연보, 2022, 17.1:44.