E1cB-제거 반응
E1cB-elimination reaction
E1cB 제거반응은 제거할 수소가 상대적으로 산성인 기본 조건에서 발생하는 제거반응의 일종인 반면, 이탈군(-OH 또는 -OR 등)은 상대적으로 빈약한 집단이다. 보통은 온건하거나 강한 기반이 존재한다. E1cB는 2단계 과정으로, 첫 번째 단계는 되돌릴 수 있거나 없을 수 있다. 첫째, 베이스는 상대적으로 산성인 양성자를 추상화하여 안정된 음이온을 생성한다. 음이온에 있는 한 쌍의 전자는 이웃한 원자로 이동하며, 따라서 떠나는 그룹을 내보내고 이중 또는 삼중 결합을 형성한다.[1] 메커니즘의 이름 E1cB는 Removal Unimolital conjate Base를 의미한다. 제거는 메커니즘이 제거 반응이며 두 개의 대체물을 잃게 된다는 사실을 말한다. 단분자란 이 반응의 속도 결정 단계가 단지 하나의 분자체만을 포함한다는 사실을 말한다. 마지막으로, 결합 베이스는 시작 재료의 결합 베이스인 카르바니온 중간의 형성을 말한다.
E1cB는 반대쪽 끝의 E1 메커니즘과 가운데의 E2 메커니즘을 포함하는 연속 스펙트럼의 한쪽 끝에 있는 것으로 간주해야 한다. E1 메커니즘은 보통 반대되는 특징을 가지고 있는데, 수소는 특별히 산성화되지 않고 튼튼한 기초가 없는 반면, 떠나는 그룹은 좋은 그룹( -OTs 또는 -Br과 같이)이다. 따라서 E1 메커니즘에서는 떠나는 그룹이 먼저 떠나 탄수화물을 생성한다. 이탈군 이탈 후 빈 p궤도가 존재하기 때문에 인접 탄소의 수소는 훨씬 산성화되어 2단계에서 약한 염기에 의해 제거될 수 있다. E2 반응에서 강한 베이스와 좋은 이탈 그룹의 존재로 인해 베이스에 의한 양성자 추상화와 이탈 그룹의 이탈이 동시에 일어나게 되어, 한 단계 과정으로 합치된 전환 상태가 된다.
메커니즘
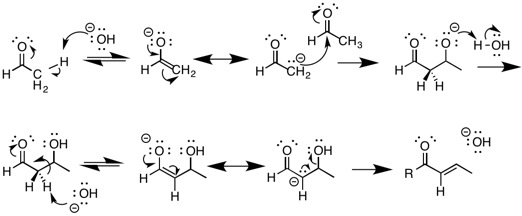
E1cB 기계론적 경로로 반동이 진행되도록 하기 위한 두 가지 주요 요건이 있다. 화합물의 β-탄소에는 산성 수소가 있어야 하며 α-탄소에는 비교적 빈약한 이탈군이 있어야 한다. E1cB 메커니즘의 첫 번째 단계는 β-탄소의 감응으로, 그 결과 카르바니온과 같은 음이온적 전환 상태가 형성된다. 이 전환 상태의 안정성이 클수록 메커니즘은 E1cB 메커니즘을 선호할 것이다. 이러한 전환 상태는 공명을 통한 전자 단독 쌍의 유도 또는 소산화를 통해 안정될 수 있다. 일반적으로 기판 위의 전자 인출 그룹, 튼튼한 베이스, 빈약한 이탈 그룹, 극성 용제가 E1cB 메커니즘을 촉발한다고 주장할 수 있다. 안정적인 전환 상태를 가진 E1cB 메커니즘의 예는 지구 대기 중 비교적 짧은 반감기를 가진 카바메이트 살충제인 에디오펜카르브의 저하에서 볼 수 있다. 아민이 퇴화되었을 때, 아미드는 인접한 카보닐과 결합되기 때문에 결과 아미드는 비교적 안정적이다. β-탄소에 산성수소를 함유하는 것 외에 상대적으로 빈약한 이탈군도 필요하다. 분자의 이온화 이전에 좋은 이탈 그룹이 떠날 것이기 때문에 나쁜 이탈 그룹이 필요하다. 결과적으로, 이 화합물은 E2 경로를 통해 진행될 것 같다. 불량한 이탈 그룹을 포함하고 E1cB 메커니즘을 겪을 수 있는 화합물의 몇 가지 예는 알코올과 플루오로알카인이다. 또한 E1cB 메커니즘은 알칸에서 알켄으로 제거하는 것보다 알칸에서 알켄으로 제거하는 알켄 사이에서 더 흔하다고 제안되었다.[2] 이에 대한 한 가지 가능한 설명은 sp2 교배는 약간 더 산성 양자를 만들어 낸다는 것이다. 비록 이 메커니즘이 탄소 기반 제거에만 국한되지는 않는다. 에디오펜카르브에서 페놀 유도체를 제거하는 과정에서 질소와 같은 다른 이질소에서도 관찰되었다.[3]

E1cB-제거 반응과 E1- 및 E2-제거 반응의 구별
모든 제거 반응은 화합물의 원자 쌍에서 두 대체물을 제거하는 것을 포함한다. 알켄, 알키네스 또는 유사한 이질 원자 변화(카보닐, 시아노 등)가 형성될 것이다. E1cB 메커니즘은 세 가지 유형의 제거 반응 중 하나에 불과하다. 다른 두 제거 반응은 E1과 E2 반응이다. 메커니즘은 유사하지만, α 탄소의 감압 시점과 이탈 그룹의 상실 시점에 따라 다르다. E1은 단분자 제거를, E2는 2분자 제거를 의미한다. E1 메커니즘에서 분자는 α-탄소의 감압 전에 출발하는 좋은 이탈 그룹을 포함한다. 이로 인해 탄수화물 중간체가 형성된다. 그런 다음 탄수화물은 감압되어 새로운 파이 본드가 형성된다. 관련된 분자는 또한 브로민이나 염소 같은 매우 좋은 이탈군을 가지고 있어야 하며, 상대적으로 덜 산성 α 탄소를 가지고 있어야 한다.
E2 엘리미네이션 반응에서 α-탄소의 감응과 이탈 그룹의 상실 모두 한 번에 동시에 일어난다. E2 엘리미네이션 메커니즘을 거치는 분자는 E1 메커니즘을 거치는 분자보다 산성 α 탄화수소를 더 많이 가지고 있지만, 그들의 α 탄화수소는 E1cB 메커니즘을 거치는 분자의 그것만큼 산성화되지 않는다. E2와 E1cb 경로 사이의 주요 차이는 하나의 일치된 메커니즘과는 반대로 뚜렷한 카르바니온 중간이다. 연구들은 서로 다른 할로겐 퇴거 그룹을 사용함으로써 경로가 다르다는 것을 보여주었다. 한 예는 염소가 훨씬 좋은 이탈군임에도 불구하고 [4]불소를 떠나는 집단으로 만드는 불소보다 음이온을 안정화시키는 할로겐으로 염소를 사용하는 것이다.[5] 이것은 가장 안정적인 결합형 E2 메커니즘을 통해 제품이 불가능하기 때문에 카르바니온이 형성되었다는 증거를 제공한다. 다음 표에는 세 가지 제거 반응 사이의 주요 차이점이 요약되어 있다. 그러나 특정 반응에서 어떤 메커니즘이 핵심적인 역할을 하고 있는지 식별하는 가장 좋은 방법은 화학적 운동학의 적용과 관련이 있다.
| E1 | E2 | E1cB |
|---|---|---|
| 단계적 반응 | 일치반응 | 단계적 반응 |
| 탄수화물중간 | 양성자 동시 제거, 이중결합 형성, 탈퇴군 손실 | 카르바니온 중급 |
| 강산성 매체 | 선호 없음 | 강력한 기본 미디어 |
| 좋은 출발 그룹 | 탈퇴군 | 가난한 탈퇴 그룹 |
| 산도가 낮은 B-H | 산성 B-H | 더 산성 B-H |
E1cB 엘리미네이션 메커니즘의 화학적 역학
반응이 E1cB 메커니즘을 따르는지 여부를 결정하려고 할 때 화학적 운동학은 필수적이다. E1cB 메커니즘을 식별하는 최선의 방법은 속도 법칙과 운동 동위원소 효과의 사용을 포함한다. 또한 이러한 기법은 E1cB, E1 및 E2 엘리미네이션 반응을 더욱 구별하는 데 도움이 될 수 있다.
요금법
어떤 반응이 E1cB 메커니즘을 따르는지 여부를 실험적으로 판단하려고 할 때 화학적 운동학은 필수적이다. E1cB 메커니즘을 식별하는 최선의 방법은 속도 법칙과 운동 동위원소 효과의 사용을 포함한다.
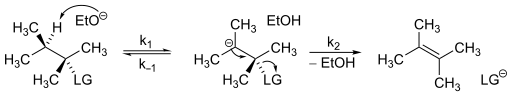
E1cB 메커니즘을 지배하는 요율법은 비교적 쉽게 결정할 수 있다. 다음과 같은 대응책을 생각해 보자.
메커니즘에 일정한 상태의 카르바니온 농도가 있다고 가정하면 E1cB 메커니즘에 대한 속도 법칙이다.
이 방정식을 보면, 2차 순서의 역학들이 전시될 것이 분명하다.[6] E1cB 메커니즘 운동학은 각 단계의 속도에 따라 약간 다를 수 있다. 결과적으로 E1cB 메커니즘은 다음과 같은 세 가지 범주로 나눌 수 있다.[7]
- E1cB는anion 카르바니온이 안정적이거나 기질을 초과하여 강한 베이스를 사용함으로써 탈조화가 불가역적으로 되고, 그 다음에 떠나는 집단의 요율결정 손실(k1[베이스] k2 k)이 뒤따르는 경우를 말한다.
- E1cB는rev 첫 번째 단계가 되돌릴 수 있지만 제품의 형성이 시작 물질에 대한 개혁보다 느릴 때 다시 두 번째 단계(k−1[콘주게이트산] ≫ k)에서 비롯된다2.
- E1cB는irr 첫 번째 단계가 느릴 때지만 음이온이 형성되면 제품이 빠르게 따라온다(k2 ≫ k−1[콘주게이트산]). 이것은 되돌릴 수 없는 첫 단계로 이어지지만 E1cB와anion 달리, 감속은 요율을 결정하는 것이다.
운동 동위원소 효과
중수소
중수소 교환과 중수소 운동 동위원소 효과는 E1cBrev, E1cBanion 및 E1cB를irr 구별하는 데 도움이 될 수 있다. 용제가 양성자이고 수소(예: CHOD3) 대신 중수소를 포함하는 경우, 양성자의 시작 물질로의 교환을 감시할 수 있다. 회수된 시동 물질에 중수소가 포함되어 있는 경우, 반응은 E1cB형rev 메커니즘을 거치고 있을 가능성이 높다. 상기, 이 메커니즘에서 카르바니온의 양성(결합산 또는 용매에 의한)은 떠나는 그룹의 손실보다 빠르다. 이것은 카르바니온이 형성된 후 용매에서 양성자를 빠르게 제거하여 출발 물질을 형성한다는 것을 의미한다.
반응제가 β 위치에서 중수소를 포함하는 경우, 일차 운동 동위원소 효과는 감응이 속도 결정임을 나타낸다. 세 가지 E1cB 메커니즘 중, 이 결과는 E1cB에서anion 동위원소가 이미 제거되었고 그룹 이탈이rev E1cB에서 결정되는 비율이기 때문에 E1cBirr 메커니즘과 일치할 뿐이다.
플루오린-19 및 탄소-11
운동동위원소 효과가 E1cB 메커니즘을 구별하는데 도움을 줄 수 있는 또 다른 방법은 F의 사용을 포함한다. 플루오린은 비교적 빈약한 이탈군이며, E1cB 메커니즘에 채용되는 경우가 많다. 불소 운동성 동위원소 효과는 의료연구의 방사선 의약품 및 기타 화합물의 라벨링에도 적용된다. 이 실험은 이탈 그룹의 손실이 메커니즘의 요율 결정 단계인지 아닌지를 결정하는 데 매우 유용하며 E1cB와irr E2 메커니즘을 구별하는 데 도움이 될 수 있다. 11C는 또한 전환 상태 구조의 특성을 조사하는 데 사용될 수 있다. 11C의 사용은 탄소 음이온의 형성뿐만 아니라 그 반응은 두 단계로 이루어지E1cB 메커니즘(로 서울 컬렉션 이분자성 제거 반응 메카니즘에 반대하), 하지만 그것은 또한은 더욱 3diffe을 구별할 수 있는 전이 상태 구조의 수명과 안정성을 해결할 수 있다는 것을 보여 주지 못할 수 있는 학문에 평생 공부하는 데 사용할 수 있다.rE1cB 메커니즘의 유형 [8]포함
알돌반응
E1cB 제거를 거치는 가장 잘 알려진 반응은 기본 조건에서 알돌 응축 반응이다. 이것은 에놀레이트 형성을 초래하는 카보닐 그룹을 포함하는 화합물의 감응을 포함한다. 에놀레이트(Enolate)는 출발 물질의 매우 안정적인 결합 베이스로, 반응의 매개체 중 하나이다. 이 에놀레이트는 핵포자 역할을 하며 전기영양 알데히드를 공격할 수 있다. 그리고 나서 알돌 제품은 또 다른 에놀레이트(Enolate)를 형성하고 E1cB 탈수 반응에서 수분을 제거한다. 알돌반응은 유기화학에서 핵심적인 반응인데, 이는 탄소-탄소 결합을 형성하는 수단을 제공해 보다 복잡한 분자의 합성을 가능하게 하기 때문이다.[9]
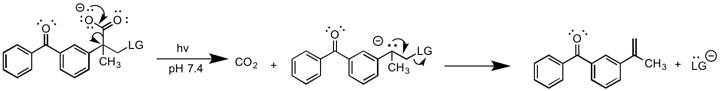
광 유도 E1cB
E1cB의 광화학 버전은 루크먼 외 연구진에 의해 보고되었다.[10] 이 보고서에서는 광화학적으로 유도된 데카르복실화반응이 카르바니온 중간을 생성하여 이후 이탈군을 제거한다. 이 반응은 카르바니온을 생성하기 위해 베이스를 필요로 하지 않기 때문에 다른 형태의 E1cB와는 독특하다. 카르바니온 형성 단계는 되돌릴 수 없으므로 E1cB로irr 분류해야 한다.
생물학에서
E1cB-제거 반응은 생물학에서 중요한 반응이다. 예를 들어, 당분해(penultimate step of glycolyis)는 E1cB 메커니즘을 포함한다. 이 단계에는 에놀라제 효소에 의해 촉진되는 2-인산소글리세레이트를 인산염피루베이트로 변환하는 과정이 포함된다.
참고 항목
참조
- ^ Grossman, R.B. (2008). The Art of Writing Reasonable Organic Mechanisms. New York: Springer. pp. 53–56. ISBN 978-0-387-95468-4.
- ^ Smith, Michael (2007). March's advanced organic chemistry reactions, mechanisms, and structure (6th ed.). Hoboken, N.J.: Wiley-Interscience. pp. 1488–1493. ISBN 978-1-61583-842-4.
- ^ Ouertani, Randa; El Atrache, Latifa Latrous; Hamida, Nejib Ben (2013). "Alkaline hydrolysis of ethiofencarb: Kinetic study and mechanism degradation". International Journal of Chemical Kinetics. 45 (2): 118–124. doi:10.1002/kin.20748. ISSN 0538-8066.
- ^ Hine, Jack; Burske, Norbert W.; Hine, Mildred; Langford, Paul B. (1957). "The Relative Rates of Formation of Carbanions by Haloforms1". Journal of the American Chemical Society. 79 (6): 1406–1412. doi:10.1021/ja01563a037. ISSN 0002-7863.
- ^ Baciocchi, Enrico; Ruzziconi, Renzo; Sebastiani, Giovanni Vittorio (1 August 1982). "Concerted and stepwise mechanisms in the eliminations from 1,2-dihaloacenaphthenes promoted by potassium tert-butoxide and potassium ethoxide in the corresponding alcohols". The Journal of Organic Chemistry. 47 (17): 3237–3241. doi:10.1021/jo00138a007.
- ^ McLennan, D. J. (1967). "The carbanion mechanism of olefin-forming elimination". Quarterly Reviews, Chemical Society. 21 (4): 490. doi:10.1039/qr9672100490. ISSN 0009-2681.
- ^ Smith, Michael (2007). March's advanced organic chemistry reactions, mechanisms, and structure (6th ed.). Hoboken, N.J.: Wiley-Interscience. pp. 1488–1493. ISBN 978-1-61583-842-4.
- ^ Matsson, Olle; MacMillar, Susanna (September 2007). "Isotope effects for fluorine-18 and carbon-11 in the study of reaction mechanisms". Journal of Labelled Compounds and Radiopharmaceuticals. 50: 982–988. doi:10.1002/jlcr.1443.
- ^ Wade, L.G. (2005). Organic Chemistry. New Jersey: Prentice Hall. pp. 1056–1066. ISBN 0-13-236731-9.
- ^ Lukeman, Matthew; Scaiano, Juan C. (2005). "Carbanion-Mediated Photocages: Rapid and Efficient Photorelease with Aqueous Compatibility". Journal of the American Chemical Society. 127 (21): 7698–7699. doi:10.1021/ja0517062. ISSN 0002-7863. PMID 15913358.


![The rate law and observed rate for the E1cB-elimination mechanism in the previous example where the base is ethoxide. {\displaystyle {\begin{aligned}{\frac {\ce {d[P]}}{{\ce {d}}t}}&={\frac {k_{1}k_{2}{\ce {[substrate][base]}}}{k_{-1}[{\ce {conjugate\ acid}}]+k_{2}}}\\{\ce {rate}}&=k_{\ce {obs}}{\ce {[substrate][base]}}\end{aligned}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/9fcaecea886d403f885d43b58cfb946af0778938)