탄수화물
Carbocation

탄수화물은 양전하 탄소 원자를 가진 이온이다. 가장 간단한 예로는 메테늄 CH+
3, 메타늄 CH+
5, 비닐 CH 양이
2+
3 있다. 때때로 둘 이상의 양전하 탄소 원자를 포함하는 탄화수화물도 만나게 된다(예: 에틸렌 다이케이션 CH
22+
4).[1]
1970년대 초까지 모든 탄화수소는 카르보늄 이온이라고 불렸다.[2] IUPAC에 의해 주어진 오늘날의 정의에서, 탄수화물은 탄소 원자에 상당한 부분적인 양의 전하를 가진 모든 짝수 전자의 양이온이다. 그들은 추가로 카베늄 이온에 3개, 카보늄 이온에 5개 등, 충전된 탄소의 조정 번호에 따라 두 가지 주요 범주에 분류된다. 이 명명법은 G. A에 의해 제안되었다. 올라.[3] 카보늄 이온은 원래 올라에서 정의한 바와 같이 3중 2전자의 소산성 결합 체계가 특징이며 본질적으로 C–C 또는 C–H σ-bonds를 브리징하는 탄화물인 이른바 '비분류 탄화체'와 동의어다. 그러나 다른 이들은 '카보늄 이온'이라는 용어를 2노르보닐 계화와 같은 비종류 탄화물을 배제하기 위해 공식적으로 양성 또는 알킬화 알칸(CR+
5, 여기서 R은 H 또는 알킬)으로 보다 좁게 정의했다.[4]
정의들
IUPAC에 따르면, 탄수화물은 양의 전하의 상당 부분이 탄소 원자 위에 있는 짝수 수의 전자를 포함하는 모든 양이온이다.[5] 올라와 동료들이 5개의 좌표 탄소를 관측하기 전에는 탄소와 카르보늄 이온이 서로 교환하여 사용하였다. 올라는 카보늄 이온의 정의를 어떤 종류의 3중 2전자 본딩도 특징으로 하는 탄수화물로 제안했고, 카베늄 이온은 3중 2전자 본드만 3중으로 짜여진 양전자를 가진 탄수화물을 지칭하는 카보늄 이온이 새롭게 만들어졌다. 그 후, 다른 사람들은 카보늄 이온이라는 용어를 보다 좁게 사용하여 알칸에 대한+ H나+ R의 전기적 공격으로부터 파생된 종(적어도 형식적으로)을 다른 주요 집단 오늄 종과 유사하게 언급하는 한편, 어떤 종류의 3중 중심 결합을 포함하는 탄소를 비종류 탄수화물이라고 한다. 이 용법에서 2노르보닐 양이온은 비록 브리지 구조로 인해 비급성 탄수화물이지만 알칸이 아닌 알켄(노르보넨)의 양성에서 정식으로 파생되기 때문에 카르보늄 이온이 아니다. IUPAC는 카르보늄 이온의 세 가지 상이한 정의를 인정하고 이 용어의 사용에 주의를 촉구한다. 이 글의 나머지 부분에 대해, 카르보늄 이온이라는 용어는 후자의 제한적 의미에 사용되며, 비 분류적 탄수화물은 브리징에 의해 소산된 C–C 및/또는 C–H σ-bonds를 가진 탄수화물을 지칭하는 데 사용된다.
1990년대 후반부터 대부분의 교과서는 고전적인 세 개의 좌표 탄수화물에 카르보늄 이온이라는 용어를 사용하는 것을 중단했다. 그러나 일부 대학 수준의 교과서는 카르베늄 이온과 동의어인 것처럼 카바노케이션이라는 용어를 계속 쓰거나 [6][7]카바늄 이온이나[8] 카르베늄, 카르보늄 이온이라는 오래된 용어를 잠깐 언급할 뿐 카바노케이션에 대해 논하고 있다.[9] 한 교과서는 카르베늄 이온에 대한 카보늄 이온의 옛 명칭을 오늘날까지 유지하고 있으며, CH에+
5 대해서는 고밸런트 카보늄 이온이라는 문구를 사용하고 있다.[10]
알켄에서 수화 이온(H−)을 공식적으로 제거하여 얻은 2개의 좌표 양탄소를 가진 탄소를 가진 탄소를 비닐 양이온이라고 한다. 기하학적 제약이 없을 때, 대부분의 대체 비닐 양이온들은 선형 기하학의 sp-hydridized 탄소 원자에 형식적인 양의 전하를 운반한다. 아레네에서 하이드라이드 이온을 공식적으로 제거함으로써 생기는 대략적으로 sp-하이브리드된2 양이온을 아릴 양이온이라고 한다. 이러한 탄화물은 상대적으로 불안정하며(아릴 양이 특히 그렇다) 자주 접하지 않는다. 그래서 도입부와 중급 교과서에서 누락되는 경우가 많다. IUPAC 정의는 탄화수소가 짝수 전자의 종이라고 규정하므로 질량 분광 분석에서 자주 만나는•+
4 CH와 같은 과격한 양이 탄화수소로 간주되지 않는다.
역사
탄화수소의 역사는 1891년 G[11]. Merling이 트로필리덴(사이클로헥타트리엔)에 브롬을 첨가한 뒤 제품을 가열해 결정성 수용성 물질인 CHBr을
7
7 얻었다고 보고한 때로 거슬러 올라간다. 그는 그것을 위한 구조를 제안하지는 않았지만, 도링과 녹스는[12] 그것이 열대우림(사이클로헥타리엔리움) 브롬화라는 것을 설득력 있게 보여주었다. 이 이온은 후켈의 통치에 의해 방향성이 있을 것으로 예측된다.
1902년 노리스와 케르만은 무색의 트리페닐메탄올이 농축 황산에 깊은 황색 용액을 제공한다는 사실을 독자적으로 발견했다. 염화 트리페닐메틸은 알루미늄과 주석 염소화물로 오렌지 콤플렉스를 유사하게 형성했다. 1902년 아돌프 폰 배이어는 형성된 화합물의 소금과 같은 성격을 인정했다. 안정적인 탄수화물 시스템으로서의 트리틀 탄수화물(아래에 표시)은 유기합성에서 균일한 유기촉매로 사용되어 왔다.[13]
그는 색과 염분 형성 할로크롬의 관계라고 불렀는데, 그 중 말라카이트 그린이 대표적인 예다.
탄화수소는 많은 유기 반응에서 반응하는 매개물이다. 1899년 줄리어스 스티글리츠가 처음 제안한 이 생각은 1922년 한스 미어웨인이 바그너-미어웨인 재배치에 대한 연구에서[15][16] 더욱 발전했다.[14] 탄화수소는 또한 S1N 반응, E1 반응, 휘트모어 1.2 교대 등의 재배열 반응에도 관여하는 것으로 밝혀졌다. 화학업소는 탄수화물의 개념을 받아들이기를 꺼렸고 오랫동안 미국화학학회지(Journal of American Chemical Society)는 이를 언급한 기사를 거부했다.
용액 내 안정적인 탄수화물의 첫 번째 NMR 스펙트럼은 1958년 Doering 외 [17]연구진에 의해 발표되었다. 헥사메틸벤젠을 염화메틸과 염화알루미늄으로 처리해 만든 헵타메틸벤젠 이온이었다. 안정적인 7노르보나디에닐 양이온은 1960년[18] 스토리 외 연구진에 의해 -80℃에서 이산화황에 함유된 노보나디에닐 염화물과 은화 사트라플루오보졸을 반응시켜 준비했다. NMR 스펙트럼은 비클래식 브리지(비클래식 이온이 관측된 최초의 안정적 비클래식 이온)임을 규명했다.
1962년 올라는 매직산에 테르트부틸 불소를 용해하는 안정적인 종으로서 핵자기 공명에 의한 테르트부틸 탄수화물을 직접 관찰했다. 노르보르닐 양이온의 NMR은 Schleyer [19]외 연구진에 의해 처음 보고되었고 Sunders 외 연구진에 의해 장벽 너머로 양성자 스크램블을 겪는 것으로 나타났다.[20]
구조 및 특성
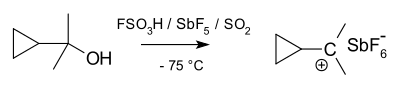
카르보늄 이온은 양성자 알칸이라고 생각할 수 있다. 알칸은 보통 불활성 상태로 간주되지만 초산성 조건(예: HF/SbF5)에서는 C-H 시그마 결합이 H에+ 대한 공여자 역할을 할 수 있다. 이것은 탄소가 상대적으로 흔하지는 않지만 붕소 화학에서 흔한 결합의 한 종류인 탄소 원자와 두 개의 수소 원자 사이의 3c-2e 결합을 포함하는 종을 낳는다. 대안적인 관점으로서, 카보늄 이온의 3c-2e 결합은 카르베늄 이온에 조화된 H의2 분자로 간주될 수 있다(아래 참조). 실제로 카르보늄 이온은 분자수소의 상실에 의해 자주 분해되어 상응하는 카르베늄 이온을 형성한다. 구조적으로 메탄늄 이온 CH는+
5 Cs 대칭의 최소 에너지 구조를 갖는 것으로 계산된다. 그러나 이온의 다양한 가능한 구조는 에너지가 가깝고 얕은 장벽에 의해 분리된다. 따라서, 이온의 구조는 종종 유속적인 것으로 묘사된다. 카르보늄 이온에서 탄소와 5개의 결합이 있는 것으로 보이지만, 3c-2e 결합 때문에 중심 탄소 주변의 전자 카운트가 8개에 불과하기 때문에, 그것들은 초밸런트가 아니다.
이와는 대조적으로, 적어도 형식적인 의미에서 카르베늄 이온은 카베니움이나 알켄의 양성(H의+ 추가)이나 알킬화(R의+ 추가)에서 파생된다. 따라서 적어도 하나의 공명 묘사에서 그들은 탄소의 발란스 껍질(옥텟 규칙)을 채우는 데 필요한 통상적인 옥텟 대신 전자 6개(발란스 전자)로 둘러싸인 형식 양전하를 가진 탄소 원자를 가지고 있다. 따라서 카르베늄 이온(및 일반적으로 탄화수소)은 반응하는 경우가 많아 발란스 전자의 옥텟을 채우고 중성 전하를 되찾으려 한다. VSEPR과 Bent의 규칙에 따라, 기하학적으로 피라미드(예: 1-아다만틸 양이온)가 되도록 제약을 받지 않는 한, 3-조정 카르베늄 이온은 보통 삼각 평면이며, 가장 낮은 빈 분자 궤도(LUMO)와 C(sp2) 궤도로부터 형성된 CH/CC 결합으로 빈 궤도상에 순수한 p 문자를 가지고 있다. 전형적인 예로는 메틸 양이온 CH가+
3 있다. 같은 이유로 2-조정(비닐 양이온)인 탄화체는 일반적으로 기하학에서 선형이며, C(sp) 궤도로부터 CH/CC 결합이 형성된다.
알킬 대체 탄화물은 하이드라이드 이온 친화력 값(CH3)3C+, (CH3)2CH+, (CH
3+
2)CH, CH, CH, CH의+
3 경우 (231, 246, 273, 312kcal/mol)으로 유추할 수 있듯이 안정성이 있는 3° > 1° > 메틸의 순서를 따른다.[21] 알킬 대체의 효과는 강한데, 3차 양이온이 안정적이고 많은 양이 초산성 매체에서 직접 관측할 수 있지만, 2차 양이온은 대개 과도하며 용액에서 이소프로필, s부틸, 사이클로펜틸 양이 관측되었을 뿐이다.[22] 과도성 매개체(에틸 양이 99.9% 황산과 FSUH2/SbF의5 반응을 위해 제안되었다)[23]로서 용액 단계에서 일차 탄화물에 대한 실험적인 지원은 거의 없으며, 메틸 양이 가스 단계에서 명확하게 식별되었을 뿐이다. 대부분의 경우, 일차 탄화물의 지상 상태는 두 개 이상의 탄소 원자에 의해 양전하가 공유되고 진정한 일차 양이 아닌 횡방향 정격 알켄, 에지 정격 사이클로프로판 또는 코너 정격 사이클로프로판으로 더 잘 설명되는 브리지 구조로 구성된다.[24][25] 심지어 단순한 에틸 계통인 CH조차
2+
5 가교될 수 있도록 실험적으로 그리고 계산적으로 증명되었고 대칭적으로 양성된 에틸렌 분자로 생각할 수 있다. 1-프로필과 1-부틸 양이온과 같은 상위 호몰로그램도 마찬가지다.[26] 네오펜틸 유도체는 메틸 그룹의 동반 이동으로 이온화되는 것으로 생각되므로(항암제 지원) 모든 경우는 아닐지라도 별개의 네오펜틸 양이온이 관여하는 것으로 간주되지 않는다.[27]
알킬 집단에 의한 안정화는 초융합에 의해 설명된다. β C-H 또는 C-C 결합에서 카보 위치의 빈 p 궤도(aCH/CC a → p interaction)로 전자 밀도를 기부하면 양의 전하가 소산될 수 있다.
하이드라이드 이온 친화력을 바탕으로 모체 비닐 양이온도 1차 sp-하이브리드2 탄화물보다 안정성이 떨어지는 반면, α 알킬-대체 비닐 양이온도 α는 후자에 버금가는 안정성을 가지고 있다. 따라서, 비닐은 비교적 흔치 않은 매개체다. 이들은 비닐 전기장치의 이온화에 의해 생성될 수 있다. 단, 이탈 그룹이 충분히 양호하다면(예: TfO−, IPh 또는2 N). 그들은 일부 비닐 대체 반응(S1N(비닐)로 지정됨)과 아릴랄키네스의 전기적 첨가 반응에 매개체로 관여되어 왔다. 가교종인 것으로 추정되는 부모비닐 양이온과 기하학적으로 제약된 순환비닐 양이온을 제외하면 대부분의 비닐 양이온들은 sp 잡종을 띠며 선형이다.
아릴 양이온은 비선형 기하학적 형상에 대한 링-강제 왜곡과 미사용 궤도상의 대략적인 sp문자로2 인해 비닐 양이온보다 불안정하다. 아릴디아조늄염에 함유된2 N만이 아릴 양이온의 화학적 생성을 위한 충분한 이탈군이다.
알키닐 양이온은 CH(수소+
3 이온 친화력 386 kcal/mol 대 CH의+
3 경우 312 kcal/mol)보다 훨씬 안정적이지 않고, 순수 화학적 방법으로 생성될 수 없다. 그러나 삼중수소의 베타 붕괴를 통해 방사화학적으로 생성될 수 있다.[28]
- RC≡CT → [RC≡]C3He]+ + e− + νe → RC≡C+ + 3He + e− + νe

반응성 측면에서 탄화물은 물, 알코올, 카르복실산염, 아지드화, 할로겐화 이온과 같은 핵성분들에 의해 공격받기 쉬워서 첨가물을 형성한다. 매우 기초적인 핵물질, 특히 방해가 되는 핵물질은 덧셈보다 제거를 선호한다. 약한 핵성분자라도 탄수화물에 반응하기 때문에 대부분은 슈퍼아키드와 같은 비핵성 매체에서만 직접 관찰되거나 격리될 수 있다.
카보케이션은 일반적으로 알킬 그룹이나 수소를 새로운 카보케이션 센터를 형성하기 위해 큐레이션 센터로 이동함으로써 덜 안정적인 구조에서 동등하게 안정적이거나 더 안정적인 구조로의 재배열 반응을 겪는다. 이는 종종 주변 온도에서 10초를10−1 초과하는 속도 상수에서 발생하며, -120 °C의 낮은 온도에서 (NMR 시간 척도와 비교) 빠르게 발생한다(와그너-메르바인 시프트 참조). 특히 2노르보닐 양이온과 같이 유리한 경우, 86 K(-187 °C)에서 X선 결정학을 간섭할 정도로 빠른 속도로 수소 이동이 여전히 발생할 수 있다.[29] 일반적으로 탄화수소는 3차 이성질체를 주기 위해 재배열된다. 예를 들어, CH의
6+
11 모든 이소머는 1-메틸-1-사이클로펜틸을 주기 위해 빠르게 재배열된다. 이 사실은 종종 합성 경로를 복잡하게 만든다. 예를 들어, 3-펜탄올을 수용성 HCl로 가열할 때, 처음에 형성된 3-펜탄올은 3-펜탄올과 2-펜탄올의 통계적 혼합으로 재배열된다. 이러한 양이온들은 염화 이온과 반응하여 약 3분의 1의 3-클로로펜탄과 3분의 2의 2-클로로펜탄을 생산한다. Friedel-Crafts 알킬화는 이러한 한계로 인해 고통 받고 있다. 이러한 이유로, 아킬레이트(Alkylated 제품을 주기 위한 Wolff-Kishner 또는 Clemmensen 감소에 따른)가 더 자주 적용된다.
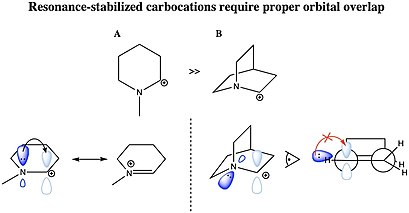
탄소는 탄소-탄소 이중 결합에 의한 공명 또는 이온화 탄소에 인접한 이질 원자의 단독 쌍에 의해 안정될 수 있다. 탄수화물이 공명 안정화되려면 기증 그룹의 분자 궤도에는 탄수화물의 빈 2p 궤도와 상호작용할 수 있는 적절한 대칭, 방향, 에너지 수준이 있어야 한다. π계통에서 양이온센터로 전자밀도를 기부하기 때문에 alliel cation CH
2=CH–CH+
2 및 벤질 양이온 CH
6
5–CH와 같은+
2 양이온들은 대부분의 다른 탄화수소보다 안정적이다. 더욱이 방향족 분자에 존재하는 탄화물은 특히 안정화되는데, 주로 방향족 고리의 탈초점화된 π 전자 특성 때문이다.[30] 아군이나 벤질 탄소를 형성할 수 있는 분자는 특히 반응적이다. C가+ 이중 또는 삼중 결합을 가진 다른 탄소 원자에 인접하는 이러한 탄화물은 탄화물의 빈 p 궤도(p 궤도)와 π 결합의 p 궤도(p 궤도)가 겹치기 때문에 추가적인 안정성을 가진다. 이러한 궤도 중첩은 양전하를 분산시키고 π계로부터의 전자밀도를 전자결핍중심과 공유하여 안정화시킨다. 이중 및 삼중 벤질 탄화수소, 디페닐카르베늄 및 트리페닐카르베늄(트리텔) 양이온은 특히 안정적이다. 같은 이유로 사이클로프로필 그룹에서 경색된 C-C 결합의 부분 p 특성도 전자 밀도의 기증을 허용하고 사이클로프로필메틸(사이클로프로필카비닐) 양이온을 안정화시킨다.
탄화수소의 안정성 순서는 하이드라이드 이온 친화도(HIA) 값으로 가장 안정적에서 가장 낮은 안정적(HIA 값 in kcal/mol in 괄호)과 같다.
| 탄수화물 | c-C 7H+ 7 (가장 안정적) | (C6H5)3C+ | c-C 3H+ 3 | (C6H5)2CH+ | 2노르보닐+ | t-C 4H+ 9 | CHC 6 5+ 2 | I-CH 3+ 7 |
|---|---|---|---|---|---|---|---|---|
| HIA(kcal/mol) | 201 | 215 | 221 | 222 | 231 | 231 | 234 | 246 |
| 탄수화물 | c-C 3H 5CH+ 2 | CH 2=CH-CH+ 2 | c-C 5H+ 5 | CHC-CH+ 2 | C 2H+ 5 | C 2H+ 3 | C 6H+ 5 | CH+ 3 (안정적) |
| HIA(kcal/mol) | 249 | 256 | 258 | 270 | 273 | 287 | 298 | 312 |
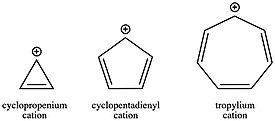
역사 부분에서 언급된 바와 같이, 열대우림 양이온(CH
7+
7)은 방향성 안정성으로 인해 최초로 발견된 탄화수소 중 하나이다. 이 탄수화물은 분자가 분리되어 소금으로 팔릴 수 있을 정도로 안정되어 있다. 반면 반자율 사이클로펜타디엔틸 양이온(CH
5+
5)은 약 40kcal/mol로 불안정하다. 사이클로프로페늄 양이온(CH
3+
3)은 각도 스트레인에 의해 다소 불안정하지만, 그것의 오픈 체인 아날로그인 아군 양이온과 비교할 때 방향성에 의해 여전히 명확하게 안정화된다. 링 시스템의 in 전자 수에 따라 이러한 변화된 양이온 안정성은 더 나아가 반응 운동학에서 결정적인 요인이 될 수 있다. 방향족 탄수화물의 형성은 반자동 또는 오픈체인 탄수화물의 형성에 비해 훨씬 빠르다. 예를 들어 S1과N 같은 많은 반응 체계에서 탄화물의 역할을 고려할 때, 특정 단계에 대한 속도 상수가 아르헤니우스 방정식에 따른 단계의 활성화 에너지에 따라 달라지기 때문에 시작 재료의 결합을 선택하는 것은 운동적 호감도 또는 불호감도를 부여하기 위한 강력한 방법이 될 수 있다.
탄화수소에 대한 과융합효과는 강하게 안정화되고 있다: 알킬 대체물을 사용한 과융합효과는 종종 π계통과의 결합보다 안정화되거나 심지어 더 많이 안정화된다. 불포화 그룹에 대한 결합은 중합 효과(재분산)에 의해 상당한 안정화를 가져오지만, 이 편익은 카보 위치 중심 옆에 더 많은 전기적2 sp 또는 sp 탄소의 존재에 의해 부분적으로 상쇄된다. 따라서 하이드라이드 이온 친화성에 의해 반사되는 것처럼, 2차 탄수화물은 아라이엘 양이온보다 안정화되는 반면 3차 탄수화물은 벤질 양이온보다 안정화되는데, 이는 언뜻 보기에 직관에 반하는 것처럼 보일 수 있는 결과들이다.
옥소카르베늄과 이미늄 이온은 탄소가 양전하를 띠는 중요한 2차 표준형식(리소스 구조)을 가지고 있다. 이와 같이, 가장 중요한 공진 기여자들이 각각 산소 또는 질소 원자에 대해 공식적인 양의 전하를 운반하기 때문에 일부 화학자들은 이들을 "진정한" 탄화물로 간주하지 않지만, IUPAC 정의에 따른 탄화물이다.
비클래식 이온
2-노르보닐 양이온과 같은 일부 탄화물은 대칭적인 3-중앙 2-전자 결합을 나타낸다. 비종류 탄화라고 불리는 그러한 구조물은 분자의 σ-프레임 구조에 관여하는 결합의 탈초점화를 수반하여, 분자 본드 순서의 C-C와 C-H 결합을 초래한다.[31] 이러한 소량화는 양이온의 추가적인 안정화를 초래한다. 예를 들어, 고전적인 카르베늄 이온으로 묘사되는 2-노르보닐 양이온이 2차 탄수화물인 것처럼 보인다. 그러나 일반적인 "2차" 탄수화물보다 안정성이 뛰어나며, 하이드라이드 이온 친화도에 따라 t-부틸 양이온과 같은 3차 탄수화물처럼 대략적으로 안정적이다.
비급속 탄화물의 존재는 한때 큰 논란의 대상이었다. 반대편에는 Herbert C가 있었다. 비분류 탄수화물로 보이는 것이 급속하게 평준화되는 두 종(또는 어느 정도의 브리징이나 기울어짐을 나타내는 두 가지 구조물)의 평균을 나타내며, 진정한 비분류적 구조는 두 잠재적 수수께끼 사이의 전환 상태라고 믿었던 브라운.Rgy Minima, 그리고 Saul Winstein은 대칭면을 가진 비클래식 구조물이 유일한 잠재적 에너지 최소라고 믿었고 고전적인 구조물은 이 비클래식 종의 공진 형태에 불과하다고 믿었다. 이 두 시나리오를 구별하기 위해 마틴 손더스가 개발한 매우 민감한 NMR 기법과 함께, 탄화수소를 직접 관찰할 수 있는 초산성 매체를 조지 올라가 발견한 것이 이 논란을 해결하는 데 중요한 역할을 했다.[32][33] 적어도 2노르바이닐 양이온 자체에 대해서는 6K의 낮은 온도에서도 퍼팅식 인터컨버전트 클래식 종들의 흔적은 찾아볼 수 없고, 뚜렷한 비클래식 구조를 보이는 2013년식 수정구조가 등장하면서 논란은 압도적으로 윈슈타인에게 유리하게 해결되었다.[34][29] 이제 다양한 탄화수소(예: 에틸 양이온, 위 참조)가 비클래식 구조를 채택하는 것으로 간주된다. 그러나, 많은 경우에 가능한 두 개의 "고전적" 구조와 "비고전적" 구조 사이의 에너지 차이는 매우 작으며, 두 가능성을 실험적으로 구별하기는 어려울 수 있다.
특정 탄화수소
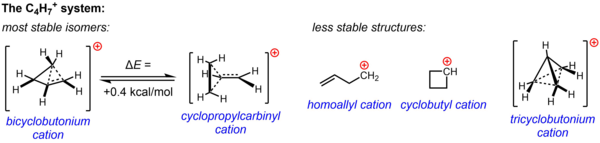
CH에
4+
7 대한 비분류적 구조는 비핵생성 매체에서 수행된 용혈성 실험과 NMR 연구의 실질적인 실험 증거에 의해 뒷받침된다. 다양한 실험에서 관찰된 반응성을 설명하기 위해 두 구조물 중 하나 또는 둘 다인 사이클로프로필카비닐 양이온과 사이클로부토늄 양이온을 호출한 반면, NMR 데이터는 온도 a에서도 C NMR 신호로 구성된 평균 스펙트럼을 제공하기 위해 급속한 재배열을 거치는 매우 유동적인 시스템을 가리킨다.s -132 °C만큼 낮음. 계산적으로 CH 시스템의
4+
7 에너지 넘치는 지형이 매우 평평하며, 실험 데이터를 바탕으로 가정된 두 이소머의 에너지가 매우 가깝다는 것이 확인되었으며, 사이클로프로필카르비닐 구조보다 0.4 kcal/mol이 더 안정적이라고 계산되고 있다. 용액 단계(SbF5·SOClF2·SOF22, SbF를–
6 반격으로 하는 경우)에서는 -61°C에서 84:16 비율의 사이클로프로필카르비닐 구조보다 자전거로부토늄 구조가 우세하다.
다른 세 가지 가능한 구조, 즉 두 개의 고전적 구조(호모릴 양이온과 사이클로부틸 양이온)와 보다 고도로 탈색된 비고전적 구조(트리시클로부토늄 이온)는 이제 덜 안정된 이소머(혹은 사이클로부틸 양이온의 경우 에너지 최소치보다는 전환 상태일 뿐)로 알려져 있다.[35]
대체된 사이클로프로필카르비닐 양이온도 NMR에 의해 연구되었다.[36][37]
디메틸 파생 모델의 NMR 스펙트럼에서 두 개의 비양각 신호가 두 메틸 그룹에 대해 발견되는데, 이는 이 양이온의 분자 순응이 거울 평면을 소유하는 수직이 아니라(A와 같이) 사이클로프로필 링 시스템에 평행한 빈 p-오르비탈과 (B와 같이) 이등분됨을 나타낸다.
구부러진 결합 이론의 관점에서, 이 선호도는 채운 사이클로프로판 구부러진 결합과 빈 p-오르비탈 사이의 유리한 궤도 중첩을 가정함으로써 설명된다.[38]
피라미드식 탄수화물
| 피라미드식 탄화물 | ||
|---|---|---|
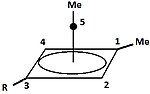 | 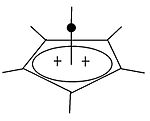 | 고전적 탄화물과 비전통적 탄화물 외에도 세 번째 등급인 피라미드식 탄화물을 구별할 수 있다. 이온들에서는 하나의 탄소 원자가 4면 또는 5면 다각형 위로 맴돌며, 사실상 피라미드를 형성한다. 사각 피라미드 이온은 +1, 펜타곤 피라미드 이온은 +2의 전하를 가진다. 대류삼투(CH77)3+의 안정적인 육각형 피라미드 구성도 예측됐다.[39] 이 경우 탄소의 조정 수는 7에 이른다. [C6(CH3)][6SbF6]2의 결정구조.HSOF는3 헥사메틸벤젠 도킹의 오각형-피라미달 모양을 확인한다.[40] |
| 모노밸런트 탄수화물의 예 | 분할 탄수화물의 예 |
참고 항목
참조
- ^ Grützmacher, Hansjörg; Marchand, Christina M. (1997). "Heteroatom stabilized carbenium ions". Coord. Chem. Rev. 163: 287–344. doi:10.1016/S0010-8545(97)00043-X.
- ^ Robert B. Grossman (2007-07-31). The Art of Writing Reasonable Organic Reaction Mechanisms. Springer Science & Business Media. pp. 105. ISBN 978-0-387-95468-4.
- ^ Olah, George A. (1972). "Stable carbocations. CXVIII. General concept and structure of carbocations based on differentiation of trivalent (classical) carbenium ions from three-center bound penta- of tetracoordinated (nonclassical) carbonium ions. Role of carbocations in electrophilic reactions". Journal of the American Chemical Society. 94 (3): 808–820. doi:10.1021/ja00758a020.
- ^ Sommer, J.; Jost, R. (2000-01-01). "Carbenium and carbonium ions in liquid- and solid-superacid-catalyzed activation of small alkanes". Pure and Applied Chemistry. 72 (12): 2309–2318. doi:10.1351/pac200072122309. ISSN 1365-3075.
- ^ "Carbocation", IUPAC Compendium of Chemical Terminology, International Union of Applied Chemistry, 2009, doi:10.1351/goldbook.C00817, ISBN 978-0967855097, retrieved 2018-11-03
- ^ McMurry, John. Organic chemistry (5th ed.). ISBN 978-0-534-37617-8.
- ^ Vollhardt, K. Peter C.; Schore, Neil Eric (2018). Organic chemistry: Structure and function (8th ed.). New York. ISBN 9781319079451. OCLC 1007924903.
- ^ Yurkanis Bruice, Paula (2004). Organic Chemistry (4th ed.). ISBN 978-0-13-140748-0.
- ^ Clayden, Jonathan; Greeves, Nick; Warren, Stuart; Wothers, Peter (2001). Organic Chemistry (1st ed.). Oxford University Press. ISBN 978-0-19-850346-0.
- ^ Fox, Marye Anne; Whitesell, James K. (1997). Organic Chemistry. ISBN 978-0-7637-0413-1.
- ^ Merling, G. (1891). "Ueber Tropin". Berichte der Deutschen Chemischen Gesellschaft. 24 (2): 3108–3126. doi:10.1002/cber.189102402151. ISSN 0365-9496.
- ^ Doering, W. von E.; Knox, L. H. (1954). "The Cycloheptatrienylium (Tropylium) Ion". Journal of the American Chemical Society. 76 (12): 3203–3206. doi:10.1021/ja01641a027.
- ^ "Discovery of an in situ carbocationic system using trityl chloride as a homogeneous organocatalyst". Tetrahedron. 69: 212–218. 2013. doi:10.1016/j.tet.2012.10.042.
- ^ "On the Constitution of the Salts of Imido-Ethers and other Carbimide Derivatives". American Chemical Journal. 21: 101. ISSN 0096-4085.
- ^ Meerwein, H.; Emster, K. van (1922). "About the equilibrium isomerism between bornyl chloride isobornyl chloride and camphene chlorohydrate". Berichte. 55: 2500.
- ^ Rzepa, H. S.; Allan, C. S. M. (2010). "Racemization of Isobornyl Chloride via Carbocations: A Nonclassical Look at a Classic Mechanism". Journal of Chemical Education. 87 (2): 221. Bibcode:2010JChEd..87..221R. doi:10.1021/ed800058c.
- ^ Doering, W. von E.; Saunders, M.; Boyton, H. G.; Earhart, H. W.; Wadley, E. F.; Edwards, W. R.; Laber, G. (1958). "The 1,1,2,3,4,5,6-heptamethylbenzenonium ion". Tetrahedron. 4 (1–2): 178–185. doi:10.1016/0040-4020(58)88016-3.
- ^ Story, Paul R.; Saunders, Martin (1960). "The 7-norbornadienyl carbonium ion". Journal of the American Chemical Society. 82 (23): 6199. doi:10.1021/ja01508a058.
- ^ Schleyer, Paul von R.; Watts, William E.; Fort, Raymond C.; Comisarow, Melvin B.; Olah, George A. (1964). "Stable Carbonium Ions. X.1 Direct Nuclear Magnetic Resonance Observation of the 2-Norbornyl Cation". Journal of the American Chemical Society. 86 (24): 5679–5680. doi:10.1021/ja01078a056.
- ^ Saunders, Martin; Schleyer, Paul von R.; Olah, George A. (1964). "Stable Carbonium Ions. XI.1 The Rate of Hydride Shifts in the 2-Norbornyl Cation". Journal of the American Chemical Society. 86 (24): 5680–5681. doi:10.1021/ja01078a057.
- ^ Anslyn, Eric V.; Dougherty, Dennis A. (2000). Modern Physical Organic Chemistry. Sausalito, CA: University Science Books. ISBN 978-1891389313.
- ^ Carroll, Felix A. (2010). Perspectives on structure and mechanism in organic chemistry (2nd ed.). Hoboken, N.J.: John Wiley. ISBN 9780470276105. OCLC 286483846.
- ^ Olah, George A.; O'Brien, Daniel H.; White, Anthony Mallinson. (October 1967). "Stable carbonium ions. LII. Protonated esters and their cleavage in fluorosulfonic acid-antimony pentafluoride solution". Journal of the American Chemical Society. 89 (22): 5694–5700. doi:10.1021/ja00998a036. ISSN 0002-7863.
- ^ Carey, Francis A. (2007). Advanced organic chemistry. Sundberg, Richard J. (5th ed.). New York: Springer. ISBN 9780387448978. OCLC 154040953.
- ^ Lowry, Thomas H. (1987). Mechanism and theory in organic chemistry. Richardson, Kathleen Schueller. (3rd ed.). New York: Harper & Row. ISBN 0060440848. OCLC 14214254.
- ^ Schultz, Jocelyn C.; Houle, F. A.; Beauchamp, J. L. (July 1984). "Photoelectron spectroscopy of 1-propyl, 1-butyl, isobutyl, neopentyl, and 2-butyl radicals: free radical precursors to high-energy carbonium ion isomers". Journal of the American Chemical Society. 106 (14): 3917–3927. doi:10.1021/ja00326a006. ISSN 0002-7863.
- ^ Yamataka, Hiroshi; Ando, Takashi; Nagase, Shigeru; Hanamura, Mitsuyasu; Morokuma, Keiji (February 1984). "Ab initio MO calculations of isotope effects in model processes of neopentyl ester solvolysis". The Journal of Organic Chemistry. 49 (4): 631–635. doi:10.1021/jo00178a010. ISSN 0022-3263.
- ^ Angelini, Giancarlo; Hanack, Michael; Vermehren, Jan; Speranza, Maurizio (1988-02-17). "Generation and trapping of an alkynyl cation". Journal of the American Chemical Society. 110 (4): 1298–1299. doi:10.1021/ja00212a052. ISSN 0002-7863.
- ^ a b Scholz, F.; Himmel, D.; Heinemann, F. W.; Schleyer, P. v R.; Meyer, K.; Krossing, I. (2013-07-05). "Crystal Structure Determination of the Nonclassical 2-Norbornyl Cation". Science. 341 (6141): 62–64. Bibcode:2013Sci...341...62S. doi:10.1126/science.1238849. ISSN 0036-8075. PMID 23828938.
- ^ Aue, Donald H. (2011). "Carbocations". WIREs Computational Molecular Science. 1 (4): 487–508. doi:10.1002/wcms.12. ISSN 1759-0884.
- ^ 엄밀히 말하면 알킬 대체 탄수화물의 고압 안정화는 3중심 결합의 일종이다. 기하학적으로 초점화에 관련된 C-H 결합은 그 결과로 탄수화물 중심 쪽으로 약간 "경계"되도록 관찰(또는 계산)된다(즉, C-C-H 결합 각도는 다소 감소한다). 그럼에도 불구하고 수소 원자는 여전히 주로 카본 α와 양이온 탄소에 결합되어 있다. 비종류 탄수화물로 자격을 얻으려면, 2 전자 3 중심 결합은 두 전자 결핍 센터에 균등하게(또는 거의 동등하게) 결합된 그룹을 특징으로 할 필요가 있다. 실제로, 인접한 집단의 약간의 관여(약한 초점화)에서부터 인접 중심들 사이의 집단의 동등한 공유(완전히 비표준적인 결합)까지 가능한 결합 체계가 연속적으로 존재한다.
- ^ Olah, George A.; Prakash, G. K. Surya; Saunders, Martin (May 2002). "Conclusion of the classical-nonclassical ion controversy based on the structural study of the 2-norbornyl cation". Accounts of Chemical Research. 16 (12): 440–448. doi:10.1021/ar00096a003.
- ^ 조지 A. 올라 - 노벨 강연회
- ^ Yannoni, C. S.; Myhre, P. C.; Webb, Gretchen G. (November 1990). "Magic angle spinning nuclear magnetic resonance near liquid-helium temperatures. Variable-temperature CPMAS spectra of the 2-norbornyl cation to 6 K". Journal of the American Chemical Society. 112 (24): 8991–8992. doi:10.1021/ja00180a060. ISSN 0002-7863.
- ^ Olah, George A.; Surya Prakash, G. K.; Rasul, Golam (July 2008). "Ab Initio/GIAO-CCSD(T) Study of Structures, Energies, and 13C NMR Chemical Shifts of C
4H+
7 and C
5H+
9 Ions: Relative Stability and Dynamic Aspects of the Cyclopropylcarbinyl vs Bicyclobutonium Ions". Journal of the American Chemical Society. 130 (28): 9168–9172. doi:10.1021/ja802445s. ISSN 0002-7863. - ^ Kabakoff, David S.; Namanworth, Eli (1970). "Nuclear magnetic double resonance studies of the dimethylcyclopropylcarbinyl cation. Measurement of the rotation barrier". Journal of the American Chemical Society. 92 (10): 3234–3235. doi:10.1021/ja00713a080.
- ^ Pittman Jr., Charles U.; Olah, George A. (1965). "Stable Carbonium Ions. XVII.1a Cyclopropyl Carbonium Ions and Protonated Cyclopropyl Ketones". Journal of the American Chemical Society. 87 (22): 5123–5132. doi:10.1021/ja00950a026.
- ^ Carey, F.A.; Sundberg, R.J. Advanced Organic Chemistry Part A (2nd ed.).
- ^ Wang, George; Rahman, A. K. Fazlur; Wang, Bin (May 2018). "Ab initio calculations of ionic hydrocarbon compounds with heptacoordinate carbon". Journal of Molecular Modeling. 24 (5): 116. doi:10.1007/s00894-018-3640-9. ISSN 1610-2940. PMID 29696384.
- ^ Malischewski, Moritz; Seppelt, K. (2016-11-25). "Crystal Structure Determination of the Pentagonal-Pyramidal Hexamethylbenzene Dication C
6(CH
3)2+
6". Angewandte Chemie International Edition. 56 (1): 368–370. doi:10.1002/anie.201608795. ISSN 1433-7851. PMID 27885766.