메타늄
Methanium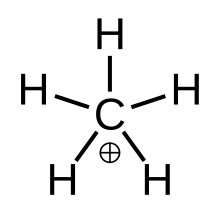 "True" 메타늄, 전이성 상태 CH+ 5 | |
 메타늄, CH 3(H 2)+ | |
| 이름 | |
|---|---|
| 기타 이름 카르보늄(다중 정의로 인해 발생)[1] | |
| 식별자 | |
3D 모델(JSmol) | |
펍켐 CID | |
| |
| |
| 특성. | |
| CH5+ | |
| 어금질량 | 17.050 g·190−1 |
| 콘게이트 베이스 | 메탄 |
| 구조 | |
| 삼위일체 | |
달리 명시된 경우를 제외하고, 표준 상태(25°C [77°F], 100 kPa)의 재료에 대한 데이터가 제공된다. | |
| Infobox 참조 자료 | |
화학에서 메탄늄은 공식[CH
3(H
2)]+을 가진 복잡한 양의 이온으로, 즉 1개의 탄소 원자가 수소 원자 3개와 1개의 수소 분자에 결합되어 있으며, +1의 전하를 가지고 있다. 그것은 초산성이며 오늄 이온 중 하나인데, 실제로 가장 단순한 카보늄 이온이다.
메탄늄은 희소성 기체 또는 초산물의 희석종으로서 실험실에서 생산될 수 있다. 1950년에 처음으로 준비되었고 1952년에 빅토르 탈로즈와 그의 조수 안나 콘스탄티노브나 류비모바에 의해 출판되었다.[2][3] 그것은 화학 반응에서 중간 종으로 발생한다.
메탄늄 이온은 암모니아(NH
3)에서 암모늄 이온(NH+
4)이 파생된 것과 유사하게 메탄(CH
4)의 이름을 따서 명명되었다.
구조
메타늄은 수소 분자가 3-중앙-2 전자 결합에서 공궤도와 상호작용하는 CH+
3 카르베늄 이온으로 시각화할 수 있다. H2 분자의 결합 전자 쌍은 3-중앙-2 전자 결합을 구성하는 두 개의 수소와 하나의 탄소 원자 사이에 공유된다.[4]
H2 분자의 두 수소 원자는 CH+
3 이온의 세 수소 원자와 지속적으로 위치를 교환할 수 있다(가성화, 특히 베리 메커니즘이라고 하는 순응 변화). 따라서 메탄늄 이온은 유동 분자로 간주된다. 교환을 위한 에너지 장벽은 상당히 낮으며 매우 낮은 온도에서도 발생한다.[5][6]
적외선 분광법은 메탄늄 이온의 다른 순응에 대한 정보를 얻기 위해 사용되어 왔다.[7][8][9] 플레인 메탄의 IR 스펙트럼에는 약 3000 cm의−1 대칭 및 비대칭 스트레칭에서 C-H 대역 2개와 대칭 및 비대칭 휨 진동에서 1400 cm−1 전후의 대역 2개가 있다. CH의+
5 스펙트럼에는 약 2800~3000 cm의−1 비대칭 스트레칭 진동, 1300 cm의−1 흔들림 진동, 1100 1300 cm의−1 굽힘 진동이 있다.
준비
메탄늄은 플루오로안티몬산(HF 수소의 펜타플루오리드 SbF
5)과 같은 매우 강한 산의 작용에 의해 메탄으로부터 준비될 수 있다.[10]
약 270 Pa의 압력과 주변 온도에서 메탄 이온 CH는+
4 메탄늄과 메틸 라디칼을 생산하기 위해 중성 메탄과 반응한다.[11]
- CH+
4 + CH
4 → CH+
5 + CH•
3
안정성과 반응
SbF
5 + HF와의 메탄 반응에 의해 얻은 양이온들은 HF 분자와의 상호작용에 의해 안정화된다.
낮은 압력(약 1 mmHg)과 주변 온도에서 메탄늄은 중성 메탄에 대해 비활성적이다.[11]
참고 항목
참조
- ^ Chemistry, International Union of Pure and Applied (2009). "carbonium ion". IUPAC Compendium of Chemical Terminology. IUPAC Compendium of Chemical Terminology. IUPAC. doi:10.1351/goldbook.C00839. ISBN 978-0-9678550-9-7. Retrieved 27 November 2018.
- ^ V. L. 탈로즈와 A. K. 류비모바, 도클. Akad. Nauk SSSR 86, 909-912 (1952) (In Russian: Тальрозе, В. Л., and А. К. Любимова. "Вторичные процессы в ионном источнике масс-спектрометра." ДАН СССР 86 (1952): 909-912)
- ^ Nikolaev, Eugene (1998). "Victor Talrose: an appreciation". Journal of Mass Spectrometry. 33 (6): 499–501. Bibcode:1998JMSp...33..499N. doi:10.1002/(SICI)1096-9888(199806)33:6<499::AID-JMS684>3.0.CO;2-C. ISSN 1076-5174.
- ^ Rasul, Golam; Prakash, G.K. Surya; Olah, George A. (2011). "Comparative study of the hypercoordinate carbonium ions and their boron analogs: A challenge for spectroscopists". Chemical Physics Letters. 517 (1–3): 1–8. Bibcode:2011CPL...517....1R. doi:10.1016/j.cplett.2011.10.020.
- ^ Schreiner, Peter R.; Kim, Seung-Joon; Schaefer, Henry F.; von Ragué Schleyer, Paul (1993). "CH+
5: The never‐ending story or the final word?". Journal of Chemical Physics. 99 (5): 3716–3720. doi:10.1063/1.466147. - ^ Müller, Hendrik; Kutzelnigg, Werner; Noga, Jozef; Klopper, Wim (1997). "CH5+: The story goes on. An explicitly correlated coupled-cluster study". Journal of Chemical Physics. 106 (5): 1863. Bibcode:1997JChPh.106.1863M. doi:10.1063/1.473340.
- ^ White, Edmund T.; Tang, Jian; Oka, Takeshi (1999). "CH+
5: The infrared spectrum observed". Science. 284 (5411): 135–7. Bibcode:1999Sci...284..135W. doi:10.1126/science.284.5411.135. PMID 10102811. - ^ Oskar Asvany, Padma Kumar P; Redlich, Britta; Hegemann, Ilka; Schlemmer, Stephan; Marx, Dominik (2005). "Understanding the infrared spectrum of bare CH+
5". Science. 309 (5738): 1219–1222. Bibcode:2005Sci...309.1219A. doi:10.1126/science.1113729. PMID 15994376. S2CID 28745636. - ^ Huang, Xinchuan; McCoy, Anne B.; Bowman, Joel M.; Johnson, Lindsay M.; Savage, Chandra; Dong, Feng; Nesbitt, David J. (2006). "Quantum deconstruction of the infrared spectrum of CH+
5". Science. 311 (5757): 60–63. Bibcode:2006Sci...311...60H. doi:10.1126/science.1121166. PMID 16400143. S2CID 26158108. - ^ Sommer, J.; Jost, R. (2000). "Carbenium and carbonium ions in liquid- and solid-superacid-catalyzed activation of small alkanes" (PDF). Pure and Applied Chemistry. 72 (12): 2309–2318. doi:10.1351/pac200072122309. S2CID 46627813.
- ^ a b Field, F. H.; Munson, M. S. B. (1965). "Reactions of gaseous ions. XIV. Mass spectrometric studies of methane at pressures to 2 Torr". Journal of the American Chemical Society. 87 (15): 3289–3294. doi:10.1021/ja01093a001.


