카르베늄 이온
Carbenium ion카르베늄 이온은 RR′R″C+ 구조를 가진 양의 이온, 즉 +1 정식 전하를 갖는 3가 탄소를 가진 화학종이다.
구 문헌에서는 카르보늄 이온이라는 명칭이 이 등급에 사용되었으나, 지금은 충전된 탄소가 펜타발렌트인 카르보늄 이온의 또 다른 계열을 독점적으로 지칭하고 있다.[1]현재의 정의는 1972년 화학자 조지 앤드루 올라에 의해 제안되었고,[2] 현재는 널리 받아들여지고 있다.
카르베늄 이온은 일반적으로 전자의 불완전한 옥텟을 가지기 때문에 반응성이 높지만, 대류리움 이온과 같은 특정 카르베늄 이온은 탄소 원자 사이에 양전하가 소산되어 상대적으로 안정적이다.
명명법
카르베늄 이온은 이온화 탄소에 결합하는 탄소 원자의 수가 1, 2, 3인가에 따라 1차, 2차, 3차로 분류된다. (메테늄, CH+
3 등 이온화 탄소에 부착된 탄소가 0개인 이온들은 보통 1차 등급에 포함된다.)
반응도
안정성은 일반적으로 충전식 탄소에 접합된 알킬 그룹의 수에 따라 증가한다.3차 탄화물은 2차 탄화보다 더 안정적이며(그리고 더 쉽게 형성된다) 과잉 결합에 의해 안정되기 때문이다.일차 탄화물은 매우 불안정하다.따라서 1차 카르베늄이 형성된다면 S1N 반응과 E1 제거 반응과 같은 반응은 일반적으로 발생하지 않는다.
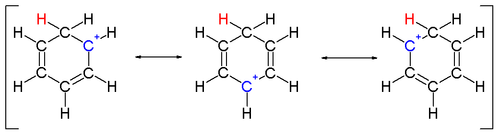
그러나 이온화 탄소와 이중 결합한 탄소는 공명에 의해 이온을 안정시킬 수 있다.아군 양이온, CH
2=CH-CH+
2, 벤질 양이온, CH-CH와
6
5+
2 같은 양이온들은 대부분의 다른 탄화수소보다 안정적이다.아군이나 벤질 카르베늄을 형성할 수 있는 분자는 특히 반응적이다.카르베늄 이온도 이질성에 의해 안정될 수 있다.[3]
카르베늄 이온은 10초9−1 이상의 속도 상수를 가진 안정성이 낮은 구조에서 동등하게 안정적이거나 더 안정적인 구조로의 재배열 반응을 겪을 수 있다.이 사실은 많은 화합물에 대한 합성 경로를 복잡하게 만든다.예를 들어, 펜탄-3-ol을 수용성 HCl로 가열할 때, 처음에 형성된 3-펜탄 탄수화물은 3-펜탄과 2-펜탄의 통계적 혼합물로 재배열된다.이러한 양이온들은 염화 이온과 반응하여 약 1:2의 비율로 3-클로로펜탄과 2-클로로펜탄을 생산한다.
카르베늄 이온의 종류
알킬리움 이온
카르베늄 이온은 강한 산성으로 하이드라이드 음이온 H를−
제거하면 알칸에서 직접 준비할 수 있다.예를 들어 안티몬 펜타플루오라이드(SBF
5)와 플루오르황산(FSOH
3)의 혼합물인 매직산은 이소부탄을 트리메틸카르베늄 양이온(CH
3)
3C로+
바꾼다.[4]
방향성 카르베늄 이온
대류 이온은 CH라는
7+
7 공식을 가진 방향족이다.[5]그것의 이름은 트로핀 분자에서 유래되었다.대류 계통의 염분은 안정적일 수 있다(예: 대류 계통 테트라플루오로보토).사이클로헥타트리엔(트로필리딘)과 브롬이나 인 펜타클로라이드[6](Pentachloride)로 만들 수 있다.
평면, 주기, 헵탄 이온이며, 또한 6㎛ 전자(4n + 2, 여기서 n = 1)를 가지고 있어 후켈의 방향족 지배를 충족시킨다.그것은 금속 원자에 대한 리간드로서 조정될 수 있다.
표시된 구조는 각 탄소가 양전하의 일부를 운반하는 7개의 공명 기여자로 이루어진 복합체다.
1891년 G. Merling은 사이클로헥타틴과 브롬의 반응으로 수용성 소금을 얻었다.[7]이 구조물은 에거스 도어링과 녹스에 의해 1954년에 해명되었다.[8][9]
또 다른 방향족 카르베늄 이온으로는 1970년 로널드 브레슬로와 존 T. 그로브스가 입수한 사이클로프로페닐 또는 사이클로프로페늄 이온 CH가
3+
3 있다.[10]열대지방에 비해 안정성은 떨어지지만, 이 카르베늄 이온은 실온에서도 염분을 형성할 수 있다.브레슬로우와 그로브스는 이러한 염분의 용액을 통해 방향성 카르베늄 이온에 대한 기대와 일치하는 분광 및 화학적 특성을 가진 것으로 밝혀졌다.
트리페닐메틸(트리플) 양이온
삼페닐카르베늄 또는 삼페닐메틸 양이온 [C(CH
6
5)]
3+
은 양전하를 탄소 원자의 10개(페닐 그룹 각각의 정형 및 파라 위치에 있는 3개의 탄소 원자와 중앙 탄소 원자를 더하여 분포시킬 수 있기 때문에 특히 안정적이다.트리페닐메틸 헥사플루오로인산염[C(CH
6
5)]
3+
[PF],
6−
트리페닐메틸 테트라플루오보화[C(CH
6
5)]
3+
화합물에 존재한다.BF
4],−
및 트리페닐메틸 과염소산염 [C(CH
6
5)]
3+
[ClO
4].−
[11]그것의 파생상품은 삼알메탄 염료를 포함한다.
아레늄 이온

아레늄 이온은 시클로헥사디엔아닐 양이온으로 전기영양 방향족 치환에서 반응성 중간으로 나타난다.[12]역사적 이유로 이 단지는 윌랜드 중간,[13] 즉 σ 복합단지로도 불린다.
하나의 탄소에 결합된 두 개의 수소 원자가 벤젠 고리에 수직인 평면에 놓여 있다.[14]아레늄 이온은 더 이상 방향족이 아니지만, 탈색화 때문에 비교적 안정적이다: 양전하가 다음의 공명 구조에서와 같이 π계를 통해 5개의 탄소 원자에 걸쳐 분산된다.
아레늄 이온의 안정성에 대한 또 다른 기여는 벤젠과 복잡한 전기영동체 사이의 강한 결합으로 인한 에너지 이득이다.
가장 작은 아레늄 이온은 양성자 벤젠, CH이다
6+
7.벤젠 이온은 카르보레인 슈퍼아시드 H(CBH(11CH3)5Br6)에 의해 벤젠이 양성될 때 안정적인 화합물로 격리될 수 있다.[15]벤제늄 소금은 최대 150 °C의 열 안정성을 가진 결정체다.X선 결정학에서 추론된 결합 길이는 사이클로헥사디아닐 양이온 구조와 일치한다.
아킬리움 이온
아실리움 이온은 RCO라는+ 공식을 가진 양이온이다.[16]구조는 R-C≡O+ 또는 R-=O로 설명된다.아킬 탄수화물의 합성 및 반응성 등가물이지만 실제 구조는 3중 결합에 의해 연결된 산소와 탄소를 가지고 있다.그러한 종은 일반적인 반응성 매개체로서, 예를 들어, 프리델-크래프트 아킬레이션에서는 하야시 재배치와 같은 다른 많은 유기 반응에서도 나타난다.아킬리움 이온을 함유한 염분은 아킬 할리드로부터 할로겐화물을 제거함으로써 생성될 수 있다.
- RCOCl + SbCl5 → RCO+SbCl−
6
이러한 양이온의 C-O 거리는 1.1 å스트룀에 가깝고 일산화탄소보다 더 짧다.[17]아킬리움 계수는 케톤 EI 질량 스펙트럼에서 관측된 특성 조각이다.
참고 항목
참조
- ^ IUPAC 골드 북 카르보늄 이온
- ^ "안정성 탄화수소.CXVIII.3중경계(클래식) 카르베늄 이온의 3중경계(클래식) 카바늄 이온의 분화에 기초한 카바늄의 일반적인 개념 및 구조.전기영역 반응에서 탄화수소의 역할" 조지 앤드류 올라; J. Am. 화학. Soc.; 1972; 94(3); 808–820.
- ^ 한스예르크 그뤼츠마허, 크리스티나 M.Marchand(1997), "Heteroatom 안정화 카르베늄 이온", Choords. Chem. Rev. 163, 287–344. doi:10.1016/S0010-8545(97)00043-X
- ^ 조지 A.올라와 요아힘 루카스(1967), "안정적인 카르보늄 이온"XLVII. 플루오슐폰산-안티몬 펜타플루오리드-술푸릴 클로로플루오르화물 용액에서 하이드라이드(알키이드) 이온 추상화를 통해 알칸에서 알킬카본륨 이온 형성이 이루어진다."J. Am. Chem. Soc. 89(18), 4739–4744 doi:10.1021/ja00994a030
- ^ IUPAC, 화학용어 종합편찬, 제2편.("금책")(1997년).온라인 수정 버전: (2006–) "분자". doi:10.1351/골드북.M04002
- ^ "Tropylium Tetrafluor" Organic Syntheses, Coll.제 5, 페이지 1138 (1973); 제 43, 페이지 101 (1963).Wayback Machine에 아카이브된 2012-08-29 링크
- ^ Merling, G.(1891), "Uber Tropin".베리히테 데르 도이체첸 게셀샤프트, 24: 3108–3126. 도이:10.1002/cber.189102402151
- ^ "The Cycloheptatrienylium (Tropylium) Ion" W. von E.도어링, L. H. 녹스 J. 암. Chem. Soc, 1954, 76 (12), pp 3203–3206 doi:10.1021/ja01641a027
- ^ "이질적 화학의 초석으로서의 자성" 알렉산드루 T. 발라반, 다니엘라 C.오니치우, 앨런 R. 카트리츠키 화학. 2004년 개정, 104(5), 2777–2812 doi:10.1021/cr0306790
- ^ "사이클로프로페닐 씨ation.합성 및 특성화." R. 브레슬로우와 J. T. 그로브스 J. Am. Chem. Soc. , 1970, 92 (4), 984–987 [1]
- ^ N. C. 데노, J. Jaruzelski, Alan Schresheim(1955) "카보늄 이온.I. 아릴카보늄 이온 평형관에서 파생된 산도함수(C0). J. am. Chem. Soc, 77 (11), 3044–3051. doi:10.1021/ja016a036
- ^ "안정성 탄화수소.CXVIII.3중경계(클래식) 카르베늄 이온의 3중경계(클래식) 카바늄 이온의 분화에 기초한 카바늄의 일반적인 개념 및 구조.전기영역 반응에서 탄화수소의 역할" 조지 A. Olah J. Am. Chem. Soc.; 1972; 94(3) 808–820; doi:10.1021/ja00758a020
- ^ "향기 분자 내 대체물질의 방향성에 대한 양자역학적 조사" G. W. Wiland J. Am. Chem. Soc.; 1942; 64(4) 900–908; doi:10.1021/ja01256a047
- ^ 유기화학에서의 메커니즘에 대한 안내서, Peter Sykes; 페이지 130–133
- ^ "벤제늄 이온 솔트 분해" 크리스토퍼 A.리드, 김기찬, 에브게니 S.스토야노프, 다니엘 스타스코, 푸크 S.Tham, Leonard J. Mueller, Peter D.W. 보이드 J. 암. Chem. Soc.; 2003; 125(7) 1796–1804; doi:10.1021/ja027336o
- ^ 화학용어, 아킬군 개요
- ^ Chevrier, B.; Le Carpentier, J. M.; Weiss, R. (1972). "Synthesis of two crystalline species of the Friedel–Crafts intermediate antimony pentachloride-p-toluoyl chloride. Crystal structures of the donor–acceptor complex and of the ionic salt". J. Am. Chem. Soc. 94 (16): 5718–5723. doi:10.1021/ja00771a031.