육불화 테크네튬
Technetium hexafluoride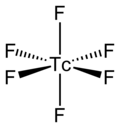 | |
| 식별자 | |
|---|---|
3D 모델(JSmol) | |
| 켐스파이더 | |
PubChem CID | |
| |
| |
| 특성. | |
| TcF6 | |
| 몰 질량 | 212 g/mol (98Tc) |
| 외모 | 황금빛의[1] 결정 |
| 밀도 | 3.58g/cm3(-140°C), 솔리드[2] |
| 녹는점 | 37.4°C(99.3°F, 310.5K)[1] |
| 비등점 | 55.3 °C (131.5 °F, 328.4 K)[1] |
| 구조. | |
| 입방체의 | |
달리 명시되지 않은 한 표준 상태(25°C[77°F], 100kPa)의 재료에 대한 데이터가 제공됩니다. | |
육불화테크네튬 또는 플루오르화테크네튬(VI)은6 녹는점이 낮은 노란색 무기화합물이다.그것은 [3]1961년에 처음 확인되었다.이 화합물에서 테크네튬은 할로겐화 테크네튬에서 볼 수 있는 가장 높은 산화상태인 +6의 산화상태를 가진다.또 다른 화합물은 염화테크네튬(VI)인6 TcCl이다.이 점에서 테크네튬은 헵타플루오르화물인 ReF를7 [4]형성하는 레늄과는 다르다.육불화 테크네튬은 우라늄의 핵분열 생성물(자연 우라늄의 자발적 핵분열, 재처리 우라늄의 원자로 내부의 유도 핵분열에 의한 오염 가능성)이기 때문에 육불화 우라늄의 불순물로 발생한다.우라늄과 테크네튬의 육불화물의 비등점이 매우 가깝다는 것은 핵 재처리에 불화물 휘발성을 사용하는 데 문제가 있음을 보여준다.
준비
육불화 테크네튬은 400°[3]C에서2 F를 초과하는 테크네튬 금속을 가열하여 제조합니다.
- Tc + 3
2 F → TcF
6
묘사
육불화 테크네튬은 상온에서 황색의 고체이다.녹는점은 37.4°C이고 끓는점은 55.3°[1]C이다.
육불화 테크네튬은 -4.54°C에서 고체상 전이를 겪습니다.이 온도(10°C에서 측정)를 초과하면 고체 구조는 입방체 구조입니다.격자 매개변수는 a = 6.16Ω이다.단위 셀당 두 개의 공식 단위(이 경우 이산 분자)가 있으며, 밀도는 3.02 g·cm이다−3.이 온도(-19°C에서 측정)에서 고체 구조는 직교혼합 공간군 Pnma이다.격자 매개변수는 a = 9.55Ω, b = 8.74Ω, c = 5.02Ω이다.단위 셀당 4개의 공식 단위(이 경우 이산 분자)가 있으며, 밀도는 3.38 g/cm이다−3.-140°C에서 고체 구조는 여전히 직교형이지만, 현재 격자 매개변수는 a = 9.360Ω, b = 8.517Ω, c = 4.934Ω으로 3.58g·[2]cm의−3 밀도를 제공한다.
TcF6 분자 자체(액체 또는 기체상에 중요한 형태)는 점군(Oh)을 갖는 8면체 분자 형상을 가집니다.Tc-F 결합 길이는 1.812Ω입니다.[2]그 자기 모멘트는 0.45μ로B [5]측정되었다.
특성.
물리적.
TcF는6 적외선과 라만 [6][7]스펙트럼에서 알 수 있듯이 8면체이다.RhF 및 [8]OsF와6 같은6 다른 금속 육불화물처럼 저온 정육면체 형태가 실온에서 대칭성이 높은 체심 입방체로 변환됩니다.자기 모멘트의 예비 측정값은 0.45µB로, 이는 d팔면체1 [9]화합물의 기대치보다 낮다.
화학의
TcF는6 요오드 펜타플루오르화물(IF5) 용액에서 알칼리성 염화물과 반응하여 헥사플루오로테네타이트를 [10][11]형성합니다.TcF는6 가수분해와 수성 NaOH의 불균형을 일으켜 TcO의2 [3]흑색 침전을 형성한다.플루오르화수소용액에서 TcF는6 플루오르화히드라지늄과 반응하여 NHTcF266 또는26 NH(TcF6)2[12]를 생성한다.
레퍼런스
- ^ a b c d CRC Handbook of Chemistry and Physics, 90판, CRC Press, 플로리다, 보카 라톤, 2009, ISBN978-1-4200-9084-0, 섹션 4, 무기 화합물의 물리 상수, 페이지 4-93.
- ^ a b c Drews, T.; Supeł, J.; Hagenbach, A.; Seppelt, K. (2006). "Solid State Molecular Structures of Transition Metal Hexafluorides". Inorganic Chemistry. 45 (9): 3782–3788. doi:10.1021/ic052029f. PMID 16634614.
- ^ a b c Selig, H.; Chernick, C.L.; Malm, J.G. (1961). "The Preparation and Properties of TcF6". Journal of Inorganic and Nuclear Chemistry. 19 (3–4): 377–381. doi:10.1016/0022-1902(61)80132-2.
- ^ Greenwood, Norman N.; Earnshaw, Alan (1997). Chemistry of the Elements (2nd ed.). Butterworth-Heinemann. ISBN 978-0-08-037941-8.
- ^ Selig, H.; Cafasso, F. A.; Gruen, D. M.; Malm, J. G. (1962). "Magnetic Susceptibility of ReF6". Journal of Chemical Physics. 36 (12): 3440. Bibcode:1962JChPh..36.3440S. doi:10.1063/1.1732477.
- ^ Howard H. Claassen; Henry Selig & John G. Malm (1962). "Vibrational Spectra of MoF6 and TcF6". Journal of Chemical Physics. 36 (11): 2888–2890. Bibcode:1962JChPh..36.2888C. doi:10.1063/1.1732396.
- ^ Howard H. Claassen; Gordon L. Goodman; John H. Holloway & Henry Selig (1970). "Raman Spectra of MoF6, TcF6, ReF6, UF6, SF6, SeF6, and TeF6 in the Vapor State". Journal of Chemical Physics. 53 (1): 341–348. Bibcode:1970JChPh..53..341C. doi:10.1063/1.1673786.
- ^ Siegel S, Northrop DA (1966). "X-Ray Diffraction Studies of Some Transition Metal Hexafluorides". Inorganic Chemistry. 5 (12): 2187–2188. doi:10.1021/ic50046a025.
- ^ Selig, H; Cafasso, F A.; Gruen, D M.; Malm, J G. (1962). "Magnetic Susceptibility of ReF6". Journal of Chemical Physics. 36 (12): 3440–3444. Bibcode:1962JChPh..36.3440S. doi:10.1063/1.1732477.
- ^ Edwards, A. J.; Hugill, D.; Peacock, R. D. (1963). "New Fluorine Compounds of Technetium". Nature. 200 (4907): 672. Bibcode:1963Natur.200..672E. doi:10.1038/200672a0. S2CID 4259399.
- ^ D. Hugill & R. D. Peacock (1966). "Some quinquevalent fluorotechnetates". Journal of the Chemical Society A: 1339–1341. doi:10.1039/J19660001339.
- ^ Frlec B; Selig H & Hyman H.H (1967). "Hydrazinium(+2) Hexafluorometalates(IV) and -(V) in the 4d and 5d Transition Series". Inorganic Chemistry. 6 (10): 1775–1783. doi:10.1021/ic50056a004.