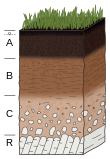
소아권
Pedosphere페더스피어(그리스어 πέΔδ pedon "땅" 또는 "지구"와 σφαρα 스파이라 "sphere"로부터)는 흙으로 구성되어 있으며, 토양 형성 과정의 대상이 되는 지구의 가장 바깥쪽 층이다. 그것은 암석권, 대기권, 수력, 생물권의 접점에 존재한다.[1] 소아권은 지구의 피부로서 대기권(토양의 안과 위), 생물권(생물체), 암석권(비통합적 퇴석 및 통합된 암반)과 수력(토양의 안, 위, 아래) 사이에 역동적인 상호작용이 있을 때만 발달한다. 페더스피어는 지구상 생명체의 기초다.
페더스피어는 화학적, 생물학적 화학적 유동성의 조정자 역할을 하며 기체, 광물적, 유체적, 생물학적 구성요소로 구성된다. 소아권은 식생, 소아권, 지하수 대수층 시스템, 퇴석 등을 포함하는 더 넓은 인터페이스인 임계 영역 내에 위치하며, 생물권과 하이드로스피어가 화학에 대한 중요한 변화를 중단하는 기반암에서 마침내 어느 정도 깊이에서 끝난다. 더 큰 지구 시스템의 일부로서, 토양이 형성되는 특정한 환경은 기후, 지질학, 생물학 및 인공적인 변화로서 지구상의 지리적 위치에만 영향을 받는다.
페더스피어는 생물권의 식물성 덮개 아래, 수력과 암석권 위에 있다. 토양 형성 과정(피질생식)은 생물학의 도움 없이 시작할 수 있지만 생물학적 반응이 있을 때 현저하게 빨라진다. 토양 형성은 암반 기질 위에 있는 초기 물질을 형성하기 위해 광물의 화학적 또는 물리적인 분해로부터 시작된다. 생물학은 암석을 분해하는 것을 돕는 산성 화합물을 분비함으로써 이것을 촉진시킨다. 특정한 생물학적 선구자들은 이끼, 이끼, 씨앗을 품고 있는 식물들이지만,[2] 초기 토양층의 화학적 구성을 다양화하는 다른 많은 무기체 반응들이 일어난다. 일단 풍화 및 분해 제품이 축적되면, 일관성 있는 토양 본체는 토양 프로파일을 통해 수직 및 횡방향으로 유체의 이동을 허용하여 고체, 유체 및 기체상 간에 이온 교환을 유발한다. 시간이 흐를수록 토양층의 대량 지질화학은 암반 초기 구성에서 벗어나 토양에서 일어나는 반응의 유형을 반영하는 화학으로 진화할 것이다.[3]
암석권
토양발달을 위한 1차 조건은 결국 토양이 형성될 바위의 화학적 구성에 의해 제어된다. 토양 프로파일의 기초를 이루는 암석 유형은 퇴적암(탄산염 또는 규산암), 화성암 또는 성암암(금속성 화성암) 또는 화산암과 메타볼카닉암인 경우가 많다. 암석 유형과 표면에서 그것의 노출을 이끄는 프로세스는 판구조론, 후속 변형, 상승, 침하 및 침적 이론의 기초 이론을 중심으로 한 연구 대상 특정 영역의 지역 지질학적 설정에 의해 제어된다.
관대하고 메타볼카닉한 바위는 크라톤에서 가장 큰 성분을 이루고 규소가 풍부하다. 화성암과 화산암도 규소암 함량이 높지만 비금속암과 함께 풍화 속도가 빨라지고 이온의 동원이 더욱 광범위하게 이뤄진다. 실리카가 많이 함유된 바위는 풍화제품으로 규산을 생산한다. 인(P)이나 질소(N)와 같이 생물학적으로 제한된 원소의 국부적인 농축으로 이어지는 암석은 거의 없다. 유기 물질을 보존하는 무산화 심층수 분지에 인산 셰일(< 15% PO25)과 인산염(< 15% PO25)이 형성된다.[4] 그린스톤(메타바살트), 필라이트 및 슈스터는 질소 풀의 30~50%까지 방출된다.[5] 탄산염 암석의 두꺼운 계승은 해수면이 상승하는 동안 종종 크래톤 여백에 축적된다. 탄산염과 증발 광물의 광범위한 용해는 수용액에서 Mg2+, HCO3−, Sr2+, Na+, Cl−, SO42− 이온의 상승으로 이어진다.[6]
광물의 풍화 및 용해
토양 형성 과정은 규산염 광물의 화학적 풍화작용에 의해 지배되며, 식물과 유기체를 개척하는 산성 생산물뿐만 아니라 대기에서 나오는 탄산이 투입된다. 탄산은 탄산화 반응을 통해 대기층과 토양층에서 생성된다.
석회석, 돌로마이트 등 탄산염 광물과 장석 등 규산염 광물이 분해되는 과정에서 화학적 풍화작용의 지배적인 형태다. 나펠츠파(Na-feldspar, albit)를 탄산에 의해 카올리나이트 점토를 형성하는 분해는 다음과 같다.
현장에서의 이러한 반응의 증거는 유출수에서3− 중탄산염, 나트륨, 실리카 이온의 상승된 수준일 것이다.
탄산염 광물의 분해:
- 또는[3]: ⟶ + C O -
탄소산(HCO23)과 중탄산염(HCO3)이 추가로 분해되면 CO2 가스가 발생한다. 산화작용도 많은 규산염 광물의 분해와 초기 토양 프로파일에서 2차 광물(디아게네시스)의 형성에 크게 기여한다. 올리빈의 산화(FeMgSiO4)는 Fe, Mg, Si 이온을 방출한다.[7] Mg는 물에 용해되어 유출로 운반되지만 Fe는 종종 산소와 반응하여 산화철인 FeO23(hematite)를 침전시킨다. 유기물이 부패하는 부산물인 유황도 철과 반응해 환원환경에서 피라이트(FeS2)를 형성한다. Pyrite 용해는 H+ 이온 상승과 FeO의23[3] 추가 강수로 인해 높은 pH 농도로 이어진다. 궁극적으로 환경의 redox 조건을 변화시킨다.
생물권
생물권의 입력은 이끼와 옥살산을 분비하는 다른 미생물로 시작할 수 있다. 이 미생물들은 이끼류 집단과 관련되거나 독립적으로 암석에 서식하는 것으로서 다수의 청록색 조류, 녹조류, 각종 곰팡이, 수많은 박테리아를 포함한다.[8] 리첸은 다음과 같은 진술이 시사하는 바와 같이 오랫동안 토양 발전의 선구자로 여겨져 왔다.
"암석의 토양으로의 초기 전환은 선구자 이끼와 그 후계자인 이끼에 의해 진행되는데, 이 이끼는 머리카락 같은 이끼가 표면을 미세먼지로[9] 분해하는 데 뿌리의 역할을 한다."
그러나 씨앗을 가진 식물이 한 지역을 차지하고 이끼보다 빨리 식민지화할 수 있다는 것이 문서화되었기 때문에, 이끼는 반드시 유일한 개척 유기체나 가장 초기 형태의 토양 형성은 아니다. 또한, 어금니 침전물은 침전물의 축적 속도를 높일 수 있다. 그럼에도 불구하고, 이끼는 확실히 대부분의 혈관 식물들보다 더 가혹한 조건을 견뎌낼 수 있고, 비록 그들이 더 느린 식민지배를 가지고 있지만, 고산지대에서 지배적인 집단을 형성한다.
식물 뿌리에서 방출되는 산은 아세트산과 구연산을 포함한다. 유기물이 부패하는 동안 페놀산은 식물 물질에서 배출되고, 유머와 풀빅산은 토양 미생물에 의해 배출된다. 이러한 유기산은 킬레이트라고 알려진 공정에서 몇몇 풍화 제품과 결합함으로써 화학 풍화 속도를 높인다. 토양 프로파일에서, 유기산은 종종 꼭대기에 집중되는 반면, 탄산은 대수층에서 바닥이나 아래쪽으로 더 큰 역할을 한다.[3]
토양 기둥이 더 두꺼운 축적으로 발전함에 따라, 더 큰 동물들이 토양에 거주하게 되고 각각의 틈새의 화학적 진화를 계속 변화시킨다. 지렁이는 토양에 공기를 불어넣고 다량의 유기 물질을 풍부한 유머로 전환시켜 토양 다산을 향상시킨다. 굴을 파고 있는 작은 포유류들은 먹이를 저장하고, 어리게 자라고, 토양 진화의 진로를 바꾸는 페달권에서 동면할 수 있다. 지상 위 대형 포유류 초식동물은 질소가 풍부한 노폐물과 인이 풍부한 뿔의 형태로 영양분을 운반하는 반면 포식자들은 인이 풍부한 뼈 더미를 토양 표면에 남겨두면서 아래 토양의 국부적 농축을 주도한다.
습지 토양 내 레독스 상태
호수와 민물 습지대의 영양분 순환은 리독스 상태에 크게 의존한다.[3] 몇 밀리미터 이하의 물 이형성 박테리아는 신진대사를 하여 산소를 소비한다. 그러므로 그들은 산소의 토양을 고갈시키고 혐기성 호흡의 필요성을 만들어낸다. 혐기성 미생물 공정 중에는 변성화, 황산염 감소, 메탄노제시스 등이 있으며 N2(질소), HS2(황화수소), CH4(메탄)의 방출을 담당한다. 다른 혐기성 미생물 과정은 철과 망간의 산화 상태의 변화와 연관되어 있다. 혐기성 분해의 결과, 토양은 분해가 불완전하기 때문에 많은 양의 유기 탄소를 저장한다.[3]
리독스 전위는 산소 결핍 토양에서 화학 반응이 어떤 방식으로 진행되며 침수된 시스템에서 영양소 순환을 제어하는지 설명한다. 리독스 전위(redox probled) 또는 환원 전위(redox probled)는 환경이 전자를[3] 수신하여 감소할 가능성을 나타내는 데 사용된다. 예를 들어, 시스템이 이미 많은 전자(아산화, 유기농이 풍부한 셰일)를 가지고 있다면, 그것은 감소되고, 화학적 경사로에 평준화되도록 전자 농도가 낮거나 산화된 환경을 가진 시스템의 일부에 전자를 기증할 가능성이 높다. 산화 환경은 높은 redox 잠재력을 가지고 있는 반면, 감소된 환경은 낮은 redox 잠재력을 가지고 있다.
리독스 전위는 화학종 pH의 산화 상태와 시스템에 존재하는 산소량(O2)에 의해 제어된다. 산화 환경은 전자 수용체 역할을 하는 O의2 존재 때문에 전자를 받아들인다.
이 방정식은 낮은 pH 수준에서 더 높은 리독스 전위를 발견하게 하는 산성 조건에서 오른쪽으로 이동하는 경향이 있을 것이다. 이질성 유기체인 박테리아는 산소의 토양을 고갈시키는 유기물을 분해하면서 산소를 소비하고, 따라서 리독스 전위를 증가시킨다. 낮은 리독스 조건에서 철철(Fe2+)의 침적은 분해율이 감소함에 따라 증가하게 되어 유기 잔해를 보존하고 유머를 축적하게 된다. 높은 리독스 전위에서는 산화된 형태의 철인 철철(Fe3+)이 일반적으로 헤마이트로 침전된다. X선 형광학(XRF) 또는 유도결합 질량분석(ICP-MS)과 같은 분석적 지질화학 도구를 사용하여 고대 암석에서 Fe(Fe2+ 및 Fe3+)의 두 형태를 측정할 수 있으므로 고대 토양에 대한 리독스 전위를 결정할 수 있다.
이런 연구는 일본과 브리티시 컬럼비아주에서 트라이아스기 암석(3억~2억년)을 통해 퍼미언에 대해 이뤄졌다. 지질학자들은 초기 및 중간 Permian에서 헤마이트를 발견했지만, Permian 끝 부근의 고대 토양과 트라이아스기에 있는 피라이트에서 철분의 감소된 형태를 발견하기 시작했다. 이는 페름 후기 동안 조건이 산소가 풍부하지 않게 되었고, 심지어 양극성까지 줄어들어 결국 지구 역사상 가장 큰 멸종인 P-T 소멸로 이어졌음을 시사한다.[10]
무산화 토양이나 환원 토양에서의 분해는 또한 유황 감소 박테리아에 의해 수행되는데, O는2 SO를42− 전자 수용체로 사용하는 대신 황화수소(HS2)와 이산화탄소를 생산한다.
HS2 가스는 위쪽으로 스며들어 Fe와2+ 반응하며 피라이트를 침전시켜 독성 HS2 가스의 함정으로 작용한다. 그러나 HS는2 여전히 습지 토양에서 배출되는 많은 양의 배출물이다.[11] 대부분의 민물 습지에는 황산염(SO42−)이 거의 없기 때문에 황산염이 고갈될 때만 메탄유전자균에 의한 분해의 지배적인 형태가 된다. 셀룰로오스 발효의 부산물인 아세트산염은 메탄 유발세균에 의해 분열돼 대기 중으로 방출되는 메탄(CH4)과 이산화탄소(CO2)를 생산한다. 메탄은 또한 같은 박테리아에 의해2 CO가 감소하는 동안 배출된다.[3]
대기
페더스피어에서는 기체가 대기와 평형을 이루고 있다고 가정해도 무방하다.[6] 식물 뿌리와 토양 미생물은 토양에2 CO를 방출하기 때문에 토양수에서 중탄산염(HCO3)의 농도가 대기와의 평형상태에서보다 훨씬 높으며,[12] CO의2 고농도 및 토양용액에서 금속이 발생하여 토양에서 pH 농도가 낮아진다. 페더스피어에서 대기권으로 빠져나가는 기체에는 탄산염 분해, 분해, 리독스 반응, 미생물 광합성 등의 기체 부산물이 포함된다. 대기에서 나오는 주요 입력물은 애올리언 침전, 강우, 가스 확산이다. 얼리안 침전물에는 바람에 의해 막힐 수 있거나 공기 중에 무기한으로 매달려 있는 모든 것이 포함되어 있으며, 다양한 에어로졸 입자, 꽃가루와 먼지 같은 생물학적 입자와 순수한 석영 모래를 포함한다. 수증기가 에어로졸 입자를 이용해 빗방울을 핵으로 만들기 때문에 질소는 비(물 이후)에서 가장 풍부한 성분이다.[3]
숲 속의 흙
토양은 우거진 층, 큰 나무와 그곳에 사는 동물들의 풍부한 다양성이 제안하는 것처럼 숲에서 잘 발달되어 있다. 숲에서 강수량은 증발량을 초과하여 토양층을 통해 아래쪽으로 스며드는 물의 과잉을 초래한다. 분해 속도가 느려지면 다량의 풀빅산이 발생하여 화학적 풍화작용이 크게 향상된다. 화학적 풍화작용과 함께 아래쪽으로 스며들어 마그네슘(Mg), 철(Fe), 알루미늄(Al)을 토양에서 침출하여 아래로 운반하는데, 이를 포드졸라이제이션(podzolization이라고 한다. 이 과정은 토양층의 외관과 화학에서 두드러진 대비를 초래한다.[3]
열대 지방의 토양
열대림(우림)은 지구의 다른 어떤 환경보다 긴 생장기에 걸쳐 더 많은 불임과 강우량을 받는다. 이러한 기온 상승, 오수 및 강우량 증가로 인해 바이오매스는 1평방미터당 800그램에 달하는 탄소를 생산하게 된다.[3] 더 높은 온도와 더 많은 양의 물은 더 높은 화학적 풍화율의 원인이 된다. 분해율이 증가하면 적은 양의 풀빅산이 과채취되어 활성 풍화구역에서 금속을 침출하게 된다. 따라서, 숲의 토양과 극명한 대조를 이루는 열대 우림은 포드졸화 현상이 거의 또는 전혀 없으므로 토양층과 뚜렷한 시각적, 화학적 대조를 가지지 않는다. 대신 이동금속인 Mg, Fe, Al은 산화광물로 침전되어 흙에 녹슨 붉은 색을 준다.[3]
초원과 사막의 흙
초원의 강수량은 증발량과 같거나 그 이하가 되며, 상대적인 가뭄에서 토양발전을 유발한다.[3] 따라서 풍화 제품의 침출과 이주는 감소한다. 다량의 증발은 칼슘(Ca)과 다른 큰 양이온의 상층토양 면적에 점토 미네랄과 풀빅산의 축적을 유발한다. 불침투성 점토는 물과 풀빅산의 아래쪽으로 스며들어 화학적 풍화작용과 포졸화를 감소시킨다. 점토의 최대 농도까지 깊이는 강수량 증가와 침출량 증가 지역에서 증가한다. 침출량이 줄어들면, Ca는 caliche라고 알려진 층인 낮은 토양 레벨에서 석회암(CaCO3)으로 침전된다.
사막은 초원과 비슷하게 행동하지만 강수량이 증발 가스보다 적기 때문에 지속적인 가뭄에 운영된다. 화학적 풍화 작용은 초원에서보다 더 느리게 진행되며, 칼리체 층 아래는 석고층과 할라이트 층일 수 있다.[3] 사막의 토양을 연구하기 위해, 행상학자들은 토양 층의 타이밍과 개발을 연관시키기 위해 연대기 개념을 사용해 왔다. P는 시스템에서 매우 빨리 침출되어 나이가 들수록 감소하는 것으로 나타났다.[13] 게다가 토양 내 탄소 축적은 분해 속도가 느려서 감소한다. 그 결과, 생물 지질화학 주기에서 탄소 순환 속도가 감소한다.
참조
- ^ 엘리사 레빈, 2001년, 허브로서의 페더스피어
- ^ Cooper, R. (1953). "The Role of Lichens in Soil Formation and Plant Succession". Ecology. 34 (4): 805–807. doi:10.2307/1931347. JSTOR 1931347.
- ^ Jump up to: a b c d e f g h i j k l m n o p q r Schlesinger, W.H..; Bernhardt, E.S. (2013). Biogeochemistry: an analysis of global change (3rd ed.). Oxford: Academic Press. ISBN 978-0123858740.
- ^ Boggs, S, Jr. 1995, 침전물과 성층부의 원리. 미국 NJ, 프렌티스 홀
- ^ Holloway, J.; Dahlgren, R. (1999). "Geologic nitrogen in terrestrial biogeochemical cycling". Geology. 27 (6): 567. Bibcode:1999Geo....27..567H. doi:10.1130/0091-7613(1999)027<0567:GNITBC>2.3.CO;2.
- ^ Jump up to: a b c Faure, G, 1998, 지구화학의 원리 및 적용, 600 pp, 프렌티스홀, NJ, 어퍼 새들 리버.
- ^ Grandstaff, D, 1986, 하와이 해변 모래에서 추출한 포스테라틱 올리빈의 분해율: 암석과 광물의 화학적 풍화율, 페이지 41~59.
- ^ Chen, J.; Blume, H.-P.; Beyer, L. (2000). "Weathering of rocks induced by lichen colonization — a review". CATENA. 39 (2): 121–146. doi:10.1016/S0341-8162(99)00085-5.
- ^ 클리멘트스, F.E., 그리고 쉘포드, V.E., 1939, 생물학. 뉴욕 주, 존 와일리
- ^ Isozaki, Y. (1997). "Permo-Triassic Boundary Superanoxia and Stratified Superocean: Records from Lost Deep Sea". Science. 276 (5310): 235–238. doi:10.1126/science.276.5310.235. PMID 9092467.
- ^ 켈리, D, 스미스, 1990년, 환경 내 유기 황 화합물: 생물화학, 미생물학, 생태학적 측면: 미생물 생태계의 진보, v. 11, 페이지 345–385.
- ^ Piñol, J.; Alcañiz, J.M.; Rodà, F. (1995). "Carbon dioxide efflux and pCO2 in soils of three Quercus ilex montane forests". Biogeochemistry. 30 (3): 191–215. doi:10.1007/BF02186413.
- ^ Lajtha, K.; Schlesinger, W.H. (1988). "The Biogeochemistry of Phosphorus Cycling and Phosphorus Availability Along a Desert Soil Chronosequence". Ecology. 69 (1): 24–39. doi:10.2307/1943157. JSTOR 1943157.