유기화학
Organoarsenic chemistry유기농 화학은 비소와 탄소 사이의 화학적 결합을 포함하는 화합물의 화학적 화학이다. "유기농"이라고도 불리는 몇몇 유기농 화합물은 살충제, 제초제, 진균제로 사용되면서 산업적으로 생산된다. 일반적으로 이러한 애플리케이션은 환경과 인간 건강에 미치는 영향에 대한 우려가 증가함에 따라 감소하고 있다. 모화합물은 아르신과 비산이다. 유기 분자는 독성에도 불구하고 잘 알려져 있다.
역사
현재 경미하게 여겨지고 있는 분야로서는 놀라운 일이지만, 유기농 화학은 화학의 역사에서 중요한 역할을 했다. 가장 오래된 것으로 알려진 유기농 화합물인 악취 카카오디는 "카코딜" (1760)에서 보고되었으며, 때로는 최초의 합성 유기농 화합물로 분류되기도 한다. 살바산 화합물은 폴 에를리히의 노벨상을 받은 최초의 의약품 중 하나이다. 이전에 항생제(Solarson) 또는 기타 의학적 용도로 사용된 것으로 발견된 다양한 기타 유기농 화합물.[1]
종합 및 분류
비소는 일반적으로 산화 상태(III)와 (V)에서 발생하며, 할로겐화 AsX3(X = F, Cl, Br, I)와 AsF에5 의해 도해된다. 이에 상응하여, 유기화합물은 이 두 산화상태에서 흔히 발견된다.[2]
히드록시성 화합물은 다음과 같이 알려져 있다.[2]
- 방화산(RA(OH),2 희소산(As(OH))3은 잘 알려져 있다)
- 아르신산(RAs2)OH), 희귀함
- 아르신산(RA2(O)OH), 공통(Cacodylic acid(R = CH3)에 의해 설명됨
- 방화산(RA(O)(OH),2 공통으로 페닐라르손산(R = CH65)으로 설명됨
Organoarsenic(V
비소(V) 화합물은 일반적으로 기능 그룹 RAsO(OH)2 또는 RAsO2(OH)를 특징으로 한다(R = 알킬 또는 아릴). 비소 화합물의 생체해제는 메탄네우네이트의 형성과 함께 시작된다. 따라서 3가 무기 비소 화합물을 메틸화하여 메탄올에베소네이트를 투여한다. S-adenosylmethionine은 메틸 기증자다. 메탄올레오네이트는 디메틸아르소네이트의 전구체로서, 다시 (메틸아르소누스산에) 환원 주기에 의해 두 번째 메틸화(methylarsonous acid)가 뒤따른다.[3] 이 디메틸 화합물은 카코딜산(CH3)2As이다.OH2), 유기농 화합물의 화학 작용 전반에 걸쳐 두드러지게 나타난다. 이와는 대조적으로 디메틸인포스폰산은 인의 해당 화학작용에서 덜 유의미하다. 카카오실산은 산화비소의 메틸화에서 발생한다. 페닐라르손산은 아닐린과 비소의 반응, 이른바 베샹 반응으로 접근할 수 있다.
모노메틸화산인 메탄네소스산(CHAsO3(OH))2은 쌀과 면화 재배에서 곰팡이균(전통명 네오아소진)의 전구체다. 페닐라르손산(CHAsO65(OH))2의 파생상품은 4-히드록시-3-니트로벤제네어손산(3-NHPAA 또는 록사손), 우리도페닐라르손산, p-아르사닐산 등 가축용 사료첨가물로 사용된다. 이러한 용도는 환경에 수용성 형태의 비소를 도입하기 때문에 논란이 되고 있다.
유기 리간드만 함유한 비소(V) 화합물은 드물며, 주성분은 펜타페닐 파생상품인 AS(CH65)이다.5[4]
Organoarsenic(III) 화합물 및 용도
그러한 화합물은 대부분 유기석소 및 그리그나드 시약을 사용하여 AsCl과3 그 파생상품을 알키플레이션하여 제조한다.[4] 예를 들어 트리메틸아신(CH3)3As, 디메틸아르센 염화물(CH3)2AsCl, 메틸아르센 디클로로이드(CHAsCl32) 시리즈가 알려져 있다. 하이드라이드 환원 시약으로 염화물 유도체를 감소시키면 디메틸라신(CH3)2AsH(AsH)과 메틸라신(CHAsH32)과 같은 해당 하이드라이드가 발생한다. 유사한 조작이 다른 유기농 염화물 화합물에도 적용된다.
디메틸라르센 화합물에 대한 중요한 경로는 카카오실산 감소로 시작한다(위 참조).
- (CH3)2AsO2H + 2 Zn + 4 HCl → (CH3)2AsH + 2 ZnCl2 + 2 H2O
- (CH3)2AsO2H + SO2 + HI → (CH3)2AsI + SO3 + H2O
비소(III)를 함유한 다양한 이질세포가 알려져 있다. 피롤의 비소 아날로그인 아솔레와 피리딘의 비소 아날로그인 아르사벤젠이 그것이다.
대칭 유기농(III) 화합물(예: 트리메틸라신 및 트리페닐라신)은 일반적으로 조정 화학에서 리간드로 사용된다. 그들은 인산 리간드처럼 행동하지만 덜 기초적이다. diars로 알려진 diarsine CH64(As(CH3))22는 chilating ligand이다. 토린은 여러 금속의 지표다.
Organoarsenic(I) 화합물 및 용도
상업적 용도와 숫자로 볼 때 가장 중요하지 않은 것은 유기농(I) 화합물이다. 항생리제 살바산과 네오살바산이 이 반을 대표한다. 이러한 화합물은 일반적으로 As와 3개의 결합을 특징으로 하지만 As-As 단일 결합만 특징으로 한다. 비소(I)의 화합물이지만 As=double bonds가 포함된 경우는 드물다.
화학전
특히 As-Cl 결합을 특징으로 하는 유기화합물은 화학무기로 사용되어 왔으며, 특히 제1차 세계대전 중에는 '레위스티'(클로로비닐-2-arsenic dicloride), '클라크 1'(클로로디페닐라신) 등이 악명 높은 예다. 페닐디클로로아르신은 또 다른 것이다.
자연에서
비소는 대부분의 생명체에게 독성이 있으며 일부 지역에서 농도가 높아짐에 따라 여러 가지 해독 전략이 발전했다. 무기 비소와 그 화합물은 먹이 사슬에 들어가자마자 메틸화 과정을 통해 점차적으로 독성이 덜한 형태의 비소로 대사된다.[5] 유기농성 화합물은 무기 비소 화합물의 생체적응을 통해,[6] 비타민12 B와 관련된 효소에 의해 매개되는 과정을 통해 발생한다.[7] 예를 들어, 무기 비소가 존재하는 경우, Scopulariopsis brevicaulis 금형은 상당한 양의 트리메틸라르신을 생성한다.[8] 베탄인 유기 화합물인 비소베틴은 어류와 조류와 같은 일부 해양 식품과 더 큰 농도의 버섯에서도 발견된다. 평균 사람의 섭취량은 약 10-50µg/일이다. 약 1000 µg의 값은 생선이나 버섯을 섭취한 후 이상하지 않다. 하지만 이 비소 화합물은 독성이 거의 없기 때문에 생선을 먹는 데는 거의 위험이 없다.[9] 아르세노베틴은 서양의 바닷가재에서[10][11] 처음 발견되었다.
비소에 묶인 탄수화물은, 집단적으로 비소가라고 알려져 있는데, 특히 해조류에서 발견된다. 지질을 함유한 비소도 알려져 있다.[12] 비소와 그 화합물은 인간에게 독성이 있지만, 최초의 합성 항생제 중 하나가 살바산이었는데, 이 항생제의 사용은 오래 전에 중단되었다.
천연원료에서 분리된 유일한 폴리아르센 화합물은 뉴칼레도니아 해양 스펀지 에치노찰리나 바르시반티에서 발견된 비소신A이다.[13]
유기농 화합물은 그 특성에 따라 상당한 건강상의 위험을 초래할 수 있다. 비소산(As(OH))3의 LD50은 34.5mg/kg(mice)인 반면 베테인(CH3)3ASCHCO의+22− 경우 LD50은 10g/kg을 초과한다.[9]
대표 화합물
일부 예시된 유기농 화합물은 아래 표에 열거되어 있다.
| 유기농 | R | 어금질량 | CAS 번호 | 특성. | |
| 10,10'-oxybis-10H-페녹사신 |  | 502.2318 | 58-36-6 | ||
| 트리페닐라르신 | 페닐 |  | 306.23 | 603-32-7 | 용융점 58-61°C |
| 페닐디클로로아신 | 페닐, 염소 | 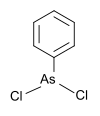 | 222.93 | 696-28-6 | |
| 록사손 | 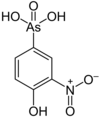 | 263.04 | 121-19-7 | ||
| 아르세노베테인 | 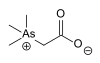 | 64436-13-1 | |||
| 아르세니신 A | ![2,4,6-Trioxa-1,3,5,7-tetraarsatricyclo[3.3.1.13,7]decane](http://upload.wikimedia.org/wikipedia/commons/thumb/4/42/Arsenicin_A.png/100px-Arsenicin_A.png) | 389.76 | 925705-41-5 | 용융점 182~184°C(360~363°F) | |
| 대표적인 유기농 화합물 [14][13] | |||||
명명법
순환 유기화합물의 명칭은 아래에 요약한 바와 같이 IUPAC가 승인한 한츠슈-위드만 명명 체계의[15] 확장에 기초한다.[16]
| 링 사이즈 | 불포화 반지 | 포화 반지 |
|---|---|---|
| 3 | 아르시렌 | 아르시라네 |
| 4 | 아르제트 | 아르세테인 |
| 5 | 아솔 | 아르솔레인 |
| 6 | 아르시닌 | 아르시나네 |
| 7 | 아르세핀 | 아르세판 |
| 8 | 아르소키네 | 아르소카네 |
| 9 | 방화 | 방화네 |
| 10 | 아르세킨 | 아르세케인 |
영어 속어인 '아스홀'(북미 이외의 지역에서 흔히 쓰이는 말)과 유사하기 때문에 '아스루'라는 이름은 재미의 대상, '실리명',[17][18] 특이한 이름을 가진 여러 화학 화합물 중 하나로 여겨져 왔다. 그러나 이런 '실명' 우연의 일치로 인해 세밀한 과학 연구도 자극을 받았다.[19]
참고 항목
참조
- ^ 싱, R. 합성 약품이야 미탈 출판물(2002년). ISBN817099831X
- ^ a b Grund, S. C.; Hanusch, K.; Wolf, H. U. "Arsenic and Arsenic Compounds". Ullmann's Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH. doi:10.1002/14356007.a03_113.pub2.
- ^ Styblo, M.; Del Razo, L. M.; Vega, L.; Germolec, D. R.; LeCluyse, E. L.; Hamilton, G. A.; Reed, W.; Wang, C.; Cullen, W. R.; Thomas, D. J. (2000). "Comparative toxicity of trivalent and pentavalent inorganic and methylated arsenicals in rat and human cells". Archives of Toxicology. 74 (6): 289–299. doi:10.1007/s002040000134. PMID 11005674. S2CID 1025140.
- ^ a b 엘센브로이치, C. "Oganometalics" (2006) Wiley-VCH: Weinheim. ISBN 978-3-527-29390-2
- ^ Reimer, K. J.; Koch, I.; Cullen, W. R. (2010). Organoarsenicals. Distribution and transformation in the environment. Metal Ions in Life Sciences. Vol. 7. Cambridge: RSC publishing. pp. 165–229. doi:10.1039/9781849730822-00165. ISBN 978-1-84755-177-1. PMID 20877808.
- ^ Dopp, E.; Kligerman, A. D.; Diaz-Bone, R. A. (2010). Organoarsenicals. Uptake, metabolism and toxicity. Metal Ions in Life Sciences. Vol. 7. Cambridge: RSC publishing. pp. 231–265. doi:10.1515/9783110436600-012. ISBN 978-1-84755-177-1. PMID 20877809.
- ^ Toshikazu Kaise; Mitsuo Ogura; Takao Nozaki; Kazuhisa Saitoh; Teruaki Sakurai; Chiyo Matsubara; Chuichi Watanabe; Ken'ichi Hanaoka (1998). "Biomethylation of Arsenic in an Arsenic-rich Freshwater Environment". Applied Organometallic Chemistry. 11 (4): 297–304. doi:10.1002/(SICI)1099-0739(199704)11:4<297::AID-AOC584>3.0.CO;2-0.
- ^ Bentley, Ronald; Chasteen, Thomas G. (2002). "Microbial Methylation of Metalloids: Arsenic, Antimony, and Bismuth". Microbiology and Molecular Biology Reviews. 66 (2): 250–271. doi:10.1128/MMBR.66.2.250-271.2002. PMC 120786. PMID 12040126.
- ^ a b Cullen, William R.; Reimer, Kenneth J. (1989). "Arsenic speciation in the environment". Chemical Reviews. 89 (4): 713–764. doi:10.1021/cr00094a002. hdl:10214/2162.
- ^ Francesconi, Kevin A.; Edmonds, John S. (1998). "Arsenic Species in Marine Samples" (PDF). Croatica Chemica Acta. 71 (2): 343–359. Archived from the original (PDF) on 2008-03-09.
- ^ John S. Edmonds; Kevin A. Francesconi; Jack R. Cannon; Colin L. Raston; Brian W. Skelton & Allan H. White (1977). "Isolation, crystal structure and synthesis of arsenobetaine, the arsenical constituent of the western rock lobster panulirus longipes cygnus George". Tetrahedron Letters. 18 (18): 1543–1546. doi:10.1016/S0040-4039(01)93098-9.
- ^ Alice Rumpler; John S. Edmonds; Mariko Katsu; Kenneth B. Jensen; Walter Goessler; Georg Raber; Helga Gunnlaugsdottir; Kevin A. Francesconi (2008). "Arsenic-Containing Long-Chain Fatty Acids in Cod-Liver Oil: A Result of Biosynthetic Infidelity?". Angew. Chem. Int. Ed. 47 (14): 2665–2667. doi:10.1002/anie.200705405. PMID 18306198.
- ^ a b Mancini, Ines; Guella, Graziano; Frostin, Maryvonne; Hnawia, Edouard; Laurent, Dominique; Debitus, Cecile; Pietra, Francesco (2006). "On the First Polyarsenic Organic Compound from Nature: Arsenicin a from the New Caledonian Marine SpongeEchinochalina bargibanti". Chemistry: A European Journal. 12 (35): 8989–94. doi:10.1002/chem.200600783. PMID 17039560.
- ^ http://www.sigmaaldrich.com
- ^ 2008년 9월 29일 IUPAC의 "헤테로모노모노사이클로 명명법 한츠슈-위드만 확장 시스템 개정"
- ^ Nicholas C. Norman (1998). Chemistry of arsenic, antimony, and bismuth. Springer. p. 235. ISBN 978-0-7514-0389-3. Retrieved 15 March 2011.
- ^ Richard Watson Todd (25 May 2007). Much ado about English: up and down the bizarre byways of a fascinating language. Nicholas Brealey Publishing. p. 138. ISBN 978-1-85788-372-5. Retrieved 15 March 2011.
- ^ Paul W May, 어리석거나 특이한 이름을 가진 분자, public. 2008 임페리얼 칼리지 프레스, ISBN 978-1-84816-207-5(pbk) 브리스톨 대학의 화학 학교에서 "바보스럽거나 특이한 이름을 가진 분자" 웹 페이지도 참조하십시오(2008년 9월 29일 철회)
- ^ M. P. Johansson; J. Juselius (2005). "Arsole Aromaticity Revisited". Lett. Org. Chem. 2 (5): 469–474. doi:10.2174/1570178054405968.
Using quantum chemical methodology, we reinvestigate the aromaticity of the much debated arsole, using the newly developed gauge-including magnetically induced currents (GIMIC) method. GIMIC provides a quantitative measure of the induced ring current strength, showing arsole to be moderately aromatic.


