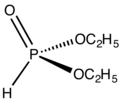
인산에스테르
Phosphite ester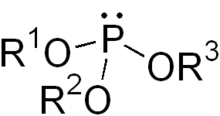
화학에서 인산에스테르 또는 유기인산염은 일반적으로 식 P(OR)3의 유기인 화합물을 말한다.이들은 관찰되지 않은 호변이성체 인산인33 HPO의 에스테르로 간주될 수 있으며, 가장 간단한 예는 트리메틸포스파이트, P(OCH3)3이다.일부 인산염은 인산의 지배적인 호변이성체(HP(O)(OH))2의 에스테르로 간주될 수 있다.가장 간단한 대표자는 HP(O)(OCH3)2 공식의 디메틸인산염이다.두 종류의 인광은 보통 무색의 액체이다.
합성
- PCl에서3
인산 에스터는 일반적으로 삼염화 인을 알코올로 처리하여 제조됩니다.이 알코용해는 합성 세부사항에 따라 디오르간인산염에 [1]다음과 같은 영향을 줄 수 있다.
- PCl3 + 3 CHOH25 → (CHO25)2 P(O)H + 2 HCl + CHCl25
또는 양성자 수용체가 있는 상태에서 알코홀리시(alcoholysis)를 수행하면 C-대칭3 트리알콕시 [2]유도체를 얻을 수 있다.
- PCl3 + 3 CHOH25 + 3 RN3 → (CHO25)3P + 3 RNHCl3
많은 유도체들이 두 종류의 인산염에 대해 준비되었다.
- 에스테르 변환에 의한
인산에스테르도 다른 [3]알코올과 가열 시 알코올 교환을 받기 때문에 에스테르 교환을 통해 제조할 수 있습니다.이 과정은 가역적이며 혼합된 알킬인산염을 생산하는 데 사용될 수 있습니다.또, 트리메틸인산염등의 휘발성 알코올의 인산염을 사용하면, 증류에 의해서 부산물(메탄올)을 제거할 수 있어 반응을 완료시킬 수 있다.
트리스(유기)인산염의 반응 및 응용
반응
 트리스(2,4-di-tert-butylphenyl)인산염, 폴리머에서 널리 사용되는 안정제
트리스(2,4-di-tert-butylphenyl)인산염, 폴리머에서 널리 사용되는 안정제
인산염은 인산 에스테르로 산화됩니다.
- P(OR)3 + [O] → OP(OR)3
이 반응은 [4]폴리머에서 안정제로서 일부 인산에스테르를 상업적으로 사용하는 것을 뒷받침한다.
알킬 포스파이트 에스터는 페르코우 반응에서 비닐 포스폰산염의 형성을 위해 사용되며, 미카엘리스-아르부조프 반응에서 포스폰산염을 형성하기 위해 사용된다.아릴인산에스테르류는 이러한 반응을 일으키지 않을 수 있으므로 PVC와 같은 할로겐 함유 폴리머의 안정제로 일반적으로 사용된다.
보다 특수한 경우에는 인산에스테르를 환원제로 사용할 수 있다.예를 들어 트리에틸포스파이트는 특정 하이드로페록시드를 자동산화[5](스킴)에 의해 형성된 알코올로 환원시키는 것으로 알려져 있다.이 과정에서 인산염은 인산 에스테르로 변환된다.이 반응 유형은 Wender Taxol 전체 합성에도 사용됩니다.
균질 촉매 작용
포스파이트 에스터는 루이스 염기이므로 다양한 금속 이온과 배위 복합체를 형성할 수 있다.대표적인 인광배위자는 트리메틸포스파이트(MeO)3P), 트리에틸포스파이트(EtO)3P, 트리메틸롤프로판포스파이트 및 트리페닐포스파이트(PhO)3P를 포함한다.인광은 구조적으로 관련된 포스핀 배위자 패밀리보다 작은 리간드 콘 각도를 보인다.인산염 배위자는 하이드로포밀화 [6]및 하이드로시아네이션용 공업용 촉매 성분이다.
HP(O)(OR)2의 화학
디오르간인산염은 인(II)의 유도체이며 인산의 디에스테르로 볼 수 있다.그들은 호변이성(tautomerism)을 나타내지만, 평형은 압도적으로 우측([9]포스폰산염 유사) 형태를 선호한다.
- (RO)2 POH ( (RO)2 P (O)h
P-H 결합은 이러한 화합물에서 반응성이 높은 부위이다(예를 들어 Atherton-).Todd reaction)는 3개 유기인산염에서 인의 유일한 쌍은 반응성이 높은 부위이다.그러나 디오가노인산염은 에스테르 교환을 거친다.
「 」를 참조해 주세요.
- 인산염 P(OR)R2
- 포스포나이트 P(OR)2R
- Ortho 에스테르 CH(OR)3
- 붕산염 에스테르 B(3OR
레퍼런스
- ^ Malowan, John E. (1953). "Diethyl phosphite". Inorganic Syntheses. Inorganic Syntheses. Vol. 4. pp. 58–60. doi:10.1002/9780470132357.ch19. ISBN 9780470132357.
- ^ A. H. Ford-Moore & B. J. Perry (1963). "Triethyl Phosphite". Organic Syntheses.; Collective Volume, vol. 4, p. 955
- ^ Hoffmann, Friedrich W.; Ess, Richard J.; Usingef, Robert P. (November 1956). "The Transesterification of Trialkyl Phosphites with Aliphatic Alcohols". Journal of the American Chemical Society. 78 (22): 5817–5821. doi:10.1021/ja01603a026.
- ^ Rainer Wolf; Bansi Lal Kaul (2000). "Plastics, Additives". Ullmann's Encyclopedia Of Industrial Chemistry. doi:10.1002/14356007.a20_459. ISBN 3527306730.
- ^ J. N. Gardner; F. E. Carlon & O. Gnoj (1968). "One-step procedure for the preparation of tertiary α-ketols from the corresponding ketones". J. Org. Chem. 33 (8): 3294–3297. doi:10.1021/jo01272a055. PMID 5742870.
- ^ Aitor Gual; Cyril Godard; Verónica de la Fuente; Sergio Castillón (2012). "Design and Synthesis of Phosphite Ligands for Homogeneous Catalysis". In Paul C. J. Kamer; Piet W. N. M. van Leeuwen (eds.). Phosphorus(III) Ligands in Homogeneous Catalysis: Design and Synthesis. John Wiley & Sons. pp. 81–131. doi:10.1002/9781118299715.ch3. ISBN 9781118299715.
- ^ Cuny, Gregory D.; Buchwald, Stephen L. (1993). "Practical, High-Yield, Regioselective, Rhodium-Catalyzed Hydroformylation of Functionalized α-olefins". Journal of the American Chemical Society. 115 (5): 2066–2068. doi:10.1021/ja00058a079.
- ^ Van Rooy, Annemiek; Kamer, Paul C. J.; Van Leeuwen, Piet W. N. M.; Goubitz, Kees; Fraanje, Jan; Veldman, Nora; Spek, Anthony L. (1996). "Bulky Diphosphite-Modified Rhodium Catalysts: Hydroformylation and Characterization". Organometallics. 15 (2): 835–847. doi:10.1021/OM950549K.
- ^ Doak, G. O.; Freedman, Leon D. (1 February 1961). "The Structure and Properties of the Dialkyl Phosphonates". Chemical Reviews. 61 (1): 31–44. doi:10.1021/cr60209a002.