생체역학
Bioconjugation생체결절은 두 분자 사이에 안정적인 공밸런스 연계를 형성하기 위한 화학적 전략이며, 그 중 적어도 하나는 생체분자다.
함수
최근 생체 분자에 대한 이해의 발전은 의약품이나 물질과 같은 수많은 분야에 그들의 응용을 가능하게 했다.합성 변형 생체분자는 세포사건 추적, 효소함수 노출, 단백질 생분포 결정, 특정 바이오마커 영상촬영, 표적 세포에 약물 전달 등 다양한 기능을 가질 수 있다.[1][2][3][4]생체공정은 이러한 변형된 생체분자를 서로 다른 기질과 연결시키는 중요한 전략이다.
합성
바이오콘주게이트의 합성에는 형광염료 마커의 단순 및 비특정 사용에서부터 항체 약물 결합체의 복잡한 설계에 이르기까지 다양한 난제가 수반된다.[1][3]그 결과, 두 개의 생체 분자를 연결하는 화학 반응인 다양한 생체 분해 반응이 개발되어 단백질을 화학적으로 변형시켰다.단백질에 대한 일반적인 유형의 생체결화 반응은 리신, 시스테인 및 티로신 아미노산 잔류물의 결합과 트립토판 아미노산 잔류물과 N-와 C-단말기의 수정이다.[1][3][4]
그러나 이러한 반응은 대개 선택성을 저해하는 다량으로 존재하는 고유 아미노산 잔류물의 유무에 의존하기 때문에 화학적 선택성과 효율성이 결여되는 경우가 많다.특히 단백질에 합성 분자 부지를 효과적으로 부착할 수 있는 화학적 전략의 필요성이 증가하고 있다.한 가지 전략은 우선 단백질에 고유한 기능 그룹을 설치한 다음 생체 직교 또는 클릭 타입 반응을 사용하여 생체 분자를 이 고유한 기능 그룹과 결합시키는 것이다.[1]비원성 기능군을 대상으로 하는 생체 직교 반응은 생체역학 화학에서 널리 사용되고 있다.중요한 반응으로는 케톤과 알데하이드의 변형, 스테오딩거의 유기 아지드(Azides)를 이용한 레깅, 아지드(Azides)의 구리로 분석된 위스겐 사이클로어데이드(Huisgen cycloaddation)를 촉진하는 변형 등이 있다.[5][6][7][8]
일반 생체검사 반응
가장 흔한 바이오콘쥬징은 단백질에 작은 분자(비오틴이나 형광염료 등)의 결합이나 효소에 대한 항체의 결합과 같은 단백질-단백질 결합이다.[9]생물조합에 사용되는 다른 덜 흔한 분자는 올리고당, 핵산, 폴리에틸렌 글리콜과 같은 합성 고분자,[10] 탄소 나노튜브들이다.[11]브렌턱시맙 베도틴, 젬투즈마브 오조가마민 등 항체 약물 접합체도 생체결합의 사례로 제약업계에서 활발한 연구 분야다.[12]최근에는 생체결핵 양자점 등 나노기술 응용 분야에서도 생체결핵화가 중요해지고 있다.
리신잔류물의 반응
뉴클레오필릭 리신 잔여물은 단백질 생체결합에서 주로 아민-반응 N-하이드록시누시미딜(NHS) 에스테르를 통해 대상 부위가 된다.[3]감응된 리신 잔류물의 최적 개수를 얻으려면 수용액의 pH가 리신 암모늄 그룹의 pKa보다 10.5 정도 낮아야 하므로 반응의 대표적인 pH는 약 8과 9이다.연결 반응에 대한 일반적인 시약은 리신 아틸화 메커니즘을 통해 핵포질 리신과 반응하는 NHS-에스테르(아래 그림 1의 첫 번째 반응에 표시됨)이다.다른 유사한 시약들은 유사한 메커니즘을 겪는 이소시아네이트와 이소티오시아네이트들이다(아래 그림 1의 두 번째와 세 번째 반응에 표시됨).[1]경미한 조건(저온, 생리학적 pH)에서 단백질의 리신 수정을 허용하는 벤조일 플루오르화물(아래 그림 1의 마지막 반응에서 표시)이 최근 고전적으로 사용되는 라이신 특정 시약의 대안으로 제안되었다.[13]
시스틴 잔여물의 반응
프리 시스테인은 단백질 표면에서 거의 발생하지 않기 때문에 화학적 수정에는 탁월한 선택이다.[14]기본 조건 하에서, 시스틴 잔여물은 탈색되어 티올레이트 핵소포체를 생성하며, 이것은 말레미드 및 이오도아세타미드(아래 그림 2의 처음 두 반응에 나타나 있음)와 같은 부드러운 전기세포와 반응하게 된다.그 결과 탄소-황 결합이 형성된다.시스틴 잔여물의 또 다른 수정은 이황화 결합의 형성을 포함한다(그림 2의 세 번째 반응에 나타나 있다).감소된 시스틴 잔여물은 이황화물과 반응하여 단백질에 이황화 결합을 새로 생성한다.이황화물의 과잉은 2-티오피리돈과 3-카르복시-4-니트로티오페놀과 같은 반응을 일으키는데 종종 사용된다.[1][3]전자 결핍 알키네스는 다른 뉴클레오필 아미노산 잔류물이 존재하는 곳에서 단백질의 시스테인 잔류물과 선택적으로 반응하는 것으로 입증되었다.알카인 대체물에 따라, 이러한 반응은 갈라질 수 있거나(알카논 유도체를 사용할 때),[15] 수력학적으로 안정된 바이오콘주게이트(3-아릴프로피오론리트를 사용할 때, 아래 그림 2의 마지막 반응)를 생성할 수 있다.[16]
티로신 잔류물의 반응
타이로신 잔여물은 상대적으로 비활성화되므로, 그것들은 생체결합의 인기 있는 대상이 아니었다.최근 개발에서는 전기 방향족 대체(EAS) 반응을 통해 티로신을 수정할 수 있으며 페놀 하이드록실 그룹에 인접한 방향족 탄소를 선택한다.[1]이는 특히 시스틴 잔류물을 타겟으로 할 수 없는 경우에 유용해진다.구체적으로는 디아조늄이 효과적으로 티로신 잔류물(아래 그림 3의 첫 번째 반응에서 시약으로 나타낸 디아조늄염)과 결합하고, 디아조늄염의 4위치에 전자 인출 대체물이 있으면 효과적으로 반응의 효율을 높일 수 있다.4-페닐-1,2,4-트리아졸-3,5-디오네(PTAD)와 같은 순환형 디아조디카복사미드 파생물이 티로신 잔류물에 대한 선택적 생체결합을 위해 보고되었다(아래 그림 3의 두 번째 반응).[17]알데히드 및 아닐린(그림 3의 마지막 반응)에 대한 3가지 구성 요소인 Mannich형 반응도 약간 최적화된 반응 조건 하에서 상대적으로 타이로신 선택적이라고 설명되었다.[18]
N- 및 C-단말의 반응
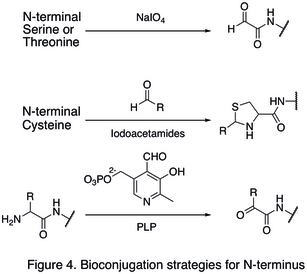
천연 아미노산 잔류물은 보통 대량으로 존재하기 때문에 단일 부위의 수정이 어려운 경우가 많다.단백질 종말을 겨냥한 전략은 단백질 수정의 현장 선택성을 크게 향상시켰기 때문에 개발되었다.N-단말 수정 중 하나는 단자 아미노산의 기능화를 포함한다.N-단자 세린과 트레오닌 잔류물의 산화는 N-단자 알데히드를 발생시킬 수 있으며, 이는 추가적인 생물직교반응을 겪을 수 있다(그림 4의 첫 번째 반응에 나타나 있다).또 다른 유형의 수정은 높은 pH(그림 4의 두 번째 반응)에서 안정성이 있는 티아졸리딘을 생성하면서 알데하이드와 함께 N-단자 사이스테인이 응결되는 것을 포함한다.피리독살 인산염(PLP)을 사용하여 여러 N-단자 아미노산이 투사화를 통해 글리신, 아스파르트산과 같은 N-단자 알데히드를 산출할 수 있다(그림 4의 세 번째 반응).
C-termini 수정의 예로는 C-terminal tiioster와 N-terminal cysteine 사이의 결합인 NCL이 있다(그림 5).
생체직교반응
케톤 및 알데히드 수정
케톤이나 알데히드는 N-단자 세린 잔류물의 산화나 PLP와의 트랜스매션을 통해 단백질에 부착할 수 있다.또한 티렐법이나 슐츠법을 통해 부자연스러운 아미노산을 통합하여 도입할 수 있다.[5]그런 다음 선택적으로 알콕시아민과 하이드라진으로 응축하여 옥소임과 하이드라존 유도체를 생성한다(각각 그림 6의 첫 번째 반응과 두 번째 반응에 표시).이 반응은 단백질 생체합성 측면에서 화학반응성이 높지만 반응속도는 느리다.기계론적 연구에 따르면 비율을 결정하는 단계는 사면체 중간의 탈수이므로, 탈수 단계를 가속화하기 위해 약한 산성 용액을 사용하는 경우가 많다.[2]
핵 촉매의 도입은 반응 속도를 현저하게 높일 수 있다(그림 7 참조).예를 들어, 아닐린을 핵포틸 촉매로 사용함으로써, 인구가 적은 양성자 카보닐은 인구밀도가 높은 양성자 쉬프 기지가 된다.[19]즉, 높은 농도의 반응성 전기세포를 발생시킨다.그러면 소고기 레깅은 쉽게 일어날 수 있으며, 약한 산성 조건에서 그 비율이 최대 400배까지 증가한 것으로 보고되었다.[19]이 촉매의 핵심은 원하는 제품과 경쟁하지 않고도 반응성 전기세포를 발생시킬 수 있다는 것이다.
근위부 기능군을 이용하는 최근의 개발은 중성 pH에서 히드라존−1−1 응축이[20] 20 Ms에서 작동할 수 있도록 하는 반면 중성 pH에서 500-100−1−1 Ms에서 촉매 없이 진행되는 옥시메인 응축이 발견되었다.[21][22]
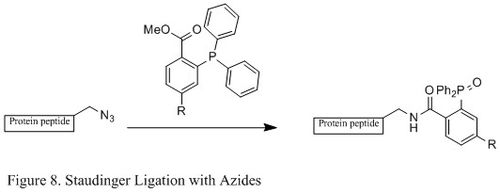
스타우딩거 레깅스(Azides)
아지드화물과 인산염의 스투딩거(Staudinger laging)는 화학 생물학 분야에서 광범위하게 사용되어 왔다.살아있는 세포와 동물에서 안정적인 아미드 결합을 형성할 수 있기 때문에 세포막의 변형, 생체내 영상촬영, 기타 생체결절 연구에 적용되어 왔다.[23][24][25][26]
전형적인 스토우딩거 반응과 대조적으로, 스토우딩거 레저는 속도 제한 단계가 인산염(그림 9에 나타낸 특정 반응 메커니즘)의 형성인 2차 반응이다.트리페닐인산염은 우선 아지드와 반응하여 4메모 링 전환 상태를 통해 아자일라이드를 산출한 다음, 분자 내 반응이 아이미노인스포레인 중간으로 이어져 가수분해 하에서 아미드 연동을 주게 된다.[27]
아지드화 후이젠 사이클링
구리가 아지드화 후이젠 사이클화를 촉진
아지드는 크기가 작고 열역학적 반응 잠재력이 좋아 화학적 단백질 수정의 인기 대상이 됐다.그러한 아지드 반응 중 하나는 알카인과의 [3+2] 사이클로어드 반응이지만, 그 반응은 높은 온도를 필요로 하며 종종 레지오이소머의 혼합물을 준다.
화학자 Karl Barry Sharfleless에 의해 개발된 개선된 반응은 구리(I) 촉매를 포함하는데, 이 촉매는 1,2,3개의 삼점만을 높은 수율로 대체하는 단자 알키네와 결합한다(아래 그림 11 참조).기계론적 연구는 단계적 반응을 제시한다.[8]Cu (I)는 먼저 아세틸렌과 커플을 맺고 나서 아지드와 반응하여 6mb의 중간을 생성한다.공정은 pH 4~12에서 발생할 정도로 매우 견고하며, 구리(II)황산염은 환원제가 있는 곳에서 촉매로 자주 사용된다.[8]
변형률로 아지드화 후이젠 사이클화가 촉진됨
스토우딩거 레저는 큰 독성이 없는 살아있는 세포에서 적합한 생체결합이지만 공기 산화 민감성과 물 속 용해성이 떨어지는 인산염은 그 효율을 현저히 저해한다.구리(I) 촉매제인 아지드알킨 결합은 생리학적 조건에서 합리적인 반응률과 효율을 가지지만 구리는 상당한 독성을 띠며 살아있는 세포의 단백질 기능을 방해하기도 한다.2004년에는 화학자 캐롤린 R. 베르토찌의 연구소는 경직된 사이클로옥티네와 아지드를 이용한 무금속 사이클로어데이션[3+2]을 개발했다.가장 작은 안정형 사이클로알키네인 사이클로옥티네는 [3+2] 사이클로어데스를 통해 아지드와 결합할 수 있으며, 두 개의 레지오이소메릭 트라이아졸(그림 12)로 이어진다.[6]이 반응은 상온에서 쉽게 일어나므로 부정적인 영향 없이 살아있는 세포를 효과적으로 수정하는데 사용될 수 있다.주기적인 알키네에 불소 대체물을 설치하면 반응속도를 크게 높일 수 있다는 보고도 있었다.[2][28]
적용된 생체역학 기술의 예
성장 요인
산화철 나노입자에 대한 TGF-β의 생체합성 및 자기 열성 인비트로에 의한 활성화가 보고되었다.[29]이는 N-Hydroxysuccinimide와 결합된 1-(3-dimethylaminopropyl)ethylcarbodiimide를 사용하여 성장 인자에 자유 1차 아민(free primary amines)탄소 나노튜브는 TGF-β를 연결한 후 근적외선으로 활성화하기 위해 생체결정과 함께 성공적으로 사용되어 왔다.[30]전형적으로, 이러한 반응은 크로스링커의 사용을 수반했지만, 이들 중 일부는 관심의 화합물과 기본 물질 사이에 분자 공간을 더하고, 차례로 비특정 결합성과 원하지 않는 반응성의 높은 정도를 야기한다.[31]
참고 항목
참조
- ^ a b c d e f g Stephanopoulos, N.; Francis, M. B. (2011). "Choosing an effective protein bioconjugation strategy". Nature Chemical Biology. 7 (12): 876–884. doi:10.1038/nchembio.720. PMID 22086289.
- ^ a b c Tilley, S. D.; Joshi, N. S.; Francis, M. B. (2008). "Proteins: Chemistry and Chemical Reactivity". Wiley Encyclopedia of Chemical Biology. doi:10.1002/9780470048672.wecb493. ISBN 978-0470048672.
- ^ a b c d e Francis, M. B.; Carrico, I. S. (2010). "New frontiers in protein bioconjugation". Current Opinion in Chemical Biology. 14 (6): 771–773. doi:10.1016/j.cbpa.2010.11.006. PMID 21112236.
- ^ a b Kalia, J.; Raines, R. T. (2010). "Advances in Bioconjugation". Current Organic Chemistry. 14 (2): 138–147. doi:10.2174/138527210790069839. PMC 2901115. PMID 20622973.
- ^ a b Carrico, I. S.; Carlson, B. L.; Bertozzi, C. R. (2007). "Introducing genetically encoded aldehydes into proteins". Nature Chemical Biology. 3 (6): 321–322. doi:10.1038/nchembio878. PMID 17450134.
- ^ a b Agard, N. J.; Prescher, J. A.; Bertozzi, C. R. (2004). "A Strain-Promoted \3 + 2] Azide−Alkyne Cycloaddition for Covalent Modification of Biomolecules in Living Systems". Journal of the American Chemical Society. 126 (46): 15046–15047. doi:10.1021/ja044996f. PMID 15547999.
- ^ Kolb, H. C.; Finn, M. G.; Sharpless, K. B. (2001). "Click Chemistry: Diverse Chemical Function from a Few Good Reactions". Angewandte Chemie International Edition. 40 (11): 2004–2021. doi:10.1002/1521-3773(20010601)40:11<2004::AID-ANIE2004>3.0.CO;2-5. PMID 11433435.
- ^ a b c Rostovtsev, Vsevolod V.; Green, Luke G.; Fokin, Valery V.; Sharpless, K. Barry (2002). "A Stepwise Huisgen Cycloaddition Process: Copper(I)-Catalyzed Regioselective "Ligation" of Azides and Terminal Alkynes". Angewandte Chemie International Edition. 41 (14): 2596–2599. doi:10.1002/1521-3773(20020715)41:14<2596::AID-ANIE2596>3.0.CO;2-4. ISSN 1433-7851. PMID 12203546.
- ^ Koniev, O.; Wagner, A. (2015). "Developments and recent advancements in the field of endogenous amino acid selective bond forming reactions for bioconjugation". Chem. Soc. Rev. 44 (15): 5495–5551. doi:10.1039/C5CS00048C. PMID 26000775.
- ^ Thordarson, P.; Le Droumaguet, B.; Velonia, K. (2006). "Well-defined protein–polymer conjugates—synthesis and potential applications". Applied Microbiology and Biotechnology. 73 (2): 243–254. doi:10.1007/s00253-006-0574-4. PMID 17061132. S2CID 23657616.
- ^ Yang, W.; Thordarson, P. (2007). "Carbon nanotubes for biological and biomedical applications". Nanotechnology. 18 (41): 412001. Bibcode:2007Nanot..18O2001Y. doi:10.1088/0957-4484/18/41/412001.
- ^ Gerber, HP; Senter, PD; Grewal, IS (2009). "Antibody drug-conjugates targeting the tumor vasculature: Current and future developments". MAbs. 1 (3): 247–53. doi:10.4161/mabs.1.3.8515. PMC 2726597. PMID 20069754. Archived from the original on February 2, 2014.
- ^ Dovgan, I.; Ursuegui, S.; Erb, S.; Michel, C.; Kolodych, S.; Cianférani, S.; Wagner, A. (2017). "Acyl Fluorides: Fast, Efficient, and Versatile Lysine-Based Protein Conjugation via Plug-and-Play Strategy". Bioconjugate Chem. 28 (5): 1452–1457. doi:10.1021/acs.bioconjchem.7b00141. PMID 28443656.
- ^ Fodje, M. N.; Al-Karadaghi, S. (2002). "Occurrence, conformational features and amino acid propensities for the π-helix". Protein Eng. 15 (5): 353–358. doi:10.1093/protein/15.5.353. PMID 12034854.
- ^ Shiu, H.-Y.; Chan, T.-C.; Ho, C.-M.; Lin, Y.; Wong, M.-K.; Che, C.-M. (2009). "Electron-Deficient Alkynes as Cleavable Reagents for the Modification of Cysteine-Containing Peptides in Aqueous Medium". Chem. Eur. J. 15 (15): 3839–3850. doi:10.1002/chem.200800669. PMID 19229937.
- ^ Koniev, O.; Leriche, G.; Nothisen, M.; Remy, J.-S.; Strub, J.-M.; Schaeffer-Reiss, C.; Dorsselaer, A.; Baati, R.; Wagner, A. (2014). "Selective Irreversible Chemical Tagging of Cysteine with 3-Arylpropiolonitriles". Bioconjugate Chem. 25 (2): 202–206. doi:10.1021/bc400469d. PMID 24410136.
- ^ Ban, H.; Nagano, M.; Gavrilyuk, J.; Barbas, C.F. (2015). "Facile and Stabile Linkages through Tyrosine: Bioconjugation Strategies with the Tyrosine-Click Reaction". Bioconjugate Chem. 4 (24): 520–532. doi:10.1021/bc300665t. PMC 3658467. PMID 23534985.
- ^ Joshi, N.S.; Whitaker, L.R.; Francis, M.B. (2004). "A Three-Component Mannich-Type Reaction for Selective Tyrosine Bioconjugation". J. Am. Chem. Soc. 126 (49): 15942–15943. doi:10.1021/ja0439017. PMID 15584710.
- ^ a b Dirksen, A.; Hackeng, T. M.; Dawson, P. E. (2006). "Nucleophilic Catalysis of Oxime Ligation". Angewandte Chemie International Edition. 45 (45): 7581–4. doi:10.1002/anie.200602877. PMID 17051631.
- ^ Kool, Eric; Park, Do-Hyoung; Crisalli, Pete (2013). "Fast Hydrazone Reactants: Electronic and Acid/Base Effects Strongly Influence Rate at Biological pH". Journal of the American Chemical Society. 135 (47): 17663–17666. doi:10.1021/ja407407h. PMC 3874453. PMID 24224646.
- ^ Schmidt, Pascal; Zhou, Linna; Tishinov, Kiril; Zimmermann, Kaspar; Gillingham, Dennis (2014). "Dialdehydes Lead to Exceptionally Fast Bioconjugations at Neutral pH by Virtue of a Cyclic Intermediate". Angewandte Chemie International Edition. 53 (41): 10928–10931. doi:10.1002/anie.201406132. PMID 25164607.
- ^ Schmidt, Pascal; Stress, Cedric; Gillingham, Dennis (2015). "Boronic acids facilitate rapid oxime condensations at neutral pH" (PDF). Chemical Science. 6 (6): 3329–3333. doi:10.1039/C5SC00921A. PMC 5656983. PMID 29142692.
- ^ Lemieux, G. A.; De Graffenrie, C. L.; Bertozzi, C. R. (2003). "A Fluorogenic Dye Activated by the Staudinger Ligation". Journal of the American Chemical Society. 125 (16): 4708–4709. doi:10.1021/ja029013y. PMID 12696879.
- ^ Laughlin, S. T.; Baskin, J. M.; Amacher, S. L.; Bertozzi, C. R. (2008). "In Vivo Imaging of Membrane-Associated Glycans in Developing Zebrafish". Science. 320 (5876): 664–667. Bibcode:2008Sci...320..664L. doi:10.1126/science.1155106. PMC 2701225. PMID 18451302.
- ^ Saxon, E.; Bertozzi, C. R. (2000). "Cell Surface Engineering by a Modified Staudinger Reaction". Science. 287 (5460): 2007–2010. Bibcode:2000Sci...287.2007S. doi:10.1126/science.287.5460.2007. PMID 10720325. S2CID 19720277.
- ^ Prescher, J. A.; Dube, D. H.; Bertozzi, C. R. (2004). "Chemical remodelling of cell surfaces in living animals". Nature. 430 (7002): 873–877. Bibcode:2004Natur.430..873P. doi:10.1038/nature02791. PMID 15318217. S2CID 4371934.
- ^ Lin, F. L.; Hoyt, H. M.; Van Halbeek, H.; Bergman, R. G.; Bertozzi, C. R. (2005). "Mechanistic Investigation of the Staudinger Ligation". Journal of the American Chemical Society. 127 (8): 2686–2695. doi:10.1021/ja044461m. PMID 15725026.
- ^ Chang, P. V.; Prescher, J. A.; Sletten, E. M.; Baskin, J. M.; Miller, I. A.; Agard, N. J.; Lo, A.; Bertozzi, C. R. (2010). "Copper-free click chemistry in living animals". Proceedings of the National Academy of Sciences. 107 (5): 1821–1826. Bibcode:2010PNAS..107.1821C. doi:10.1073/pnas.0911116107. PMC 2836626. PMID 20080615.
- ^ Azie, O; Greenberg, ZF; Batich, CD; Dobson, JP (2019). "Carbodiimide Conjugation of Latent Transforming Growth Factor β1 to Superparamagnetic Iron Oxide Nanoparticles for Remote Activation". Int J Mol Sci. 20 (13): 3190. doi:10.3390/ijms20133190. PMC 6651417. PMID 31261853.
- ^ Lin, L.; Liu, L.; Zhao, B.; et al. (2015). "Carbon nanotube-assisted optical activation of TGF-β signalling by near-infrared light". Nature Nanotechnology. 10 (5): 465–471. Bibcode:2015NatNa..10..465L. doi:10.1038/nnano.2015.28. PMID 25775150.
- ^ Lalli, E.; Sarti, G.; Boi, C. (2018). "Effect of the spacer arm on non-specific binding in membrane affinity chromatography". MRS Communications. 8 (1): 65–70. doi:10.1557/mrc.2018.4.