심근경색 혈관조영술
Cardiac allograft vasculopathy| 심근경색 혈관조영술 | |
|---|---|
 | |
| 관상동맥 | |
| 전문 | 심장학, 혈관학 |
| 증상 | 없다, 숨가쁘게, 피곤하다[1]. |
| 평상시 시작 | 심장 이식[1] 후 |
| 진단법 | 관상동맥 혈관 조영술, 혈관 내 초음파, 도부타민 스트레스 심초음파 검사, 양전자 방출 단층촬영, CT 혈관 조영술, 바이오마커, 심내막 조직검사[2] |
| 치료 | 심혈관 위험 인자, mTOR 억제제, 재분배[1] 제어 |
| 약물 | 시로리무스, 에볼리무스[1] |
| 예후 | 프로그레시브[2] |
| 빈도 | 약 50%(10년)[2] |
| 죽음 | 11-13%의 심장 이식은 수술[1] 후 1년 동안 실시 |
심근경색 혈관조영술(CAV)은 심장이식수술을 받은 사람에게 진행성 관상동맥질환의 일종이다.[1]기증 심장은 신경 공급이 끊겨서 일반적으로 흉통이 없으며, 통상 일상적인 검사에서 CAV가 검출된다.[2]피로감, 호흡곤란 등의 증상이 나타날 수 있다.[2]
이식된 심장을 공급하는 혈관의 구조가 바뀔 때 발생한다.[3]그들은 점차적으로 혈액의 흐름을 좁히고 제한하여 심장 근육의 손상이나 갑작스러운 죽음을 초래한다.[4]플라그 증식에 따른 관상동맥질환에 대한 동일한 위험요인 외에 기증자가 나이가 많거나 폭발성 뇌사 등으로 사망했을 경우, 시토메갈로바이러스 감염이 있을 경우 CAV가 발생할 가능성이 높다.[2]그것의 메커니즘은 면역학적(신체적이고 적응적)과 비면역학적 요인을 포함하며 관상동맥의 조직학적 샘플에 뚜렷한 특징을 가지고 있다.[2]심장 이식에 따른 다른 주요 사망 원인으로는 이식부전, 장기 거부, 감염 등이 있다.[5]
진단은 정기적인 사후관리와 질병의 초기 징후가 있는지 이식된 심장에 대한 모니터링을 통해 이루어진다.[2]검사에는 관상동맥 혈관조영술, 혈관내 초음파, 도부타민 스트레스 심초음파, 양전자 방출 단층촬영, 컴퓨터단층 혈관조영술(CT 혈관조영술) 및 여러 바이오마커 등이 포함된다.[2]
스타틴과 아스피린은 이식 후와 CAV 검출 시 초기에 시작한다.[2]시로리무스와 에버롤리무스를 포함한 약물은 질병 진행을 늦출 수 있다.[2]심장 이식을 다시 해야 할 수도 있다.[6]
CAV는 10년 이내에 심장이식수술을 받는 사람의 약 절반에게 영향을 미친다.[2]심장 이식 수술로 인해 1년 동안 11-13%의 사망에 기여한다.[1]
정의
심근경색 혈관조영술은 심장 이식을 받은 사람들에게서 가속화된 형태의 관상동맥질환이다.[7]
징후 및 증상
심장 이식을 하지 않은 사람들의 협심증의 가슴 조임과 달리, CAV를 가진 사람들은 일반적으로 기증된 심장이 신경 공급을 잃었기 때문에 가슴 통증을 겪지 않는다.[2]몇 년 후 몇몇 사람들은 신경을 다시 쓰며 비정상적인 흉통을 일으킬 수 있다.[8]CAV에 걸린 사람들은 피곤함, 메스꺼움, 복부 불편함을 포함한 광범위한 증상을 보이거나 전혀 증상이 없을 수 있다.[2]호흡곤란과 아릿미아 또한 발생할 수 있다.[8]
위험요소
심장 이식을 하지 않은 사람들의 관상동맥질환과 유사하게, CAV에 대한 위험요인은 고혈압, 고콜레스테롤, 당뇨병을 포함한다.[2]CAV에만 국한된 다른 위험요인으로는 고령의 기증자, 세포질갈로바이러스 감염자, 심장 이식 후 순환하는 항체가 있다.[2]기증자의 뇌사,[8] 특히 기증자의 폭발적 뇌사라는 메커니즘이 중요한 요인으로 밝혀졌다.그것은 아마도 CAV발달의 위험을 결정하는 alograft에 대한 부상의 조합일 것이다.[2]
메커니즘
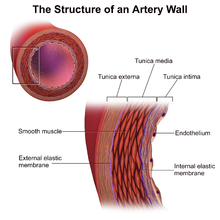
면역학적(중복적이고 적응적) 및 비면역학적 요인은 CAV의 복잡한 병원 생성에 기여한다.[2]
동맥경화증으로 관상동맥질환이 발병하는 비전환자의 경우 질병의 진행이 느리고 조직적 변화가 주로 주 관상동맥에 국한되며 동맥확장이 보상적 리모델링의 한 형태로 관찰된다.[8]그러나, CAV에서, 조직학 표본들은 전형적으로 심장 표면과 심장내 심장의 동맥에서 주요 관상동맥의 근거리 층의 동심원이 두꺼워지는 것을 보여주는데, 이것은 몇 년 안에 없어질 수 있다.[2][8]근육 세포의 원활한 이동, 거품성 대식세포, 림프구 침투 등이 있다.이것은 관상동맥의 전체 길이와 종종 더 작은 동맥에 영향을 미치는 것으로 볼 수 있다.[2]CAV에서는 석회화가 항상 발생하는 것은 아니며 만약 석회화가 나타나면 늦게 일어난다.[8]보상 동맥확장은 CAV에서 발생하지 않는다.[8]동맥경화증으로 인한 관상동맥질환이 있는 비전환자와 달리 혈관 루멘의 혈전(혈전)으로 CAV를 폐쇄하는 경우는 드물다.[2]
염증 및 내피 부상은 기증자 체포, 장기 조달, 백혈병 및 레퍼루션에 의해 유발될 수 있다.[2]
진단
증상이 워낙 다양하고 결석하는 경우가 많아 진단이 난제였다.따라서, 질병의 초기 징후에 대한 정기적인 후속 조치와 모니터링이 주창된다.[2]
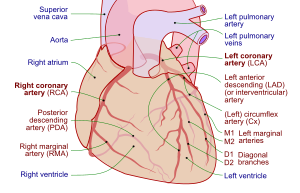
관상동맥 혈관 조영술
감시는 선택 진단 시험인 심장 카테터 검사실에서 정기적으로 관상동맥 혈관조영술을 반복하여 수행한다.[2]이것은 일반적으로 이식 후 처음 5년간 매년 시행된다.[8]CAV의 혈관조영술은 특징적으로 큰 관상동맥의 확산 협착과 "주변 제거"라고도 알려진 더 작은 관상동맥의 감소된 수를 보여준다.[2][6]그러나 CAV는 관상동맥의 전체 길이에 자주 영향을 미치기 때문에 혈관조영술만으로는 CAV가 뚜렷하지 않을 수 있다.[2]
혈관내 초음파(IVUS)
혈관내 초음파(IVUS)는 동맥벽의 근거리 층 두께의 미세한 변화를 신뢰성 있게 감지하는 데 더욱 민감하며 동맥 내강 측정을 제공한다.이식 후, 연속 측정치를 기준치와 비교한다.이식 후 1년 후 0.5mm 이상의 근두께가 증가하면 5년 이내에 혈관조영술에서 CAV 변화를 예측할 수 있다.혈관 내 초음파로도 혈관 수의 역설적인 감소 효과를 발견할 수 있다.[2][8]
그러나 IVUS는 침습적이라는 단점 때문에 연구에 이용되는 경향이 있어 조영제와 비용을 사용해야 한다.[8]
도부타민 스트레스 심초음파검사(DSE)
또는 도부타민 스트레스 심초음파검사(DSE)가 일반적으로 수행되며 CAV 존재에 대한 민감도가 85%이다.부정적인 DSE는 좋은 예후와 관련이 있다.[8]
다른 비침습성 진단으로는 양전자 방출 단층 촬영과 컴퓨터 단층 촬영 혈관 조영(CT 혈관 조영)이 있다.[2]또한 심전도에는 등심혈증의 비정상적인 특성이 나타날 수 있다.[8]
바이오마커
CAV 위험 증가를 위한 바이오마커에는 C-reactive 단백질, 혈청 브레인 나트륨 펩타이드, 트로포닌 등이 제안되어 왔다.[2]
분류
심장 이식 후 CAV의 정도는 The Cardiac Transplant Research Database, ISHLT registry, The United Network for Organ Sharing registry 등 다양한 출처에서 획득되었다.[8]
국제심폐이식학회(ISHLT)는 진단 결과를 토대로 CAV의 존재와 심각성을 규정하는 용어를 공식화하고 표준화했으며, 이는 결국 예후를 반영한다.[8][10]CAV의 중증도는 관상동맥의 좁아짐 정도와 제한성 심장질환의 유무에 의해 정의된다.[8]
| 코드 | 심각도 | 진단 결과[10] |
|---|---|---|
| 이슐트 카브0 | 중요하지 않음 | 혈관 조영에 감지 가능한 병변이 없음 |
| 이슐트 캐브1 | 마일드 | 혈관조영 좌뇌본(LM) 50% 또는 최대 병변이 70%인 1차 혈관 또는 모든 가지 협착증 70%(확산축소 포함) all70% |
| 이슐트 캐브2 | 중간 | 혈관 조영 LM 50%; 1차 혈관 1개 %,70% 또는 2개 계통 분기에서 격리된 분기 협착 7070%, 모든 기프트 기능 저하 없음 |
| 이슐트 캐브3 | 심각하다 | 혈관 조영 LM 50% 또는 2개 이상의 1차 혈관 70% 협착 또는 3개 시스템 모두에서 격리된 분기 협착 70% 또는 모든 기프트 기능 장애가 있는 ISHLT CAV1 또는 CAV2(주로 LVEF 45%로 정의됨) 또는 상당한 제약적 생리학적 증거 |
치료
스타틴스
일단 개발된 CAV 기존 치료는 효과가 없는 경우가 많기 때문에 CAV 진행 예방이 중요하다.[2]이식 후 초기에 스타틴 프라바스타틴과 심바스타틴을 시작하면 CAV 발생률과 심각도가 감소한다.[2][8]
비타민
면역억제제와 결합하면 비타민 C와 E에 의해 CAV의 진행이 느려질 수 있다.[8]
아스피린
심장 이식을 하지 않은 사람에게 이미 관상동맥 질환에서 아스피린의 역할이 확립되어 있기 때문에 대개는 심장 이식 후에 주기도 한다.[2]
항균제
COV 검출 시 mTO 억제제 시로리무스와 에버올리무스를 포함한 약물이 질병 진행을 늦추는 것으로 나타났다.[2]
기타 치료 옵션
임상적으로 유의한 CAV는 초점 질환에 대한 경피적 관상동맥 중재가 필요할 수 있지만, 재발 가능성이 높다.[2]심장 이식을 반복하는 것이 고려될 수 있다.[2]
결과
일단 좌심실 방출 분율과 심부전의 증상이 감소되면 결과는 대개 좋지 않다.[2]혈관조영술에 CAV가 있을 경우 주요 이상 심혈관 질환의 위험은 3.4배 증가한다.[8]
역학
심장 이식 후 CAV의 빈도는 The Cardiac Transplant Research Database, ISHLT registry, The United Network for Organ Sharing registry 등 다양한 출처를 통해 얻어졌다.[8]1994년과 2001년 사이에 비해, 2001년과 2007년 사이에 CAV 발생률이 감소하였다.[8]ISHLT 수치는 심장 이식 후 10년 동안 약 50%의 CAV 발생률을 보여준다.[8]
CAV는 심장 이식에 이어 사망률이 늦어지는 주요 원인이다.[2]대부분은 심하지 않지만 심장 이식으로 인해 1년 동안 11-13%의 사망에 기여한다.[1]
역사
이식된 심장의 CAV는 거부반응과 감염과 달리 초기에 예측된 결과가 아니었다.[12]심장 이식 수술의 초기 생존자들은 곧 그들의 관상동맥의 이런 형태의 혈관조영증을 발달시켰는데, 이것은 처음에 사후 검사에서 확인되었다.[12]CMV(사이토메갈로바이러스) 감염을 예방하면 CAV 유행을 줄일 수 있다는 초기 제안이 있었다.[12]CAV의 영향은 시간이 지남에 따라 달라져 초기 수혜자는 젊어지고 거부반응과 심혈관 위험인자가 많아지고 스타틴의 사용량이 줄어들었다.[12]이후 받는 사람들은 스타틴을 일상적으로 사용했고 면역억제제 mycophenolate mofetil(MMF)과 CMV propylaxis에 도입되었다.[12]또한, 항체 매개 심근경색거부(AMR)에 대한 추적 관찰이 이루어졌다.[12]
2010년 이전에는 CAV 명칭에 대한 통일된 국제 표준이 없었다.[4]CAV 표준 언어에 대한 합의문은 2010년 ISHLT에 의해 처음 발표되었다.[4]이것은 심장내막 생검에 의해 이전의 급성 거부반응 등급제와 유사한 방법으로 고안되었다.[10][13]
연구 방향
항체 매개 심근경색제거(AMR)는 CAV의 빠른 진행을 이끄는 중요한 요인이다.[12]이 영역의 향후 연구 방향에는 AMR의 발병률 및 심각도, CMV 감염 빈도 및 면역억제제 사용에 대한 감시와 임상 요인을 상관시키는 미래 데이터베이스가 포함될 수 있다.면역 내성을 유도하는 역할은 아직 정해지지 않았다.[12]
참조
- ^ a b c d e f g h Shanmuganathan, Mayooran; Dar, Owais (2020). "73. Complications of heart transplantation". In Raja, Shahzad G. (ed.). Cardiac Surgery: A Complete Guide. Switzerland: Springer. p. 669. ISBN 978-3-030-24176-6.
- ^ a b c d e f g h i j k l m n o p q r s t u v w x y z aa ab ac ad ae af ag ah ai aj ak Stehlik, Josef; Kobashigawa, Jon; Hunt, Sharon A.; Reichenspurner, Hermann; Kirklin, James K. (2 January 2018). "Honoring 50 Years of Clinical Heart Transplantation in Circulation". Circulation. 137 (1): 71–87. doi:10.1161/CIRCULATIONAHA.117.029753. PMID 29279339.
- ^ Pober, Jordan S; Chih, Sharon; Kobashigawa, Jon; Madsen, Joren C; Tellides, George (3 August 2021). "Cardiac allograft vasculopathy: current review and future research directions". Cardiovascular Research. 117 (13): 2624–2638. doi:10.1093/cvr/cvab259. PMC 8783389. PMID 34343276.
- ^ a b c Elsevier (2010). "New ISHLT Cardiac Allograft Vasculopathy Standardized Nomenclature: A Common International Definition Will Benefit Heart Transplant Patients". www.elsevier.com. Elsevier. Retrieved 27 January 2019.
- ^ Dipchand, Anne I. (2018-01-02). "Current state of pediatric cardiac transplantation". Annals of Cardiothoracic Surgery. 7 (1): 31–55–55. doi:10.21037/acs.2018.01.07. ISSN 2225-319X. PMC 5827130. PMID 29492382.
- ^ a b Lee, Michael S.; Tadwalkar, Rigved V.; Fearon, William F.; Kirtane, Ajay J.; Patel, Amisha J.; Patel, Chetan B.; Ali, Ziad; Rao, Sunil V. (2018-12-01). "Cardiac allograft vasculopathy: A review". Catheterization and Cardiovascular Interventions. 92 (7): E527–E536. doi:10.1002/ccd.27893. ISSN 1522-726X. PMID 30265435. S2CID 52880607.(필요한 경우)
- ^ Lee, Felicity; Nair, Vidhya; Chih, Sharon (2020). "Cardiac allograft vasculopathy: Insights on pathogenesis and therapy". Clinical Transplantation. 34 (3): e13794. doi:10.1111/ctr.13794. ISSN 1399-0012. PMID 31991002. S2CID 210948957.
- ^ a b c d e f g h i j k l m n o p q r s t u Eisen, Howard J. (2016). "19. Complications after cardiac transplantation". In Domanski, Michael J.; Mehra, Mandeep R.; Pfeffer, Marc A. (eds.). Oxford Textbook of Advanced Heart Failure and Cardiac Transplantation. Oxford University Press. p. 323. ISBN 9780198734871.
- ^ Blausen.com staff; staff, Blausen com (2014). "Medical gallery of Blausen Medical 2014". WikiJournal of Medicine. 1 (2): 10. doi:10.15347/wjm/2014.010. ISSN 2002-4436.
- ^ a b c Mehra, Mandeep R.; Crespo-Leiro, Maria G.; Dipchand, Anne; Ensminger, Stephan M.; Hiemann, Nicola E.; Kobashigawa, Jon A.; Madsen, Joren; Parameshwar, Jayan; Starling, Randall C. (July 2010). Patricia A. Uber. "International Society for Heart and Lung Transplantation working formulation of a standardized nomenclature for cardiac allograft vasculopathy—2010". The Journal of Heart and Lung Transplantation. 29 (7): 717–27. doi:10.1016/j.healun.2010.05.017. PMID 20620917. Retrieved 27 January 2019.
- ^ Nascimento, Bruno Ramos; Gomes, Thalles Oliveira; Borges, Júlio César; Athayde, Guilherme Rafael Sant'Anna; de Andrade, Sílvio Amadeu; Moreira, Maria da Consolação Vieira (2013). "Primary Angioplasty for Cardiac Allograft Vasculopathy Presenting as ST-Elevation Acute Myocardial Infarction during Endomyocardial Biopsy". Case Reports in Transplantation. 2013: 606481. doi:10.1155/2013/606481. ISSN 2090-6943. PMC 3771468. PMID 24066253.
- ^ a b c d e f g h Hunt, Sharon A. (2017-11-27). "Cardiac Allograft Vasculopathy: It Really Has Changed Over Time". JACC: Heart Failure. 5 (12): 902–903. doi:10.1016/j.jchf.2017.09.013. ISSN 2213-1779. PMID 29191296.
- ^ Mehra, M. R. (2006). "Contemporary Concepts in Prevention and Treatment of Cardiac Allograft Vasculopathy". American Journal of Transplantation. 6 (6): 1248–1256. doi:10.1111/j.1600-6143.2006.01314.x. ISSN 1600-6143. PMID 16686747. S2CID 22840034.



