아스파라긴펩타이드 리아제
Asparagine peptide lyase아스파라긴펩타이드 리아제는 프로테롤리틱 효소, 펩티다제 또는 단백질화제라고도 불리는 프로테아제가 촉매 잔류물에 따라 분류되는 7개 그룹 중 하나이다.아스파라긴 펩타이드 라이징의 촉매 메커니즘은 펩타이드 결합의 파단을 촉매하기 위해 가수분해보다는 핵분열 반응을 수행하기 위한 핵분열로 작용하는 아스파라긴 잔류물을 포함한다.[1]
가수 분해 대신 자가 처리로 펩타이드 결합 갈라짐이 발생하는 이 일곱 번째 촉매제 유형의 프로테아제 존재는 대장균으로부터 Tsh 자가 제거 전구체의 결정 구조를 발견함으로써 입증되었다.[2]
합성
이 효소들은 전구체나 추진체로 합성되는데, 이것은 자기복제 반응에 의해 스스로 갈라진다.[2]
아스파라긴 펩타이드 리아제의 자가 제거 성질은 효소 활성도가 효소를 파괴한다는 점에서 효소의 일반적인 정의와 모순된다.그러나 자가처리는 단백질 분해 효소의 작용으로 효소가 반응으로부터 회복할 수 없음에도 불구하고, 자기처리는 단백질 분해 효소의 작용이다.[1]
활성 사이트 및 촉매 메커니즘
아스파라긴 펩타이드 리아제의 모든 단백질 분해 활성은 자기 제거일 뿐, 그러면 더 이상의 펩티다아제 활성은 일어나지 않는다.[3]
활성 부위의 주요 잔류물은 아스파라긴이며 촉매 메커니즘에 관련된 다른 잔류물이 있으며, 아스파라긴 펩타이드 리아제의 여러 제품군 간에 다르다.[2][4][5]
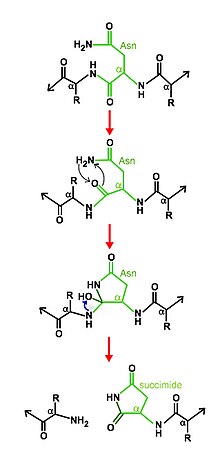
갈라짐 메커니즘은 아스파라긴의 사이클화로 구성되며, 다른 활성 부위 잔류물의 도움을 받는다.특정 조건에서 아스파라긴 순환 구조는 C-terminal 펩타이드 결합을 메인 체인에 핵포착적으로 공격하여 새로운 결합을 형성하여 안정된 숙시니미드를 생성하여 메인 체인에서 스스로를 분리시키고 결과적으로 제품의 두 반쪽을 방출한다.[6][7]
억제
분류
MEROPS 프로테아제 데이터베이스는 6개의 서로 다른 프로테아제군에 포함된 아스파라긴 펩타이드 라이아제의 다음 10개 제품군을 포함한다.[3]
단백질 분해 효소는 염기서열 유사성에 기초하여 패밀리로 분류된다.각 제품군에는 동질 서열과 공통 촉매 유형을 가진 단백질 분해 효소가 포함된다.클랜은 촉매 유형이 보존되지 않는 관련 구조를 가진 단백질 분해 효소 계열의 그룹이다.
| 씨족 | 가족 | MEROPS ID | 펩티다제 및 호몰로게스 | NC-IUMB | PDB ID |
| NA | N1 | N01.001 | 노다바이러스 코팅 단백질 | 3.4.23.44 | 2BBV |
| 미지정의 | 패밀리 N1 미지정 펩타이드 리아제 | * | - | ||
| N2 | N02.001 | 테트라바이러스 코팅 단백질 | * | 1OHF | |
| 무반복성 호몰로뉴 | 가족 N2 비합리화 호몰로지 | * | - | ||
| 미지정의 | 패밀리 N2 미지정 펩타이드 리아제 | * | - | ||
| N8 | N08.001 | 피코나바이러스 캡시드 VP0형 자기소독 단백질 | * | 1NCQ | |
| 무반복성 호몰로뉴 | 가족 N8 비합리화 동음이의어 | * | - | ||
| 미지정의 | 제품군 N8 미지정 펩타이드 리아제 | * | - | ||
| NB | N6 | N06.001 | YscU 단백질(Yersinia pseudotuberculosis) | * | 2JLJ |
| N06.002 | 스파스 단백질(살모넬라 sp) | * | 3C01; 2VT1 | ||
| N06.003 | EscU 단백질(대장균) | * | 3BZO | ||
| N06.004 | HrcU단백질(크산토모나스 sp.) | * | - | ||
| N06.A01 | FLHB단백질(대장균) | * | - | ||
| 무반복성 호몰로뉴 | 가족 N6 비합리화 동음이의어 | * | - | ||
| 미지정의 | 제품군 N6 미지정 펩타이드 리아제 | * | - | ||
| NC | N7 | N07.001 | 레오바이러스 타입 1 코트 단백질 | * | 1JMU |
| N07.002 | 아쿠아레오바이러스 코팅 단백질 | * | - | ||
| 미지정의 | N7 제품군 미지정 펩타이드 리아제 | * | - | ||
| ND | N4 | N04.001 | Tsh 관련 자기 청정 영역(대장균) 및 유사 | * | 3AEH |
| N04.002 | EsP 감마 단백질 오토트랜스포터 도메인(에스케리치형) | * | 2QOM | ||
| 무반복성 호몰로뉴 | 가족 N4 비합리화 동음이의어 | * | - | ||
| 미지정의 | 패밀리 N4 미지정 펩타이드 리아제 | * | - | ||
| NE | N5 | N05.001 | 피코비르나바이러스 자가 제거 단백질 | * | 2VF1 |
| 미지정의 | 패밀리 N5 미지정 펩타이드 리아제 | * | - | ||
| PD | N9 | N09.001 | 내장형 V형 양성자 ATPase 촉매 서브유닛 A | 3.6.3.14 | 1VDE |
| 무반복성 호몰로뉴 | N9가족 비합리화 호몰로지 | * | - | ||
| 미지정의 | 패밀리 N9 미지정 펩타이드 리아제 | * | - | ||
| N10 | N10.001 | 내장 DNA 자이드 소단위 A 전구체 | * | - | |
| N10.002 | 내장 복제 DNA 헬리코아제 전구체 | * | 1MI8 | ||
| N10.003 | 정합성 DNA 중합효소 III 아단위 알파 전구체 | 2.7.7.7 | 2KEQ | ||
| N10.004 | 내장형 번역 개시 계수 IF-2 전구체 | - | |||
| N10.005 | 정수 함유 DNA 중합효소 II 대형 서브유닛 DP2 전구체 Mername-AA281 | * | - | ||
| N10.006 | 정수 함유 DNA 중합효소 II 대형 서브유닛 DP2 전구체 Mername-AA282 | 2.7.7.7 | - | ||
| N10.007 | DNA에 의존하는 DNA중합효소 전구체 | * | 2CW7, 2CW8 | ||
| N10.008 | 내장 DNA gyrase 하위단위 A(Mycobacterium xenopi) | * | 1AM2; 4OZ6 | ||
| N10.009 | MTU recA 정수(Mycobacterium sp). | * | 2IN9 | ||
| 무반복성 호몰로뉴 | N10가족 비합리화 동음이의어 | * | - | ||
| 미지정의 | 패밀리 N10 미지정 펩타이드 리아제 | * | - | ||
| N11 | N11.001 | 정수 함유 엽록체 ATP 의존 펩타이드 리아제 | * | - | |
| 무반복성 호몰로뉴 | 가족 N11 비합리화 동음이의어 | * | - | ||
| 미지정의 | 패밀리 N11 미지정 펩타이드 리아제 | * | - |
*IUMB 권장 사항에 아직 포함되지 않음.
분포 및 유형
아스파라긴 펩타이드 리아제의 10가지 다른 제품군은 다음과 같은 세 가지 유형으로 나누어진다.
- 바이러스성 코팅 단백질
- 오토트랜스포터 단백질
- 내장단백질
바이러스성 코팅 단백질(N1, N2, N8, N7, N5)의 5개 제품군, 자가 이식 단백질(N6, N4)의 2개 제품군, 정수 단백질(N9, N10, N11)의 3개 제품군이 있다.
바이러스성 코팅 단백질
아스파라긴 잔여물에서 가공이 발생하는 바이러스성 코팅 단백질은 5개 제품군이 있다.이 다섯 집단은 클랜 NA(가족 N1, N2, N8)와 NC(가족 N7) 그리고 NE(가족 N5)의 세 집단에 포함된다.[8]
패밀리 N1: 알려진 자가합성 갈라짐은 코팅 단백질의 C-terminus로부터 노다바이러스 내분비에 의해 매개되며, 조립된 처녀막 내에서만 발생한다.[9]
패밀리 N2: 테트라비루즈 내복종 포함.알려진 자가합성 갈라짐은 코팅 단백질의 C-terminus에서 나온 것이다.갈라진 틈은 처녀자리 조립 후기에 발생한다.[10]
N8 가족: 알려진 자가 분해는 소아마비바이러스 VP0 바이러스 캡시드 단백질을 VP2와 VP4에 있다.[11]
패밀리 N7: 알려진 자가용 갈라짐은 코팅 단백질의 N-terminus에서 나온 것이다.[12]
패밀리 N5: 알려진 자가용 갈라짐은 코팅 단백질의 N-terminus에서 나온 것이다.[13]
오토트랜스포터 단백질
오토트랜스포터 단백질은 광범위한 그램 음성 박테리아에서 발견되는 외부 막이나 분비 단백질이다.이 단백질에는 신호 시퀀스, N단자에 위치한 승객 영역, C단자에 위치한 변환기 또는 자동 회전기 영역의 세 가지 구조 모티브가 들어 있어 베타 배럴 구조를 형성하고 있다.이러한 구조는 단백질 자가수송을 촉진한다.자기반스포터 단백질은 보통 독성 기능과 관련이 있다.이 사실은 숙주 세포와의 상호 작용과 자동 전파 인코딩 유전자의 광범위한 발생은 그램 음성 병원균에 대한 백신 설계의 치료 목표를 나타낼 가능성을 제기한다.[14]
MEROPS 데이터베이스가 아스파라긴 펩타이드 리야스를 분류하는 패밀리 중 두 패밀리는 자기반스포터 단백질, N4와 N6이다.[3]
패밀리 N4는 엔토박테리아로부터 분비된 바이럴 인자 또는 자동발견자를 포함한다.그들의 유일한 단백질 활동은 전구체로부터 독성인자를 방출하여 그것을 분비할 수 있게 하는 것이다.N4 아스파라긴 펩타이드 라이아제의 활성 부위 잔류물은 N1100, Y1227, E1249 및 R1282이다.
패밀리 N6는 타입 III 단백질 분비 시스템에 관여하는 자동 처리 내인성분비를 포함한다. 이 시스템에서는 단백질 분비를 매개하는 데 자동 자극이 필수적이다.제3형 분비 시스템은 숙주세포에 침투하는 속이 빈 관 구조인 주입에 의해 숙주세포로 단백질을 직접 분비한다.분비된 단백질은 주입액을 통해 숙주 세포질 속으로 통과할 수 있다.N6 아스파라긴 펩타이드 라이아제의 보존 활성 부위 잔류물은 N263이다.
내장단백질
정수는 다른 단백질인 엑스테인 안에 들어 있는 단백질이다.기생 DNA는 엔도뉴클레스를 암호화하는 정수 유전자를 감염시킨다.결과 cDNA(완성 DNA)는 정수와 함께 엑스테인을 암호화한다.이 정수에는 자기 청정 영역이 들어 있는데, 그 안에 내포된 내포뉴클레스가 있다.정인영역은 자신의 N-terminus와 C-terminus에서 두 개의 단백질 분할을 수행하고 Extein에서 분리하여 두 조각으로 분리한다.그리고 나서 이 두 조각은 함께 쪼개지고 엑스테인은 완전히 기능적인 단백질로 남아있다.
정수 영역의 N단자 잔류물은 세린, 트레오닌 또는 시스테인이어야 하며 에스테르 또는 티오에스터를 형성하기 위해 이전의 펩타이드 결합을 공격한다.엑스테인의 두 번째 부분의 첫 번째 잔여물은 세린, 트레오닌 또는 시스테인이어야 하며, 이 두 번째 핵분열체는 분기된 중간자를 형성한다.정수 영역의 C-단자 잔류물은 항상 아스파라긴으로 사이클링하여 숙시니미드를 형성하여 자체 펩타이드 결합을 분리하고 엑스테인으로부터 정수를 방출한다.마지막으로, 에스테르 또는 티오에스터 결합을 다시 배열하여 정상적인 펩타이드 결합을 형성한다.[15]
알려진 세 가지의 정함유 단백질 계열(N9, N10, N11)이 모두 PD 클랜에 포함되어 있으며, 여기에는 서로 다른 촉매 유형의 단백질 분해 효소가 포함되어 있다.3차 구조는 N9 계열의 멤버인 정맥 V형 양성자 ATPase 촉매 서브 유닛(Saccharometic serebisiae)과 N10 계열의 여러 정수에 대해 해결되었다.
참고 항목
참조
- ^ a b Rawlings, N. D.; Barrett, A. J.; Bateman, A. (4 November 2011). "Asparagine peptide lyases: A seventh catalytic type of proteolytic enzymes". The Journal of Biological Chemistry. 286 (44): 38321–8. doi:10.1074/jbc.M111.260026. PMC 3207474. PMID 21832066.
- ^ a b c Tajima, N.; Kawai, F.; Park, S. Y.; Tame, J. R. (2010). "A novel intein-like autoproteolytic mechanism in autotransporter proteins". Journal of Molecular Biology. 402 (4): 645–56. doi:10.1016/j.jmb.2010.06.068. PMID 20615416.
- ^ a b c d Rawlings, Neil D.; Barrett, Alan J.; Finn, Robert (2016). "Twenty years of the MEROPS database of proteolytic enzymes, their substrates and inhibitors". Nucleic Acids Research. 44 (D1): D343–D350. doi:10.1093/nar/gkv1118. PMC 4702814. PMID 26527717.
- ^ Dautin, N, Barnard, T. J, Anderson, D. E, Bernstein, H. D. E., 그리고 H. D. Bernstein, H. D. J. 26, 1942-1952년 EMBO J.
- ^ J. March, Advanced Organic Chemistry, 4번째 Ed, Wiley, 1992년 뉴욕,
- ^ Dehart, M. P., Anderson, B. D. (2007) J. 제약.공상 96, 2667-2685
- ^ R. A. Rossi, R. H. de Rossi, SRN1 메커니즘에 의한 방향성 대체, ACS Monograph Series No. 178, American Chemical Society, 1983
- ^ Rawlings, Neil D.; Salvesen, Guy S. (2012). Handbook of Proteolytic Enzymes, 3rd Edition. ISBN 9780123822192.
- ^ Reddy, A, Schneemann, A & Johnson, J.E.Nodavirus endopoptidase.단백질 분해 효소 핸드북에서, 2 edn (Barrett, A.J., Rawlings, N.D. & Woessner, J.F. eds), 페이지197-201, 엘스비에, 런던(2004)
- ^ Taylor, D.J. & Johnson, J.E. 접힘 및 입자 조립은 누다렐리아 카펜시스 오메가 바이러스 캡시드 단백질의 자기분석적 갈라짐 현장 근처에서 단점 돌연변이로 인해 중단된다.단백질 과학 (2005) 14, 401-408
- ^ "MEROPS - the Peptidase Database". merops.sanger.ac.uk. Retrieved 2016-10-22.
- ^ "MEROPS - the Peptidase Database". merops.sanger.ac.uk. Retrieved 2016-10-22.
- ^ "MEROPS - the Peptidase Database". merops.sanger.ac.uk. Retrieved 2016-10-22.
- ^ 웰스 TJ, 트리 JJ, 우렛 GC, 젬브리 MA. 오토트랜스포터 단백질: 박테리아 세포 표면의 새로운 표적.(2007) 274(2), 163-72
- ^ 앨런 J. 배럿, 닐 D.롤링스, J. 프레드 워스너단백질 분해 효소 핸드북.제3판.(2013) (pp. 14-16)
추가 읽기
- 롤링스 ND, 배럿 AJ, 베이트맨 A.아스파라긴 펩타이드 리아제: 일곱 번째 촉매제 형태의 단백질 분해 효소. 2011년 11월 4일;286(44):38321-8.
- 앨런 J. 배럿, 닐 D.롤링스, J. 프레드(2012).단백질 분해 효소 핸드북.제3판.ISBN 97801238 9708
- 구오야오 우 (2013) 아미노산: 생화학 및 영양.ISBN 9781439861899
- 클라우디아 브릭스, 월터 스토커 (2014년 1월 21일)프로테아제: 구조 및 기능.ISBN 9783709108857
- 진장, 소흠 메타, 카스텐 슐츠(2016).생물학의 광학 탐사선.ISBN 9781466510128
외부 링크
| 라이브러리 리소스 정보 아스파라긴펩타이드 리아제 |