오르가노틴 화학
Organotin chemistry오르가노틴 화합물 또는 스탠나인은 탄화수소 대체물이 있는 주석 기반의 화학 화합물이다. 오르가노틴 화학은 유기농 화학의 광범위한 분야 중 하나이다. 최초의 오르가노틴 화합물은 1849년 에드워드 프랭클랜드에 의해 발견된 디에틸틴 다이오다이오드(CH25)2SnI이다2.[1] 이 지역은 특히 Sn-C 채권을 생산하는 데 유용한 그리그나드 시약이 발견된 이후인 1900년대에 급속히 성장했다. 그 지역은 산업 분야에서 많은 응용과 연구소에서 계속되는 활동으로 부유하게 남아 있다.[2]
구조
오르가노틴 화합물은 일반적으로 산화 상태에 따라 분류된다. 주석 화합물은 훨씬 더 흔하고 유용하다.
주석(IV)의 유기파생상품
테트라오르간 유도체는 변함없이 사면체다. SnRR'R'R' 유형의 화합물이 개별 항산화제로 분해되었다.[3]
오르가노틴 할로겐화제
오르가노틴 염소화물은 n 최대 3의 값에 대해 RSnCl이라는4−nn 공식을 가지고 있다. 브로미이드, 요오드화합물, 불소화합물 등도 알려져 있다. 이들 화합물은 많은 R그룹으로 알려져 있다. 그들은 항상 사면체다. 트리힐라이드와 디할라이드는 피리딘과 같은 좋은 루이스 기지를 가지고 기단을 형성한다. 불소는 디메틸틴 이플루오라이드가 시트 같은 중합체를 형성하는 것과 연관되는 경향이 있다. 예를 들어 염화 트리부틸틴과 같은 디- 및 특히 트리오르가노틴은 시안화수소에 접근하는 독성을 나타낸다.[4]
오르가노틴 하이드라이드
오르가노틴 하이드리드에는 n 최대 4의 값에 대한 RSnH라는4−nn 공식이 있다. 이 시리즈의 모태인 Stannane(SnH4)은 불안정한 무색 기체다. 안정성은 유기 대체물의 수와 상관관계가 있다. 히드라이드 트리뷰티린 하이드라이드는 일부 유기농 반응에서 하이드라이드 레디컬의 원천으로 사용된다.
오르가노틴 산화물 및 수산화물
오르가노틴 산화물 및 수산화물은 오르가노틴 할로겐화물의 가수분해에서 나오는 흔한 산물이다. 실리콘과 게르마늄의 해당 파생상품과는 달리, 주석 산화물 및 수산화물은 특히 디오르가노 및 모노가노가노 파생상품의 경우 펜타(Penta) 및 심지어 육각화 주석센터(Hexacoordin centre)가 있는 구조를 채택하는 경우가 많다. 그룹 Sn-O-Sn은 스타녹산이라고 불린다. 산화물과 수산화물 중 구조적으로 가장 간단한 것은 트리오가노틴 유도체다. 상업적으로 중요한 트리오르가노틴 수산화물은 아카리아제 시헥사틴(플릭트란이라고도 함), (CH611)3SnOH이다. 그러한 트리오가노틴 수산화물은 디스타녹스(distannoxanes)와 평형 상태로 존재한다.
- 2 RSnOH3 ⇌ RSnR33 + HO2
각 Sn 센터에 두 개의 유기 대체물만 있으면, diorganotin oxide와 수산화물은 구조적으로 3개 유기체 유도체보다 더 복잡하다.[5] 단순한 보석 다이올(RSN2(OH))2과 단조로운 스탠나논(RSN2=O)은 알려져 있지 않다. Diorganotin산화물(RSNO2)은 유기 대체물이 매우 부피가 큰 경우를 제외하고, 주기적 트리머나 R = CH(SiMe3)2 다이머의 경우 SnO33 및 SnO22 링이 있는 폴리머다. 디스타녹스(distannoxanes)는 X 그룹(예: 염화물, 수산화물, 카복실산)에서 단자 또는 브리징이 될 수 있는 [RSNX2]2O2 공식을 가진 조광기의 조광기로 존재한다(표 참조). 모노오르가노틴 삼할리드의 가수분해에는 스탠나노산, RSnO2H가 발생할 가능성이 있다. 디오르가노틴 산화물/수소화물의 경우, 모노가노가노틴 종은 탈수/수소화, 집합이 발생하기 때문에 구조적으로 복잡하게 형성된다. 예시는 [(BuSn)12O14(OH)]62+를 주기 위해 부틸틴 트리클로라이드를 가수 분해하는 것이다.
하이퍼 조정식 스탠나인
탄소(IV) 아날로그와는 달리 실리콘 화합물과 다소 유사하게 주석(IV)도 일반 4개 대신 5개, 심지어 6개 원자로 조율이 가능하다. 이러한 과조정 화합물은 대개 전기적 대체 물질을 가지고 있다. 오르가노틴 산화물, 관련 카르복실산염 및 관련 유사살균 유도체에 의해 수많은 고밸런스의 예가 제공된다.[5] 오르가노틴은 예: MeSnCl22(비피리딘)과 같은 유도체를 위해 반으로 줄인다.
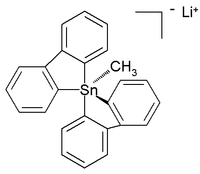
모든 유기농 펜타-육각형 및 육각형성분들도 특징지어지는 반면,[6] 그 다음 해에는 6개의 조정된 테트라오르가노틴 화합물이 보고되었다.[7] 상온 안정(아르곤) 전탄소 펜타오르고스타난네의 결정 구조는 다음과 같은 구조를 가진 리튬 염으로 보고되었다.[8]
이 왜곡된 삼각형 바이피라미달 구조에서 탄소 대 주석 결합 길이(2.26 å ap ical, 2.17 equator 적도)는 그것의 초가치 성질을 반영하는 일반 C-Sn 결합(2.14 å)보다 크다.
트리오가노틴 양이온
트리오가노틴의 일부 반응은 R3Sn+ 중간자 역할을 포함한다. 그러한 양이온들은 탄화수소와 유사하다. 그것들은 2,4,6-트리소프로필페닐과 같이 유기 대체물이 클 때 결정적으로 특징지어져 왔다.[9]
주석산소(주석(III)의 유기 유도체)
RSn이라는3 공식을 가진 주석산소들은 stannyl산소라고 불린다.[2] 그것들은 특정 원자 전달 반응에서 매개체로 작용한다. 예를 들어, 트리뷰티린 하이드라이드(트리-n-butylstananane)는 트리뷰티틴 라디칼의 안정성 때문에 "수소 원자"의 유용한 원천 역할을 한다.[10]
주석 유기 유도체().II)
오르가노틴(Organotin).II) 화합물은 다소 드물다. 경험적 공식 SnR을2 가진 화합물은 다소 연약하며 R이 부피가 크지 않을 때 링이나 폴리머로 존재한다. 폴리스타난이라고 불리는 중합체는 공식(SnR2)을 가지고 있다.n
원칙적으로 이분 주석 화합물은 공식적인 이중 결합을 가진 연골의 유사성을 형성할 것으로 예상할 수 있다. 실제로 디스타네네라고 불리는 SnR이라는24 공식을 가진 화합물들은 특정한 유기 대체물로 알려져 있다. Sn 센터들은 매우 피라미드적인 경향이 있다. SnR이라는2 공식을 가진 단층 화합물, 카르벤의 유사성도 몇 가지 경우에 알려져 있다. 예를 들면 Sn(SiR3)이 있는데,2 여기서 R은 매우 부피가 큰 CH(SiMe3)2이다(Me = 메틸). 그러한 종은 결정화 시 디스타닐렌에 가역적으로 약해진다.[11]
- 2 RSn2 ⇌ (RSN2)2
주석-탄소 이중 결합을 가진 화합물인 Stannenes는 Stannabenzene의 파생상품으로 대표된다. 시클로펜타디엔의 구조적 아날로그인 Stannoles는 C-Sn 더블 본드 캐릭터를 거의 나타내지 않는다.
주석(I)의 유기 유도체
Sn(I)의 화합물은 드물며 매우 부피가 큰 리간드로만 관측된다. 저명한 우리 가족 중 하나는 2,6-diethylphenylon-대체 트리스탄니렌[Sn(CH-263,6-Et2)]23의 열분해로 접근하는데, 이 물질은 큐바인 타입의 클러스터와 프리스만을 제공한다. 이러한 우리에는 Sn(I)이 들어 있으며 [Sn(CH-263,6-Et2)]n이라는 공식이 있다. 여기서 n = 8, 10.[12] 스타니는 탄소 대 주석 3중 결합과 두 주석 원자 사이의 3중 결합을 포함한다. 디스타니네스는 부피가 매우 큰 대용품만을 위해 존재한다. 알키네와는 달리 이들 디스타닌의 C-Sn-C 코어는 평면이지만 비선형이다. Sn-Sn 거리는 3.066(1) å이고, Sn-Sn-C 각도는 99.25(14)° 그러한 화합물은 부피가 큰 아릴틴을 감소시킴으로써 준비된다.II) 할로겐화.[13]
준비
오르가노틴 화합물은 수많은 방법으로 합성될 수 있다.[14] 고전적인 것은 예를 들어 테트라클로라이드 주석과 같은 주석 할로겐화물을 사용한 그리그나드 시약의 반응이다. 테트라에틸틴의 합성에 의해 그 예가 제공된다.[15]
- 4 EtMgBr + SnCl4 → EtSn4 + 4 MgClBr
대칭적인 테트라오르고틴 화합물, 특히 테트라알킬 유도체는 재분배 반응에 의해 다양한 혼합 염소로 변환될 수 있다(오르가노틴 화합물의 경우 "코체슈코프 복합화"라고도 한다).
- 3 RSn4 + SnCl4 → 4 RSnCl3
- RSn4 + SnCl4 → 2 RSnCl22
- RSn4 + 3 SnCl4 → 4 RSnCl3
이와 관련된 방법으로는 유기알루미늄 화합물과의 주석 할로겐화물의 재배포를 포함한다.
혼합 유기-할로 주석 화합물은 디부틸디비닐틴의 합성에 따라 혼합 유기 유도체로 변환될 수 있다.[16]
- BuSnCl22 + 2 CHMgBr23 → BuSn2(CH23)2 + 2 MgBrCl
오르가노틴 하이드라이드는 혼합 알킬 클로라이드의 감소에 의해 생성된다. 예를 들어, 리튬 알루미늄 하이드라이드를 사용한 디부틸트린 디클로로이드 처리 시 무색증류성 오일인 디부틸틴 디하이드레이드를 제공한다.[17]
알킬 나트륨 화합물과 주석 할로겐화물의 우르츠 유사 결합은 테트라오르간오틴 화합물을 생산한다.
하이드로스타니플레이션은 불포화 기판에 걸쳐 주석 하이드레이드를 금속으로 제조하여 첨가하는 것을 포함한다.[18]
반응
위에서 논의된 중요한 반응들은 대개 오르가노틴 할로겐화물과 뉴클레오필드를 가진 유사살화물에 초점을 맞춘다. 유기합성 영역에서 스틸 반응은 중요한 것으로 간주된다. 팔라듐에 의해 촉매되는 sp2 하이브리드 유기 할로겐화물과의 결합 반응을 수반한다.
및 오르가노스타나네인 첨가물(알데히드 및 이미인에 아군, 알렌릴 또는 프로파길스탄네인을 극성적으로 첨가함) 오르가노틴 화합물은 급진 화학에도 광범위하게 사용된다(예: 급진적 사이클링, 바톤-맥콤비 디옥시화, 바톤 디카르복실화 등).
적용들
오르간오틴 화합물은 폴리염화비닐에서 안정제로 상업적으로 사용된다. 이 용량에서, 그들은 동맹적인 염화물 집단을 제거하고 염화수소를 흡수함으로써 열화를 억제한다. 이 애플리케이션은 매년 약 2만 톤의 주석을 소비한다. 오르가노틴 화합물의 주요 등급은 RSN2(SR')2이라는 공식과 함께 디오르가노틴 디티올레이트다. Sn-S 결합은 반응성 성분이다. 디오르가노틴 카르복실산염(diorganotin carboxylate, 예를 들어 디부틸틴 딜라우산염)은 폴리우레탄의 형성과 실리콘의 경화, 트랜세스터화를 위한 촉매제로 사용된다.[2]
n-부틸틴 트리클로라이드는 화학 증기 증착에 의해 유리병에 이산화 주석층을 생산하는데 사용된다.
생물학적 응용
"트리부틴"은 직물 및 종이, 목재 펄프 및 제지 공장 시스템, 양조장, 산업 냉각 시스템 등에서 항균제로서 산업용 바이오시드로 사용된다. 트리페닐틴 유도체는 항균 페인트와 농약 살균제의 활성 성분으로 사용된다. 다른 트리오가노틴은 미티시드와 아세리시드로 사용된다. 산화 트리부틸틴은 목재 방부제로 널리 사용되어 왔다.[2]
트리뷰틴 화합물은 한때 해양으로 가는 선박의 효율을 높이기 위해 해양 항균제로 널리 사용되었다. 이러한 화합물의 독성에[19] 대한 우려(일부 보고서에서는 리터당 1나노그램의 농도로 해양 생물에 미치는 생물학적 영향을 설명하고 있다)는 국제해사기구(IEA)의 전 세계적인 금지로 이어졌다. 항풀링 화합물로서 오르가노틴 화합물은 디클로로옥틸이소티아졸리논으로 대체되었다.[20]
- 오르가노틴 화합물
테트라부틸틴 무색유, 다른 부틸틴 화합물의 전구체
독성이 강한 백색 고체인 트리페닐틴 염화물이 바이오시드로 사용된다.
독성 백색 고형분인 트리메틸틴 염화물이 한때 바이오시드로 사용되기도 했다.
화학 합성에 중간재로 사용되는 헥사메틸디틴
독성
트리뷰티린과 트리페닐틴 유도화합물의 독성은 시안화수소 화합물과 비교해도 손색이 없다. 게다가, 트리-n-alkyltins는 식물독성이 있어서 농업에서 사용될 수 없다. 유기 그룹에 따라 강력한 살균제와 살균제가 될 수 있다. 그들의 높은 생체 활동을 반영하여, "트리부틴"은 한때 해양 오염 방지 페인트에 사용되었다.[2]
트리오가노타인 화합물과는 대조적으로, 모노오르가노, 디오르가노, 테트라오르가노틴 화합물은 훨씬 덜 위험하다.[4]
참고 항목
참조
- ^ Caseri, Walter (2014). "Initial Organotin Chemistry". Journal of Organometallic Chemistry. 751: 20–24. doi:10.1016/j.jorganchem.2013.08.009.
- ^ a b c d e 데이비스, 알윈 조지 (2004) Organotin 화학, 제2판 Weinheim: 와일리-VCH ISBN 978-3-527-31023-4
- ^ Gielen, Marcel (1973). "From kinetics to the synthesis of chiral tetraorganotin compounds". Acc. Chem. Res. 6 (6): 198–202. doi:10.1021/ar50066a004.
- ^ a b G. G. Graf (2005). "Tin, Tin Alloys, and Tin Compounds". Ullmann's Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH. doi:10.1002/14356007.a27_049.
- ^ a b Chandrasekhar, Vadapalli; Nagendran, Selvarajan; Baskar, Viswanathan (2002). "Organotin assemblies containing Sn/O bonds". Coordination Chemistry Reviews. 235: 1–52. doi:10.1016/S0010-8545(02)00178-9.
- ^ Reich, Hans J.; Phillips, Nancy H. (1986). "Lithium-Metalloid Exchange Reactions. Observation of Lithium Pentaalkyl/aryl Tin Ate Complexes". J. Am. Chem. Soc. 108 (8): 2102–2103. doi:10.1021/ja00268a067.
- ^ V. G. Kumar Das; Lo Kong Mun; Chen Wei; Thomas C. W. Mak (1987). "Synthesis, Spectroscopic Study, and X-ray Crystal Structure of Bis[3-(2-pyridyl)-2-thienyl-C,N]diphenyltin(IV): The First Example of a Six-Coordinate Tetraorganotin Compound". Organometallics. 6: 10–14. doi:10.1021/om00144a003.
- ^ Masaichi Saito; Sanae Imaizumi; Tomoyuki Tajima; Kazuya Ishimura & Shigeru Nagase (2007). "Synthesis and Structure of Pentaorganostannate Having Five Carbon Substituents". J. Am. Chem. Soc. 129 (36): 10974–10975. doi:10.1021/ja072478+. PMID 17705378.
- ^ Greenwood, Norman N.; Earnshaw, Alan (1997). Chemistry of the Elements (2nd ed.). Butterworth-Heinemann. ISBN 978-0-08-037941-8.
- ^ T. V. RajanBabu, P. C. B. 페이지 B. R. Buckley "Tri-n-butylstannane", e-EROS 유기합성 시약 백과사전, 2004. doi:10.1002/047084289X.rt181.pub2
- ^ Holleman, Arnold Frederik; Wiberg, Egon (2001), Wiberg, Nils (ed.), Inorganic Chemistry, translated by Eagleson, Mary; Brewer, William, San Diego/Berlin: Academic Press/De Gruyter, ISBN 0-12-352651-5
- ^ Sita, Lawrence R. (1994). "Heavy-Metal Organic Chemistry: Building with Tin". Acc. Chem. Res. 27 (7): 191–197. doi:10.1021/ar00043a002.
- ^ Power, Philip P. (2007). "Bonding and Reactivity of Heavier Group 14 Element Alkyne Analogues". Organometallics. 26 (18): 4362–4372. doi:10.1021/om700365p.
- ^ Sander H.L. Thoonen; Berth-Jan Deelman; Gerard van Koten (2004). "Synthetic aspects of tetraorganotins and organotin(IV) halides" (PDF). Journal of Organometallic Chemistry (689): 2145–2157.
- ^ Der Kerk, G. J. M. Van; Luijten, J. G. A. (1956). "Tetraethyltin". Org. Synth. 36: 86ff. doi:10.15227/orgsyn.036.0086.
- ^ Seyferth, Dietmar (1959). "Di-n-butyldivinyltin". Org. Synth. 39: 10. doi:10.15227/orgsyn.039.0010.
- ^ "Organometalic Syntheses: 비변환-금속 화합물" 존 아이슈, 에드. 학술지: 1981년 뉴욕. ISBN 0122349504.
- ^ Smith, Nicholas D.; Mancuso, John; Lautens, Mark (2000). "Metal-Catalyzed Hydrostannations". Chemical Reviews. 100 (8): 3257–3282. doi:10.1021/cr9902695. PMID 11749320.
- ^ Gajda, M.; Jancso, A. (2010). "Organotins, Formation, Use, Speciation and Toxicology". Metal Ions in Life Sciences. Cambridge: RSC publishing. 7, Organometallics in environment and toxicology: 111–151. doi:10.1039/9781849730822-00111. ISBN 9781847551771.
- ^ Silva, Vânia; Silva, Cátia; Soares, Pedro; Garrido, E. Manuela; Borges, Fernanda; Garrido, Jorge (2020). "Isothiazolinone Biocides: Chemistry, Biological, and Toxicity Profiles". Molecules. 25 (4): 991. doi:10.3390/molecules25040991. PMC 7070760. PMID 32102175.
- ^ 유기합성체, 콜. 제4권, 페이지 881(1963); 제36권, 페이지 86(1956). 링크
- ^ C Gumy; et al. (2008). "Dibutyltin Disrupts Glucocorticoid Receptor Function and Impairs Glucocorticoid-Induced Suppression of Cytokine Production". PLOS ONE. 3 (10): e3545. Bibcode:2008PLoSO...3.3545G. doi:10.1371/journal.pone.0003545. PMC 2568824. PMID 18958157.






![Stille reaction scheme {\displaystyle {\ce {{R-X}+R'-SnR''3->[{\ce {Pd\ catalyst}}]{R-R'}+XSnR''3}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/16d2a781e9a7142312c1fd6052ce33fc93f0814a)