피페로날
Piperonal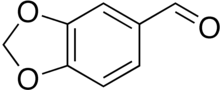 | |
| 이름 | |
|---|---|
| 선호 IUPAC 이름 2H-1,3-벤조디오xole-5-카발알데히드 | |
| 기타 이름 헬리오트로핀, 헬리오트로핀, 피페로닐 알데히드, 프로토케추이크알데히드 메틸렌에테르, 3,4-메틸렌디오섹시벤츠알데히드, | |
| 식별자 | |
3D 모델(JSmol) | |
| 131691 | |
| 체비 | |
| 켐벨 | |
| 켐스파이더 | |
| ECHA InfoCard | 100.004.009 |
| EC 번호 |
|
| 4186 | |
| 케그 | |
펍켐 CID | |
| 유니 | |
CompTox 대시보드 (EPA) | |
| |
| |
| 특성. | |
| C8H6O3 | |
| 어금질량 | 150.107 g·messages−1 |
| 외관 | 무색 결정체[1] |
| 밀도 | 1.337 g/cm3 |
| 녹는점 | 37°C(99°F, 310K)[1] |
| 비등점 | 263°C(505°F, 536K)[1] |
| 500부위[1] 용해성 | |
| 위험 | |
| GHS 라벨 표시: | |
 | |
| 경고 | |
| H317 | |
| P261, P272, P280, P302+P352, P321, P333+P313, P363, P501 | |
| 치사량 또는 농도(LD, LC): | |
LD50(중간 선량) | 2700 mg/kg(쥐의 경우 구술)[1] |
달리 명시된 경우를 제외하고, 표준 상태(25°C [77°F], 100 kPa)의 재료에 대한 데이터가 제공된다. | |
| Infobox 참조 자료 | |
헬리오트로핀으로도 알려진 피페로논은 향기와 맛에서 흔히 발견되는 유기 화합물이다.[2]이 분자는 구조적으로 다른 방향족 알데히드, 바닐린과 같은 방향족 알데히드와 관련이 있다.
자연발생
Piperonal은 다양한 식물에서 자연적으로 발생한다.예를 들면 딜, 바닐라, 보라색 꽃, 후추 등이 있다.
준비
Piperonal은 이소사프롤의 산화 분할 또는 카테콜 또는 1,2-메틸렌디오옥시벤젠의 다단계 순서를 사용하여 준비할 수 있다.후자의 화학 물질로부터의 합성은 글리옥시릴산과의 응축 반응을 거쳐 산화제로 α-히드록시산을 분해한다.[2][3][4]카테콜에서 합성하려면 디클로로메탄을 사용한 윌리엄슨 에테르 합성이라는 추가 단계가 필요하다.[5]
반응
Piperonal은 모든 알데하이드와 마찬가지로 알코올(피페로닐 알코올)로 감소하거나 산화하여 산(피페로닐산)을 줄 수 있다.
Piperononal은 타다라필,[6] L-DOPA,[7] 아트라센탄을 포함한 일부 의약품의 합성에 사용될 수 있다.[8]
향기
Piperonal은 일반적으로 바닐린이나 체리와 비슷한 꽃 냄새를 가지고 있다.이러한 이유로 향료와 인공 향료에 흔히 사용된다.[2]이 화합물은 헬리오트로핀 꽃의 향기에서 발견된 '체리 파이' 노트의 이름을 따서 헬리오트로핀이라고 명명되었다(화물의 진짜 향기에는 화학물질이 존재하지 않지만).[9]향수는 1880년대 초반에 처음으로 향기를 사용하기 시작했다.[10]바닐라나 아몬드 뉘앙스를 더하는 데 흔히 사용되며 일반적으로 향기의 성격에 발사믹, 파우더리, 플로럴적인 면을 부여한다.[11]
피페로닐 아세테이트(Piperonyl acetate)는 합성 체리 향료다.[12]
참조
- ^ a b c d e Budavari, Susan, ed. (1996), The Merck Index: An Encyclopedia of Chemicals, Drugs, and Biologicals (12th ed.), Merck, ISBN 0911910123
- ^ a b c Karl-Georg Fahlbusch, Franz-Josef Hammerschmidt, Johannes Panten, Wilhelm Pickenhagen, Dietmar Schatkowski, Kurt Bauer, Dorothea Garbe and Horst Surburg "Flavors and Fragrances" in Ullmann's Encyclopedia of Industrial Chemistry, Wiley-VCH, Weinheim, 2003. doi:10.1002/14356007.a11_141
- ^ Fatiadi, Alexander & Schaffer, Robert (1974). "An Improved Procedure for Synthesis of DL-4-Hydroxy-3-methoxymandelic Acid (DL-"Vanillyl"-mandelic Acid, VMA)". Journal of Research of the National Bureau of Standards Section A. 78A (3): 411–412. doi:10.6028/jres.078A.024. PMC 6742820. PMID 32189791.
- ^ Nwaukwa, Stephen; Keehn, Philip (1982). "Oxidative cleavage of α-diols, α-diones, α-hydroxy-ketones and α-hydroxy- and α-keto acids with calcium hypochlorite [Ca(OCl)2]". Tetrahedron Letters. 23 (31): 3135–3138. doi:10.1016/S0040-4039(00)88578-0.
- ^ Bonthrone, W. & Cornforth, J. (1969). "The methylenation of catechols". Journal of the Chemical Society (9): 1202–1204. doi:10.1039/J39690001202.
- ^ Gilla, G.; Anumula, R.R.; Aalla, S.; Vurimidi, H. & Ghanta, M.R. (2013). "Synthesis and characterization of related substances and metabolite of tadalafil, a PDE-5 inhibitor" (PDF). Organic Communications. 6 (1): 12–22.
- ^ Yamada, Shun-Ichi; Fujii, Tozo; Shioiri, Takayuki (1962). "Studies on Optically Active Amino Acids. I. Preparation of 3-(3, 4-Methylenedioxyphenyl)-D-, and -L-alanine". Chemical & Pharmaceutical Bulletin. 10 (8): 680–688. doi:10.1248/cpb.10.680. PMID 14002245.
- ^ Winn, Martin; von Geldern, Thomas W.; Opgenorth, Terry J.; Jae, Hwan-Soo; Tasker, Andrew S.; Boyd, Steven A.; Kester, Jeffrey A.; Mantei, Robert A.; Bal, Radhika; Sorensen, Bryan K.; Wu-Wong, Jinshyun R.; Chiou, William J.; Dixon, Douglas B.; Novosad, Eugene I.; Hernandez, Lisa; Marsh, Kennan C. (1996). "2,4-Diarylpyrrolidine-3-carboxylic AcidsPotent ETASelective Endothelin Receptor Antagonists. 1. Discovery of A-127722". Journal of Medicinal Chemistry. 39 (5): 1039–1048. doi:10.1021/jm9505369. ISSN 0022-2623. PMID 8676339.
- ^ "Essential oils".
- ^ 정치사회 패션의 힘: 베버리 르미어 ISBN 9781409404927
- ^ Heliotropin을 위한 Good Spents Company 데이터베이스 항목
- ^ 페나롤리의 향료 안내 책자.
외부 링크
| 위키소스는 1911년 브리태니커 백과사전 기사 '피페롤론'의 원문을 가지고 있다. |

