수소생산
Hydrogen production수소 가스는 여러 산업적 방법으로 생산됩니다. 2022년 수소 생산량의 1% 미만이 저탄소였습니다.[1] 화석 연료는 예를 들어 천연 가스의 증기 개질에 의해 지배적인 수소 공급원입니다.[2] 수소 생산의 다른 방법으로는 바이오매스 가스화와 메탄 열분해가 있습니다. 메탄 열분해 및 수전해는 재생 에너지를 포함한 모든 전기원을 사용할 수 있습니다. 지하 수소를 추출합니다.[3]
수소는 많은 화학 공정에 필요하기 때문에 수소 생산은 모든 산업 사회에서 핵심적인 역할을 합니다.[4] 2020년 전 세계적으로 약 8,700만 톤의 수소가 하버 공정을 통한 암모니아 생산, 일산화탄소 환원을 통한 메탄올 생산 등 정유 등 다양한 용도로 생산되었습니다[5]. 세계 수소 발전 시장은 2022년 미화 1,550억 달러로 공정하게 평가되었으며, 2023년부터 2030년까지 연평균 9.3%의 복합 성장률을 보일 것으로 예상됩니다.[6]
2022년[update] 기준 전 세계 수소 생산량의 95% 이상이 탄소 저감 없이 화석 가스와 석탄에서 조달됩니다.[7]: 1
수소는 종종 그 기원을 나타내기 위해 다양한 색상으로 언급됩니다(아마도 회색은 "더러운 수소"[8][9][10]를 상징하기 때문일 것입니다).
| 색. | 생산원 | 메모들 | 참고문헌 | |
|---|---|---|---|---|
| 초록의 | 대부분의 정의에서 물의 전기 분해를 통한 재생 가능한 전기입니다. 그린 수소의 정의에는 바이오매스와 같은 다른 저배출원에서 생산된 수소가 포함됩니다. | [12] | ||
| 청록색 | 메탄의 열분해 | 메탄 열분해를 통해서 | [13]: 28 [14]: 2 | |
| 파랑색 | 탄소 포집 및 저장이 가능한 탄화수소 | 필요한 CCS 네트워크 | [13]: 28 | |
| 회색의 | 화석탄화수소, 주로 천연가스의 수증기 개질 | [13]: 28 [15]: 10 [14]: 2 | ||
| 갈색 또는 흑색 | 화석 탄화수소: 갈탄 또는 흑탄 | 석탄 가스화 또는 적합한 원자로에서; 저감이 필요함. | [16]: 91 | |
| 빨강, 분홍, 보라 | 원자력 발전 | 열화학적 물 분할, 물의 전기 분해 또는 천연 가스 개질에 증기 기여를 통해 | [14]: 2 [8] | |
| 노란 색 | 때때로 태양 광전지를 의미하는 것으로 이해됩니다. | 태양광 발전으로 | [10] | |
| 금이나 백이나 | 지각 깊은 곳에서 자연적으로 발생하는 수소 | 채굴에 의해 얻어짐; 또한 백색이라고도 함. | [17] |
개요
분자 수소는 콜라 슈퍼딥 보어홀에서 발견되었습니다. 천연 저수지에 얼마나 많은 분자 수소가 있는지는 불분명하지만, 적어도 한 회사는[18] 수소를 추출하기 위해 우물을 뚫는 것을 전문으로 합니다. 암석권에 있는 대부분의 수소는 물 속의 산소와 결합합니다. 원소 수소를 제조하기 위해서는 화석 연료나 물과 같은 수소 운반체의 소비가 필요합니다. 전자의 운반체는 화석 자원을 소비하고 증기 메탄 개질(SMR) 공정에서는 온실가스 이산화탄소가 발생합니다. 그러나 새로운 메탄 열분해 과정에서는 온실 가스 이산화탄소가 발생하지 않습니다. 이러한 과정은 일반적으로 화석 연료 외에 더 이상의 에너지 투입을 필요로 하지 않습니다.
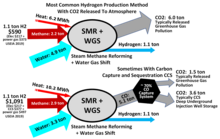
후자의 운반체인 물을 분해하려면 일부 1차 에너지원(화석 연료, 원자력 또는 재생 에너지)에서 발생하는 전기 또는 열 입력이 필요합니다. 풍력, 태양광 등 재생에너지원을 이용하여 물을 전기분해하여 생산하는 수소를 그린수소라 합니다.[19] 온실가스 배출 메탄 열분해 제로로 천연가스에서 유래된 경우를 청록색 수소라고 합니다.[20]
온실가스 배출과 함께 파생된 화석 연료를 일반적으로 그레이 수소라고 합니다. 이산화탄소 배출을 대부분 포착하면 블루수소라고 합니다.[21] 석탄에서 생산되는 수소는 갈색 또는 흑색 수소로 지칭될 수 있습니다.[22]
현재생산방법
스팀 리포밍 – 회색 또는 파란색
수소는 천연가스를 사용하는 수증기 개질(SMR)에서 산업적으로 생산됩니다.[23] 생산된 수소의 에너지 함량은 원래 연료의 에너지 함량의 약 74%입니다.[24] 일부 에너지는 생산 중에 과잉 열로 손실되기 때문입니다. 일반적으로 수증기 개질은 온실가스인 이산화탄소를 배출하며, 회색 수소로 알려져 있습니다. 이산화탄소를 포집하여 저장하면 생성되는 수소를 블루수소라고 합니다.
증기 메탄 개질(SMR)은 천연 가스, 대부분 메탄(CH4) 및 물에서 수소를 생성합니다. 세계 수소의 거의 50%를 공급하는 가장 저렴한 산업용 수소 공급원입니다.[25] 이 프로세스는 니켈 촉매 위에 증기가 있는 상태에서 가스를 700~1,100°C(1,300~2,000°F)로 가열하는 것으로 구성됩니다. 그 결과 발생하는 흡열 반응은 일산화탄소와 분자 수소(H2)를 형성합니다.[26]
수성-가스 전환 반응에서 일산화탄소는 증기와 반응하여 더 많은 양의2 H를 얻습니다. WGSR에는 일반적으로 산화철 또는 기타 산화물 위에 촉매가 필요합니다. 부산물은 CO입니다2.[26] 공급 원료(천연가스, 나프타 등)의 품질에 따라 생산되는 수소 1톤에서도 포집 가능한 온실가스인 CO2 9~12톤이 발생합니다.[27]

이 과정에서 고온 증기(HO2)는 흡열 반응에서 메탄(CH4)과 반응하여 합성가스를 생성합니다.[28]
- CH + HO → CO + 3H
두 번째 단계에서는 약 360°C(680°F)에서 수행되는 저온, 발열, 수성 가스 전환 반응을 통해 추가 수소를 생성합니다.
- CO + HO → CO + H
기본적으로 산소(O) 원자를 추가 물(증기)에서 제거하여 CO를 CO로2 산화시킵니다. 이 산화는 또한 반응을 유지하는 에너지를 제공합니다. 공정을 구동하는 데 필요한 추가 열은 일반적으로 메탄의 일부를 태움으로써 공급됩니다.
물에서
화석 연료를 사용하지 않고 수소를 생산하는 방법은 물을 쪼개거나 물 분자(HO2)를 산소와 수소로 나누는 과정을 포함합니다. 물을 쪼개는 에너지원이 재생 가능하거나 저탄소일 때 생산되는 수소를 그린 수소라고 부르기도 합니다. 변환은 여러 가지 방법으로 수행할 수 있지만 현재 모든 방법이 화석 연료 기반 생산 방법보다 더 비싸다고 간주됩니다.
물의 전기 분해 – 녹색, 분홍색 또는 노란색

수소는 고압 전기 분해, 물의 저압 전기 분해 또는 고온 전기 분해 또는 탄소 보조 전기 분해와 같은 기타 새로운 전기 화학 공정을 통해 제조될 수 있습니다.[29] 그러나 현재 수전해를 위한 최적의 공정은 70-80%[30][31][32]의 유효 전기 효율을 가지므로 1kg의 수소(비에너지 143 MJ/kg 또는 약 40kWh/kg)를 생산하려면 50-55kWh의 전기가 필요합니다.
세계 일부 지역에서는 수소 가스 가압 비용을 제외하고 스팀 메탄 개질이 평균 $1-3/kg 사이입니다. 이로 인해 전기 분해를 통한 수소 생산은 이미 Nel Hydrogen[33] 등에서 설명한 바와 같이 많은 지역에서 경쟁력이 있습니다. 여기에는 전기 분해에 대한 경쟁 우위를 가져올 수 있는 조건을 조사한 IEA의[34] 기사도 포함됩니다.
소량(2019년[35] 2%)은 전기와 물을 이용한 전기 분해로 생산되며, 생산된 수소 1kg당 약 50~55킬로와트시의 전기를 소비합니다.[36]

수전해는 전기를 이용하여 물을 수소와 산소로 나누는 것입니다. 2020년 기준 수소 생산량의 0.1% 미만이 수전해에서 발생합니다.[37] 물의 전기 분해는 70~80% 효율적이며([38][39]변환 손실은 20~30%) 천연 가스의 증기 개질은 70~85%[40]의 열 효율을 갖습니다. 전기 분해의 전기적 효율은 2030년 이전에 82~86%[41]에 이를 것으로 예상되며, 또한 이 분야의 진전이 빠르게 진행됨에 따라 내구성을 유지할 수 있을 것으로 예상됩니다.[42]
수전해는 50~80 °C(120~180 °F)에서 작동할 수 있는 반면, 메탄 수증기 개질에는 700~1,100 °C(1,300~2,000 °F)의 온도가 필요합니다.[43] 두 방법의 차이점은 전기(전기 분해용) 또는 천연 가스(증기 메탄 개질용) 중 하나로 사용되는 주요 에너지입니다. 물을 사용하기 때문에 쉽게 구할 수 있는 자원, 전기 분해 및 유사한 물 분할 방법이 과학계의 관심을 끌었습니다. 수소 생산 비용을 줄이기 위한 목적으로 전기 분해가 가능하도록 재생 가능한 에너지원을 목표로 삼았습니다.[44]
전해셀에는 크게 세 가지 종류가 있는데, 고체산화물 전해셀(SOECs), 고분자 전해질막셀(PEM), 알칼리 전해셀(AECs)이 있습니다.[45] 전통적으로, 알칼리 전해질은 투자 측면에서 더 저렴하지만(일반적으로 니켈 촉매를 사용함), 효율성은 떨어집니다; 반대로, PEM 전해질은 더 비싸지만(일반적으로 값비싼 백금 그룹 금속 촉매를 사용함), 더 효율적이고 더 높은 전류 밀도에서 작동할 수 있습니다. 따라서 수소 생산량이 충분히 많으면 더 저렴해질 수 있습니다.[46]
SOEC는 일반적으로 약 800°C(1,500°F)의 고온에서 작동합니다. 이러한 고온에서는 필요한 에너지의 상당량이 열 에너지(열)로 제공될 수 있으므로 고온 전기 분해라고 합니다. 열 에너지는 폐 산업용 열, 원자력 발전소 또는 농축 태양열 발전소를 포함한 다양한 소스에서 제공될 수 있습니다. 이것은 전기 분해에 필요한 전기 에너지의 양을 줄임으로써 생산되는 수소의 전체 비용을 줄일 수 있는 잠재력을 가지고 있습니다.[47][48][49][50]
PEM 전기 분해 셀은 일반적으로 100°C(212°F) 이하에서 작동합니다.[47] 이 전지들은 비교적 간단하다는 장점이 있으며, 매우 다양한 전압 입력을 수용하도록 설계될 수 있어 태양광 태양 전지판과 같은 재생 가능한 에너지원과 함께 사용하기에 이상적입니다.[51] AEC는 고농도의 전해질(KOH 또는 탄산칼륨) 및 고온(보통 200°C(392°F)에서 최적으로 작동합니다.
산업생산 및 효율성
현대 수소 발전기의 효율은 표준2 온도와 H의 압력을 가정하여 수소의 표준 부피당 소비되는 에너지(MJ/m3)로 측정됩니다. 발전기가 사용하는 에너지가 적을수록 효율이 높아집니다. 100% 효율이 높은 전해조는 킬로그램당 39.4 킬로와트시(142 MJ/kg),[52] 리터당 12,749 줄(12.75 MJ/m3)의 수소를 소비합니다. 실제 전기 분해는 일반적으로 회전하는 전기 분해기를 사용하는데, 원심력은 물에서 기포를 분리하는 데 도움이 됩니다.[53] 15bar 압력의 이러한 전해기는 수소 자동차에 사용하기 위해 수소를 압축하는 경우 킬로그램당 50킬로와트시(180 MJ/kg)를 소비하고 추가로 15킬로와트시(54 MJ)를 소비할 수 있습니다.[54]
기존의 알칼리 수전해는 약 70%[55]의 효율을 가지고 있지만 최대 82%의 효율을 가진 고급 알칼리 수전해기를 사용할 수 있습니다.[56] 더 높은 열 값의 사용을 고려할 때(열을 통한 비효율성은 촉매에 필요한 증기를 생성하기 위해 시스템으로 다시 전환될 수 있기 때문에) PEM 전기 분해의 평균 작업 효율은 약 80%, 즉 82%에 달합니다.[57]
PEM 효율은 2030년 이전에 약 86%[58]로 증가할 것으로 예상됩니다. PEM 전해질의 이론적 효율은 최대 94%[59]로 예측됩니다.

2020년 현재 전기 분해에 의한 수소 비용은 약 $3-8/kg입니다.[60] 수소의 산업적 생산과 70-82의 유효 전기 효율을 갖는 물 전기 분해(PEM 또는 알칼리 전기 분해)를 위한 현재의 최상의 공정을 사용하는 것을 고려할 때,[61][62][63] 1kg의 수소(비에너지 143 MJ/kg 또는 약 40kWh/kg)를 생산하려면 50~55kWh의 전력이 필요합니다. 2015년 에너지부 수소 생산 목표에 명시된 0.06달러/kWh의 전기 비용으로,[64] 수소 비용은 3달러/kg입니다.
2020년 미국 DOE의 수소 목표 가격은 2.30달러/kg으로, 최근 많은 지역에서 풍력 및 태양광에 대한 PPA 입찰을 고려할 때 0.037달러/kWh의 전기료가 필요합니다.[65] IRENA의 보고서입니다.ORG는 kg당 약 53~70 kWh를 소비하는 오늘날의 산업용 수소 생산에 대한 광범위한 사실 보고서로 약 45 kWh/kg H까지
2 내려갈 수 있습니다.[66] 전기 분해에 의한 수소에 필요한 열역학적 에너지는 33 kWh/kg으로 탄소 포집을 통한 수증기 개질보다 높고 메탄 열분해보다 높습니다. 스팀 메탄 개질(SMR)에서 나오는 수소에 비해 전기 분해의 장점 중 하나는 현장에서 수소를 생산할 수 있다는 것이며, 이는 트럭이나 파이프라인을 통한 비용이 많이 드는 배송 과정을 피할 수 있다는 것을 의미합니다.
화학적으로 보조된 전기 분해
전기 분해 셀의 온도 상승을 통해 전기 분해에 필요한 전압을 감소시킬 뿐만 아니라, 반응기의 산소 측에 연료(탄소/석탄,[67] 메탄올,[68][69] 에탄올,[70] 포름산,[71] 글리세롤 [71]등)를 도입하여 전기 화학적으로 전해조에서 생성된 산소를 소비할 수 있습니다. 이를 통해 필요한 전기 에너지를 줄이고 남은 에너지를 사용하여 수소 비용을 40~60% 미만으로 줄일 수 있습니다.[72]
CAWE(Carbon/Hydrocarbon Assisted Water Electrolysis)는 낮은 순위 및 높은 황탄, 바이오매스, 알코올 및 메탄(Natural Gas)과 같은 다양한 탄소 공급원에서 화학 에너지를 사용하는 덜 에너지 집약적이고 깨끗한 방법을 제공할 수 있으며, 여기서 생성된 순수한 CO2는 분리할 필요 없이 쉽게 격리될 수 있습니다.[73][74]
바이오매스에서 나오는 수소 – 녹색
바이오매스는 가스화에 의해 합성가스로 변환되고 합성가스는 물-가스 이동 반응(WGSR)[75]에 의해 수소로 변환됩니다.
다른 화학 공정의 부산물인 수소
전기 분해에 의한 염소와 가성소다의 산업적 생산은 부산물로 상당한 양의 수소를 발생시킵니다. 앤트워프 항구에는 1MW 규모의 실증 연료 전지 발전소가 이러한 부산물로 구동됩니다. 이 장치는 2011년 말부터 운영되고 있습니다.[76] 초과 수소는 종종 수소 핀치 분석으로 관리됩니다.
철강 생산에서 코크스 오븐에서 발생하는 가스는 부피 기준으로 수소가 60%인 합성가스와 유사합니다.[77] 코크스 오븐 가스에서 수소를 경제적으로 추출할 수 있습니다.[78]
기타 화석연료 사용방법
부분산화
천연 가스와 더 무거운 탄화수소로부터 수소를 생산하는 것은 부분 산화에 의해 달성됩니다. 연료-공기 또는 연료-산소 혼합물이 부분적으로 연소되어 수소와 일산화탄소가 풍부한 합성가스가 생성됩니다. 그런 다음 물-가스 전환 반응을 통해 일산화탄소(및 물)로부터 더 많은 수소와 이산화탄소를 얻습니다.[26] 이산화탄소는 수소 대 일산화탄소 비율을 낮추기 위해 공동 공급될 수 있습니다.
부분 산화 반응은 아화학량론적 연료-공기 혼합물 또는 연료-산소가 개질기 또는 부분 산화 반응기에서 부분적으로 연소될 때 발생합니다. TPOX(thermal partial oxidation)와 CPOX(catalytic partial oxidation)를 구분합니다. 화학 반응은 일반적인 형태를 취합니다.
- 2 CnHm + nO2 → 2n CO + mH2
각각 조성 CH1224 및 CH를2412 가정하여 오일과 석탄을 가열하기 위한 이상적인 예는 다음과 같습니다.
- CH + 6 O → 12 CO + 12 H
- CH + 12 O → 24 CO + 6 H
플라즈마 열분해
Kv æ rner 공정 또는 Kvaerner 카본 블랙 및 수소 공정(CB&H)은 1980년대 노르웨이의 같은 회사가 액체 탄화수소(CH)로부터 수소와 카본 블랙을 생산하기 위해 개발한 플라즈마 열분해 방법입니다. 사료의 가용 에너지 중 약 48%는 수소에 포함되어 있고, 40%는 활성탄에 포함되어 있으며, 10%는 과열 증기에 포함되어 있습니다.[80] 그 과정에서 CO가2 발생하지 않습니다.
이 공정의 변형은 플라즈마 변환기에서 메탄과 천연 가스로부터 수소, 열 및 탄소를 생산하기 위해 플라즈마 아크 폐기물 처리 기술을 사용하여 2009년에 제시되었습니다.[81]
석탄
석탄에서 수소를 생산하기 위해 석탄 가스화를 사용합니다. 석탄 가스화 과정은 증기와 산소를 이용하여 석탄의 분자 결합을 끊고 수소와 일산화탄소의 기체 혼합물을 형성합니다.[44] 석탄 가스화 대 석탄 연소에서 얻은 가스에서 이산화탄소와 오염물질을 더 쉽게 제거할 수 있습니다.[82][83] 전환을 위한 또 다른 방법은 저온 및 고온 석탄 탄화입니다.[84]
석탄의 열분해(산소 없는 가열)로 만들어진 코크스 오븐 가스는 60% 정도의 수소를 가지고 있으며, 나머지는 메탄, 일산화탄소, 이산화탄소, 암모니아, 분자 질소, 황화수소(HS2) 등입니다. 압력 스윙 흡착 공정으로 수소를 다른 불순물과 분리할 수 있습니다. 일본 철강사들은 이 방법으로 수소 생산을 진행했습니다.
석유 코크스
석유 코크스는 석탄 가스화를 통해 수소가 풍부한 합성가스로 전환될 수도 있습니다. 생산된 합성가스는 주로 코크스 공급의 황에서 나오는 수소, 일산화탄소 및 HS로2 구성됩니다. 가스화는 거의 모든 탄소원에서 수소를 생산하기 위한 옵션입니다.[85]
고갈된 유정
고갈된 유정에 적절한 미생물을 주입하면 남은 회수 불가능한 오일에서 수소를 추출할 수 있습니다. 투입물은 미생물뿐이기 때문에 생산 비용이 저렴합니다. 이 방법은 또한 원칙적으로 포획될 수 있는 농축 CO를
2 생성합니다.[86]
방사분해
핵 방사선은 방사성 분해를 통해 물 결합을 깨뜨릴 수 있습니다.[87][88] 남아프리카 공화국의 음포넹 금광에서 연구원들은 자연적으로 발생하는 고방사능 지역에서 박테리아를 발견했습니다. 데술포토마쿨룸의 새로운 계통형이 지배적이었던 박테리아 군집은 주로 방사성을 띠는 수소를 먹고 있었습니다.[89]
열분해
물은 약 2500°C에서 자발적으로 해리되지만, 이러한 열분해는 일반적인 공정 배관 및 장비에 비해 너무 높은 온도에서 발생하여 상용화 가능성이 다소 낮습니다.[90]
바이오매스의 열분해
열분해는 열분해 온도에 따라 저온 완속 열분해, 중온 급속 열분해, 고온 플래시 열분해 등 다양한 유형으로 나눌 수 있습니다.[91] 원천 에너지는 주로 태양 에너지이며 광합성 미생물의 도움으로 물이나 바이오매스를 분해하여 수소를 생산합니다. 하지만 이 공정은 상대적으로 수소 수율이 낮고 운영 비용이 높습니다. 그것은 산업에 실현 가능한 방법이 아닙니다.
핵보조열분해
고온 가스 냉각 원자로(HTGR)는 물을 대규모로 쪼개 수소를 생산하는 가장 유망한 CO-free2 원자력 기술 중 하나입니다. 이 방법에서는 물을 쪼개기 위한 요오드-황(IS) 열화학 사이클과 고온증기전기분해(HTSE)를 핵수소 생산의 주요 공정으로 선정했습니다. S-I 사이클은 세 가지 화학 반응을 따릅니다.[92]
분젠 반응: I2+SO2+2HO=HSO+2HI
HI 분해 : 2HI=H+I
IS 사이클을 적용한 HTGR의 수소 생산율은 약 0.68kg/s이며, 발전소 1기 건설에 소요되는 자본 비용은 1억 달러입니다.
열화학주기
열화학적 순환은 열원(열원)만을 화학 반응과 결합하여 물을 수소 및 산소 성분으로 나눕니다.[93] 사이클이라는 용어는 물, 수소 및 산소 외에도 이러한 공정에 사용되는 화학 화합물이 지속적으로 재활용되기 때문에 사용됩니다. 전기가 부분적으로 입력으로 사용되는 경우 결과적인 열화학적 순환은 하이브리드 순환으로 정의됩니다.
황-요오드 사이클(S-I 사이클)은 물로부터 약 50%의 효율로 수소를 생성하는 열화학적 사이클 과정입니다. 공정에 사용된 황과 요오드는 회수되어 재사용되며, 공정에 의해 소비되지 않습니다. 사이클은 CSP(Concentrated Solar Power Systems)와 같이 약 950°C의 매우 높은 온도의 모든 소스에서 수행할 수 있으며 고온 원자로의 수소 생산에 매우 적합한 것으로 간주되어 [94]일본의 고온 공학 시험로에서 연구되고 있습니다.[95][96][97][98] 고온과 일부 전기를 모두 사용하는 하이브리드 사이클이 있는데, 구리-염소 사이클과 같이 반응 단계 중 하나에서 전기화학 반응을 사용하기 때문에 하이브리드 열화학 사이클로 분류되며, 530℃에서 작동하고 43%의 효율을 갖습니다.[99]
페로실리콘법
페로실리콘은 군에서 풍선용 수소를 신속하게 생산하는 데 사용됩니다. 화학 반응은 수산화나트륨, 페로실리콘, 물을 사용합니다. 발전기는 트럭에 들어갈 정도로 작고 소량의 전력만 필요하며 재료는 안정적이고 연소가 불가능하며 혼합될 때까지 수소를 생성하지 않습니다.[100] 이 방법은 제1차 세계대전 때부터 사용되어 왔습니다. 중강 압력 용기에 수산화나트륨과 페로실리콘을 채우고 닫아서 조절된 양의 물을 첨가하고, 수산화물이 용해되면 혼합물을 약 93 ℃로 가열하여 반응을 시작하고, 규산나트륨, 수소 및 증기가 생성됩니다.[101]
광생물학적 물 쪼개기

생물학적 수소는 조류 생물반응기에서 생산될 수 있습니다.[102] 1990년대 후반에 조류가 황을 빼앗기면 산소, 즉 정상적인 광합성에서 수소 생산으로 전환된다는 것이 발견되었습니다. 7~10%의 에너지 효율(태양광을 수소로 바꾸는 것) 장벽을 뛰어넘어 경제적으로 생산이 가능해진 것으로 보입니다.[103] 시간당 L당 10-12ml의 수소 생산 속도로.[104]
광촉매 물 쪼개기
태양 에너지를 물 분할 과정을 통해 수소로 전환하는 것은 깨끗하고 재생 가능한 에너지 시스템을 달성하는 가장 흥미로운 방법 중 하나입니다. 그러나 이 과정을 광전지와 전해 시스템을 사용하는 대신 물에 직접 매달아 반응하는 광촉매의 도움을 받으면 한 단계로 더 효율적으로 만들 수 있습니다.[105][106][107] 그러나 현재 시스템은 상업적 구현을 위한 성능이 낮습니다.[108][109]
바이오수소 경로
바이오매스와 폐기물 스트림은 원칙적으로 바이오매스 가스화, 수증기 개질 또는 바이오 촉매 전기[72] 분해 또는 발효 수소 생산과 같은 생물학적 전환을 통해 바이오 수소로 전환될 수 있습니다.[2]
수소 생산 방법 중 생물학적 경로는 잠재적으로 에너지 집약적이지 않습니다. 또한 재생 가능한 자원으로서 농업용 바이오매스와 같은 다양한 폐기물 및 저부가가치 물질은 생화학적 또는 열화학적 경로를 통해 수소를 생산하는 데 사용될 수 있습니다.[110] 그럼에도 불구하고 현재 수소는 주로 화석 연료, 특히 재생 불가능한 천연 가스에서 생산됩니다. 수소는 가장 깨끗한 연료일 뿐만 아니라 여러 산업, 특히 비료, 석유 화학 및 식품 산업에서 널리 사용됩니다.[111]
수소로 가는 생화학적 경로는 암발효 과정과 광발효 과정으로 분류됩니다. 암흑 발효에서는 엄격한 혐기성 및 통성 혐기성 박테리아를 포함한 발효 미생물에 의해 탄수화물이 수소로 전환됩니다. 이론적으로 최대 4 mol H2/mol 포도당을 생성할 수 있습니다.[citation needed] 당은 이 과정에서 부산물로 휘발성 지방산(VFA)과 알코올로 전환됩니다. 광발효 박테리아는 VFA로부터 수소를 생성할 수 있습니다. 따라서 암발효에서 형성된 대사산물을 광발효의 공급원료로 사용하여 수소의 전체 수율을 향상시킬 수 있습니다.[111]
발효수소 생산
발효 수소 생산은 유기 기질을 수소로 전환합니다. 다양한 박테리아 그룹이 이 변형을 촉진합니다. 광발효는 빛이 있는 곳에서만 진행되기 때문에 암발효와 다릅니다. 예를 들어, Rhodobacter sphaeroides SH2C를 사용한 광발효는 일부 지방산을 수소로 전환시키는 데 사용될 수 있습니다.[112]
발효 수소 생산은 녹조에 의한 직접적인 생물광합성, 남조류에 의한 간접적인 생물광합성, 혐기성 광합성균에 의한 광발효, 혐기성 발효균에 의한 암발효를 이용하여 수행할 수 있습니다. 예를 들어, E. coli와 같은 hydrogenase 공여체와 결합된 혐기성 광합성 세균인 H. salinarium을 이용한 수소 생산에 대한 연구가 문헌에 보고되어 있습니다.[113] 엔테로박터 에어로제네스는 또 다른 수소 생산업체입니다.[114]
효소적 수소 발생
당으로부터 수소를 생성하기 위해 다양한 효소 경로가 설계되었습니다.[115]
생체촉매 전기분해

암발효 외에 전기 수소화(미생물을 이용한 전기 분해)도 가능합니다. 미생물 연료 전지를 사용하여 폐수 또는 식물을 사용하여 전력을 생산할 수 있습니다. 생물 촉매 전기 분해는 생물학적 수소 생산과 혼동되어서는 안 됩니다. 후자는 조류만 사용하고 후자는 조류 자체가 즉시 수소를 생성하기 때문에 생물 촉매 전기 분해의 경우 미생물 연료 전지를 통과한 후에 발생하며 다양한 수생 식물을[116] 사용할 수 있습니다. 여기에는 갈대 스위트그래스, 코드그래스, 쌀, 토마토, 루핀 및 조류가 포함됩니다.[117]

나노갈바닉알루미늄합금분말
알루미늄 합금 분말은 물과 반응하여 물과 접촉하면 수소 가스를 생성합니다. 이론 수율의 100%로 수소를 생산한다고 합니다.[118][119] 알루미늄 합금을 생산하기 위한 비용 효율적인 경로는 여전히 파악하기 어렵습니다.
CC-HOD
CC-HOD(Catalytic Carbon – Hydrogen On Demand)는 탄소와 알루미늄이 약 80°C(176°F)까지 잠기고 가열되어 화학 반응을 일으켜 수소를 생성하는 저온 공정입니다.
천연수소

수소도 지하에 자연적으로 존재합니다. 백색 수소 또는 금 수소라고도 불리는 이 천연 수소는 석유, 천연 가스와 같은 화석 연료와 유사한 방식으로 우물에서 추출할 수 있습니다.[120][121]
재생 가능한 수소 경제를 위해 중대륙 균열 시스템에서 백색 수소를 발견하거나 생산할 수 있습니다. 물을 뜨거운 철이 풍부한 암석으로 퍼내 수소를 생산하고 수소를 추출할 수 있습니다.[122]
실험생산방법
메탄 열분해 – 청록색

용융금속 촉매를 통해 메탄을 버블링하는 1단계 공정으로[123] 메탄(천연가스)을 열분해하는 것은 2017년 실험실 조건에서 입증된 수소를 생산하기 위한 "온실가스 금지" 접근법입니다.[124][125] 이 공정은 고온(1065°C)에서 수행됩니다.[126][127][128][129] 수소 1kg을 생산하기 위해서는 공정열을 위해 약 18kWh의 전기가 필요합니다.[130] 메탄의 열분해는 다음과 같은 반응식으로 나타낼 수 있습니다.[131]
- CH
4(g) → C(s) + 2 H
2(g) ΔH° = 74.8 kJ/mol
산업용 품질의 고체 탄소는 제조 공급 원료로 판매되거나 매립(무공해)될 수 있습니다.
생물학적 생산
발효 수소 생산은 혐기성 전환과 유사한 3단계를 포함하는 다중 효소 시스템을 사용하여 다양한 박테리아 그룹에 의해 발현되는 유기 기질을 바이오 수소로 발효 전환하는 것입니다. 암발효반응은 빛에너지가 필요하지 않아 밤낮으로 유기화합물로부터 끊임없이 수소를 생산할 수 있습니다. 광발효는 빛이 있는 곳에서만 진행되기 때문에 암발효와 다릅니다. 예를 들어, Rhodobacter sphaeroides SH2C를 사용한 광발효는 소분자 지방산을 수소로 전환시키는 데 사용될 수 있습니다.[132] 전기 수소화는 0.2~0.8V가 적용되는 동안 유기물(예: 하수 또는 고체 물질[133])에서 수소가 생성되는 미생물 연료 전지에 사용됩니다.
생물학적 수소는 조류 생물반응기에서 생산될 수 있습니다. 1990년대 후반에 조류가 황을 빼앗기면 산소, 즉 정상적인 광합성에서 수소 생산으로 전환된다는 사실이 발견되었습니다.[134]
생물학적 수소는 조류 이외의 공급 원료를 사용하는 생물반응기에서 생산될 수 있으며, 가장 일반적인 공급 원료는 폐기물 흐름입니다. 이 과정에는 박테리아가 탄화수소를 먹고 수소와 CO를2 배출하는 것이 포함됩니다. CO는2 여러 가지 방법으로 성공적으로 격리되어 수소 가스를 남길 수 있습니다. NanoLogix는 2006-2007년 미국 펜실베니아주 노스이스트에 위치한 Welch의 포도 주스 공장에서 폐기물을 공급 원료로 사용하는 수소 생물반응기 시제품을 처음으로 시연했습니다.[135]
생체촉매 전기분해
일반적인 전기 분해 외에도 미생물을 이용한 전기 분해도 가능합니다. 생체 촉매 전기 분해를 통해 미생물 연료 전지를 구동한 후 수소가 발생하고 다양한 수생 식물을 사용할 수 있습니다. 여기에는 갈대 스위트그래스, 코드그래스, 쌀, 토마토, 루핀 및 조류가[136] 포함됩니다.
고압전기분해
고압전기분해는 물을 통해 흐르는 전류에 의해 물(HO2)이 산소(O2)와 수소가스(H2)로 분해되어 물을 전기분해하는 것입니다. 표준 전해조와의 차이점은 약 120~200bar(1740~2900psi, 12~20MPa)의 압축 수소 출력입니다.[137] 전해조에서 수소를 가압함으로써 화학적 압축으로 알려진 프로세스를 통해 외부 수소 압축기의 필요성을 제거함으로써 내부 압축에 대한 평균 에너지 소비는 약 3%[139]입니다.[138] 핀란드 Kokkola에서 유럽 최대 규모(140,000 kg/a, 물의 고압 전기 분해, 알칼리 기술) 수소 생산 공장이 가동되고 있습니다.[140]
고온 전기분해
이 섹션을 업데이트해야 합니다.이할 수 바랍니다. (2019년 2월) |
고온 전기분해(HTE)를 통해 열과 전기의 형태로 공급되는 에너지로 수소를 생산할 수 있습니다. HTE의 에너지 중 일부는 열의 형태로 공급되기 때문에 두 번(열에서 전기로, 그리고 나서 화학적 형태로) 더 적은 에너지가 변환되어야 하므로 생산된 수소 1kg당 잠재적으로 훨씬 더 적은 에너지가 필요합니다.
핵에서 생산된 전기는 전기 분해에 사용될 수 있지만 핵열은 물에서 수소를 분리하기 위해 직접 적용될 수 있습니다. 고온(950~1000 °C) 가스로 냉각된 원자로는 핵열을 이용한 열화학적 방법으로 물에서 수소를 분리할 수 있는 가능성이 있습니다. 고온 원자로에 대한 연구는 결국 천연가스 증기 개질과 비용 경쟁력이 있는 수소 공급으로 이어질 수 있습니다. General Atomics는 고온 가스 냉각 반응기(HTGR)에서 생산되는 수소의 가격이 1.53달러/kg이 될 것이라고 예측합니다. 2003년 천연가스의 수증기 개질을 통해 1.40달러/kg의 수소가 생산되었습니다. 2005년 천연가스 가격에서 수소는 kg당 2.70달러입니다.
고온 전기 분해는 실험실에서 생산된 수소 kg당 108 MJ(열량)[141]로 입증되었지만 상업적 규모에서는 입증되지 않았습니다. 또한, 이 제품은 저품질의 "상업용" 등급 수소로 연료 전지에 사용하기에 부적합합니다.[142]
광전기화학적 물분할
태양광 시스템에서 생산된 전기를 사용하면 가장 깨끗한 수소 생산 방법을 제공합니다. 물은 전기 분해에 의해 수소와 산소로 분해됩니다 – 광전기화학 전지 (PEC) 과정은 인공 광합성이라고도 불립니다.[143] William Ayers at Energy Conversion Devices는 1983년 물의 직접 분할을 위한 최초의 다중 접합 고효율 광전기화학 시스템을 시연하고 특허를 받았습니다.[144] 이 그룹은 저가 박막 비정질 실리콘 다중 접합 시트를 물에 직접 담근 상태에서 현재 "인공 잎" 또는 "무선 태양열 물 분할"로 불리는 직접 물 분할을 시연했습니다.[145][146]
수소는 다양한 촉매로 장식된 전면 비정질 실리콘 표면에서 진화했고 산소는 후면 금속 기판에서 진화했습니다. 다중 접합 셀 위의 나피온 막은 이온 수송을 위한 경로를 제공했습니다. 그들의 특허에는 비정질 실리콘 및 실리콘 게르마늄 합금 외에도 직접 물 분할을 위한 다양한 반도체 다중 접합 물질이 나열되어 있습니다. 대학과 태양광 산업에서 고효율 다중접합 셀 기술을 개발하기 위한 연구가 계속되고 있습니다. 이 과정을 태양광과 전해 시스템을 사용하는 대신 물에 직접 매달린 광촉매의 도움을 받으면 반응이 단 한 단계로 진행돼 효율을 높일 수 있습니다.[145][146]
광전기촉매 생산
동 앵글리아 대학의 토마스 난과 그의 팀이 연구한 방법은 인화인듐(InP) 나노입자 층으로 덮인 금 전극으로 구성되어 있습니다. 그들은 철-황 복합체를 층층이 쌓인 배열에 도입했는데, 이 복합체를 물에 담가 작은 전류로 빛을 조사하면 60%[147]의 효율을 가진 수소를 생산했습니다.
2015년에 파나소닉이 보도되었습니다. 니오븀 질화물 기반의 광촉매를 개발하여 햇빛의 57%를 흡수하여 물의 분해를 지원하여 수소 가스를 생산할 수 있습니다.[148] 당사는 2020년 이전이 아닌 "가능한 한 빨리" 상업적 적용을 달성할 계획입니다.
집광 태양열
물을 수소와 산소로 분리하기 위해서는 매우 높은 온도가 필요합니다. 공정을 실현 가능한 온도에서 작동시키기 위해서는 촉매가 필요합니다. 물을 가열하는 것은 태양열을 집중시키는 물을 사용하여 달성할 수 있습니다. 하이드로솔-2는 스페인 플라타포마 솔라 데 알메리아에 있는 100 킬로와트의 파일럿 플랜트로, 햇빛을 이용하여 물을 가열하는 데 필요한 800~1,200 °C를 얻습니다. 하이드로솔 II는 2008년부터 운영되고 있습니다. 이 100킬로와트 파일럿 플랜트의 설계는 모듈식 컨셉을 기반으로 합니다. 결과적으로, 이 기술은 사용 가능한 원자로 단위를 곱하고 식물을 적절한 크기의 헬리오스타트 들판(태양 추적 거울의 들판)에 연결함으로써 메가와트 범위까지 쉽게 확장될 수 있을 것입니다.[149]
열화학적 생산
물을 쪼개는 데 사용할 수 있는 352개[150] 이상의 열화학적 사이클이 있는데,[151] 산화철 사이클, 세륨(cerium)과 같은 사이클은 약 12개 정도입니다.IV) 산화물-세륨(III) 산화물 사이클, 아연-산화물 사이클, 황-요오드 사이클, 구리-염소 사이클 및 하이브리드 황 사이클, 알루미늄-산화물 사이클은 전기를 사용하지 않고 물과 열로부터 수소와 산소를 생산하기 위해 연구 및 시험 단계에 있습니다.[152] 이러한 프로세스는 고온 전기 분해보다 더 효율적일 수 있으며, 일반적으로 LHV 효율이 35% ~ 49%입니다. 석탄이나 천연가스의 화학에너지를 이용한 수소의 열화학적 생산은 직접적인 화학적 경로가 더 효율적이기 때문에 일반적으로 고려되지 않습니다.
열화학적 수소 생산 과정 중 어느 것도 생산 수준에서 입증되지 않았지만, 몇몇은 실험실에서 입증되었습니다.
전자레인지용 플라스틱
갈아서 산화철 및 산화알루미늄과 혼합한 플라스틱을 몇 초 동안 전자레인지에 돌리면 97%의 수소 회수가 달성됩니다.[153]
Kv æ너 과정
Kv æ rner 공정 또는 Kvaerner 카본 블랙 앤 수소 공정(CB&H)은 1980년대에 같은 이름의 노르웨이 회사가 메탄, 천연 가스 및 바이오 가스와 같은 탄화수소(CH)로부터 수소를 생산하기 위해 개발한 방법입니다. 사료의 가용 에너지 중 약 48%는 수소에 포함되어 있고, 40%는 활성탄에 포함되어 있으며, 10%는 과열 증기에 포함되어 있습니다.[155]
자연 발생 수소 추출 – 백색 수소
2019년[update] 현재 수소는 주로 산업용 공급 원료로 사용되며, 주로 암모니아 및 메탄올 생산 및 석유 정제에 사용됩니다. 처음에는 편리한 저수지에서 수소 가스가 자연적으로 발생하지 않는 것으로 여겨졌지만, 지금은 그렇지 않다는 것이 입증되었습니다. 현재 말리의 쿨리코로 지역 부라케부구 근처에서 수소 시스템이 개발되어 주변 마을에 전기를 공급하고 있습니다.[156] 최근 몇[157] 년 동안 대륙의 육상 지질 환경에서 자연적으로 발생하는 수소에 대한 더 많은 발견이 이루어졌고, 에너지 전환 노력을 뒷받침하는 새로운 천연 또는 천연 수소 분야로 가는 길을 열었습니다.[158][159]

재생 가능한 수소 경제를 위해 중대륙 균열 시스템에서 백색 수소를 발견하거나 생산할 수 있습니다. 물을 뜨거운 철이 풍부한 암석으로 퍼내 수소를 생산하고 수소를 추출할 수 있습니다.[160]
환경영향
2020년 현재 대부분의 수소는 화석 연료에서 생산되어 이산화탄소 배출이 발생합니다.[161] 이 기술에 의해 생산되는 수소는 배출물이 대기로 방출될 때는 회색 수소, 배출물이 탄소 포집 및 저장(CCS)을 통해 포집될 때는 청색 수소로 설명되어 왔습니다.[162][163] 미국의 상류 및 중류 메탄 누출 속도와 이산화탄소 포집 기능을 갖춘 스팀 메탄 개질기(SMR)를 통한 생산을 가정할 때 블루수소의 탄소 발자국은 난방을 위해 가스나 석탄을 태우는 것보다 20%, 난방을 위해 디젤을 태우는 것보다 60% 더 큰 것으로 추정되었습니다.[164]
이산화탄소를 통합 포집하는 자동 열 개질기(ATR)를 사용하면 만족스러운 에너지 효율로 더 높은 포집률을 얻을 수 있으며, 수명 주기 평가 결과 이산화탄소 포집이 있는 SMR에 비해 이러한 플랜트의 온실 가스 배출량이 더 낮은 것으로 나타났습니다.[165] 유럽에서 통합적으로 이산화탄소를 포집하는 ATR 기술을 적용하는 것은 예를 들어, 연소하는 천연 가스보다 온실 가스 발자국이 더 낮은 것으로 평가되었습니다. 천연가스의 이산화탄소 강도 감소와 이산화탄소 포집에 더 적합한 원자로 유형이 결합되어 68%의 감소가 보고된 H21 프로젝트의 경우.[166]
재생 가능한 에너지원에서 생산되는 수소를 흔히 그린 수소라고 합니다. 재생 가능한 에너지원으로 수소를 생산하는 두 가지 방법이 실용적이라고 주장됩니다. 하나는 전력을 가스에 사용하는 것으로 물의 전기 분해를 통해 수소를 생산하는 것이고, 다른 하나는 매립 가스를 사용하여 수증기 개질기에서 수소를 생산하는 것입니다. 수소 연료는 풍력 또는 태양광과 같은 재생 가능한 에너지원으로 생산될 때 재생 가능한 연료입니다.[167][168] 전기 분해를 통해 핵 에너지에서 생성된 수소를 녹색 수소의 하위 집합으로 간주하기도 하지만 분홍색 수소라고도 할 수 있습니다. 오스카샴 원전은 2022년 1월 상업용 핑크수소를 하루 킬로그램 단위로 공급하기로 협약을 맺었습니다.[169]
2020년[update] 기준 예상 생산 비용은 그레이 수소와 블루 수소의 경우 kg당 1~1.80달러,[170] 그린 수소의 경우 2.50~6.80달러입니다.[170]
2022년 현재 전 세계적으로 9400만 톤의 그레이 수소가 화석 연료, 주로 천연 가스를 사용하여 생산되고 있으며, 따라서 온실 가스 배출의 중요한 원천입니다.[171][172][173][174]
수소 사용법
수소는 수소 크래킹을 통해 중유 분획을 더 가벼운 분획으로 전환하는 데 사용됩니다. 또한 전 세계 식품의 47%를 재배하기 위한 합성 질소 비료 생산을 위한 주요 산업 방법인 Haber 공정을 통한 방향족화 공정, 탈황 및 암모니아 생산을 포함한 다른 공정에도 사용됩니다.[175]
수소는 지역 전기 발전을 위해 연료 전지에 사용되거나 잠재적으로 운송 연료로 사용될 수 있습니다.
수소는 전기 분해에 의한 산업용 염소 생산의 부산물로 생산됩니다. 고가의 기술이 필요하지만 현장의 다른 공정에서 사용하기 위해 수소를 냉각, 압축 및 정제하거나 파이프라인, 실린더 또는 트럭을 통해 고객에게 판매할 수 있습니다. 보다 저렴한 대량 수소 생산 방법의 발견과 개발은 수소 경제의 확립과 관련이 있습니다.[2]
참고 항목
참고문헌
- ^ "Hydrogen". IEA. Retrieved 2024-03-23.
- ^ a b c Häussinger, Peter; Lohmüller, Reiner; Watson, Allan M. (2011). "Hydrogen, 1. Properties and Occurrence". Ullmann's Encyclopedia of Industrial Chemistry. doi:10.1002/14356007.a13_297.pub2. ISBN 978-3-527-30673-2.
- ^ "Natural Hydrogen: A Potential Clean Energy Source Beneath Our Feet". Yale E360. Retrieved 2024-03-23.
- ^ 에너지, U.S.D.O. 수소사용 증가가 석유소비 및 이산화탄소 배출에 미치는 영향 84 (Washington DC, 2008)
- ^ Collins, Leigh (2021-05-18). "A net-zero world 'would require 306 million tonnes of green hydrogen per year by 2050': IEA Recharge". Recharge Latest renewable energy news. Archived from the original on 2021-05-21.
- ^ "Global Hydrogen Generation Market Size Report, 2030".
- ^ Rosenow, Jan (27 September 2022). "Is heating homes with hydrogen all but a pipe dream? An evidence review". Joule. 6 (10): 2225–2228. doi:10.1016/j.joule.2022.08.015. ISSN 2542-4785. S2CID 252584593. 신문 기사입니다.
- ^ a b 오류 인용: 명명된 참조
:1호출되었지만 정의되지 않았습니다(도움말 페이지 참조). - ^ "Hydrogen Color Explained". Sensonic. Retrieved 2023-11-22.
- ^ a b national grid. "The hydrogen colour spectrum". National Grid Group. London, United Kingdom. Retrieved 2022-09-29.
- ^ "What potential for natural hydrogen?". Energy Observer. Retrieved 2023-07-03.
- ^ Deign, Jason (2020-06-29). "So, What Exactly Is Green Hydrogen?". Greentechmedia. Archived from the original on 2022-03-23. Retrieved 2022-02-11.
- ^ a b c 오류 인용: 명명된 참조
bmwi-2020호출되었지만 정의되지 않았습니다(도움말 페이지 참조). - ^ a b c 오류 인용: 명명된 참조
van-de-graaf-etal-2020호출되었지만 정의되지 않았습니다(도움말 페이지 참조). - ^ 오류 인용: 명명된 참조
sansom-etal-2020호출되었지만 정의되지 않았습니다(도움말 페이지 참조). - ^ 오류 인용: 명명된 참조
bruce-etal-2018호출되었지만 정의되지 않았습니다(도움말 페이지 참조). - ^ Department of Earth Sciences (12 September 2022). "Gold hydrogen". Department of Earth Sciences, Oxford University. Oxford, United Kingdom. Retrieved 2022-09-29.
- ^ "Natural Hydrogen Energy LLC". Archived from the original on 2020-10-25. Retrieved 2020-09-29.
- ^ "Definition of Green Hydrogen" (PDF). Clean Energy Partnership. Retrieved 2014-09-06.[영구 데드링크]
- ^ Schneider, Stefan; Bajohr, Siegfried; Graf, Frank; Kolb, Thomas (October 2020). "State of the Art of Hydrogen Production via Pyrolysis of Natural Gas". ChemBioEng Reviews. 7 (5): 150–158. doi:10.1002/cben.202000014.
- ^ Sampson2019-02-11T10:48:00+00:00, Joanna (11 February 2019). "Blue hydrogen for a green future". gasworld. Archived from the original on 2019-05-09. Retrieved 2019-06-03.
{{cite web}}: CS1 메인트: 숫자 이름: 작성자 목록(링크) - ^ "Brown coal the hydrogen economy stepping stone ECT". Archived from the original on 2019-04-08. Retrieved 2019-06-03.
- ^ "Actual Worldwide Hydrogen Production from ..." Arno A Evers. December 2008. Archived from the original on 2015-02-02. Retrieved 2008-05-09.
- ^ Velazquez Abad, A.; Dodds, P. E. (2017-01-01), "Production of Hydrogen", in Abraham, Martin A. (ed.), Encyclopedia of Sustainable Technologies, Oxford: Elsevier, pp. 293–304, ISBN 978-0-12-804792-7, retrieved 2023-09-22
- ^ Dincer, Ibrahim; Acar, Canan (2015). "Review and evaluation of hydrogen production methods for better sustainability". International Journal of Hydrogen Energy. 40 (34): 11096. doi:10.1016/j.ijhydene.2014.12.035. ISSN 0360-3199.
- ^ a b c Press, Roman J.; Santhanam, K. S. V.; Miri, Massoud J.; Bailey, Alla V.; Takacs, Gerald A. (2008). Introduction to hydrogen Technology. John Wiley & Sons. p. 249. ISBN 978-0-471-77985-8.
- ^ Collodi, Guido (2010-03-11). "Hydrogen Production via Steam Reforming with CO2 Capture" (PDF). CISAP4 4th International Conference on Safety and Environment in the Process Industry. Retrieved 2015-11-28.
- ^ "HFCIT Hydrogen Production: Natural Gas Reforming". U.S. Department of Energy. 2008-12-15.
- ^ Badwal, Sukhvinder P. S.; Giddey, Sarbjit S.; Munnings, Christopher; Bhatt, Anand I.; Hollenkamp, Anthony F. (24 September 2014). "Emerging electrochemical energy conversion and storage technologies". Frontiers in Chemistry. 2: 79. Bibcode:2014FrCh....2...79B. doi:10.3389/fchem.2014.00079. PMC 4174133. PMID 25309898.
- ^ Werner Zittel; Reinhold Wurster (1996-07-08). "Chapter 3: Production of Hydrogen. Part 4: Production from electricity by means of electrolysis". HyWeb: Knowledge – Hydrogen in the Energy Sector. Ludwig-Bölkow-Systemtechnik GmbH. Archived from the original on 2007-02-07. Retrieved 2010-10-01.
- ^ Bjørnar Kruse; Sondre Grinna; Cato Buch (2002-02-13). "Hydrogen – Status and Possibilities". The Bellona Foundation. Archived from the original (PDF) on 2011-07-02.
Efficiency factors for PEM electrolysers up to 94% are predicted, but this is only theoretical at this time.
- ^ "high-rate and high efficiency 3D water electrolysis". Grid-shift.com. Archived from the original on 2012-03-22. Retrieved 2011-12-13.
- ^ "Wide Spread Adaption of Competitive Hydrogen Solution" (PDF). nelhydrogen.com. Nel ASA. Archived (PDF) from the original on 2018-04-22. Retrieved 22 April 2018.
- ^ Philibert, Cédric. "Commentary: Producing industrial hydrogen from renewable energy". iea.org. International Energy Agency. Archived from the original on 22 April 2018. Retrieved 22 April 2018.
- ^ IEA H2 2019, p. 37 (
- ^ "How Much Electricity/Water Is Needed to Produce 1 kg of H2 by Electrolysis?". Archived from the original on 17 June 2020. Retrieved 17 June 2020.
- ^ Petrova, Magdalena (2020-12-04). "Green hydrogen is gaining traction, but still has massive hurdles to overcome". CNBC. Retrieved 2021-06-20.
- ^ "ITM – Hydrogen Refuelling Infrastructure – February 2017" (PDF). level-network.com. Retrieved 17 April 2018.
- ^ "Cost reduction and performance increase of PEM electrolysers" (PDF). fch.europa.eu. Fuel Cells and Hydrogen Joint Undertaking. Retrieved 17 April 2018.
- ^ Kalamaras, Christos M.; Efstathiou, Angelos M. (2013). "Hydrogen Production Technologies: Current State and Future Developments". Conference Papers in Energy. 2013: 1–9. doi:10.1155/2013/690627.
- ^ "Cost reduction and performance increase of PEM electrolysers" (PDF). fch.europa.eu. Fuel Cell and Hydrogen Joint Undertaking. Retrieved 17 April 2018.
- ^ "Report and Financial Statements 30 April 2016" (PDF). itm-power.com. Retrieved 17 April 2018.
- ^ "Hydrogen Production: Natural Gas Reforming". energy.gov. US Department of Energy. Retrieved 17 April 2018.
- ^ a b Hordeski, M. F. 대체 연료: 수소의 미래. 171–199 (The Fairmont Press, Inc., 2007).
- ^ Badwal, Sukhvinder P.S.; Giddey, Sarbjit; Munnings, Christopher (2013). "Hydrogen production via solid electrolytic routes". Wiley Interdisciplinary Reviews: Energy and Environment. 2 (5): 473–487. Bibcode:2013WIREE...2..473B. doi:10.1002/wene.50. S2CID 135539661.
- ^ Sebbahi, Seddiq; Nabil, Nouhaila; et al. (2022). "Assessment of the three most developed water electrolysis technologies: Alkaline Water Electrolysis, Proton Exchange Membrane and Solid-Oxide Electrolysis". Materials Today: Proceedings. 66: 140–145. doi:10.1016/j.matpr.2022.04.264. ISSN 2214-7853. S2CID 248467810.
- ^ a b Ogden, J.M. (1999). "Prospects for building a hydrogen energy infrastructure". Annual Review of Energy and the Environment. 24: 227–279. doi:10.1146/annurev.energy.24.1.227.
- ^ Hauch, Anne; Ebbesen, Sune Dalgaard; Jensen, Søren Højgaard; Mogensen, Mogens (2008). "Highly efficient high temperature electrolysis". Journal of Materials Chemistry. 18 (20): 2331–40. doi:10.1039/b718822f.
- ^ 실험실에서 수전해는 호프만 전압계와 같은 간단한 장치로 수행할 수 있습니다."Electrolysis of water and the concept of charge". Archived from the original on 2010-06-13.
- ^ "Nuclear power plants can produce hydrogen to fuel the 'hydrogen economy'" (Press release). American Chemical Society. March 25, 2012. Archived from the original on December 10, 2019. Retrieved March 9, 2013.
- ^ Clarke, R.E.; Giddey, S.; Ciacchi, F.T.; Badwal, S.P.S.; Paul, B.; Andrews, J. (2009). "Direct coupling of an electrolyser to a solar PV system for generating hydrogen". International Journal of Hydrogen Energy. 34 (6): 2531–42. doi:10.1016/j.ijhydene.2009.01.053.
- ^ Luca Bertuccioli; et al. (7 February 2014). "Development of water electrolysis in the European Union" (PDF). Client Fuel Cells and Hydrogen Joint Undertaking. Archived from the original (PDF) on 31 March 2015. Retrieved 2 May 2018.
- ^ L. Lao; C. Ramshaw; H. Yeung (2011). "Process intensification: water electrolysis in a centrifugal acceleration field". Journal of Applied Electrochemistry. 41 (6): 645–656. doi:10.1007/s10800-011-0275-2. hdl:1826/6464. S2CID 53760672. Retrieved June 12, 2011.
- ^ Stensvold, Tore (2016년 1월 26일). «Coca-Cola-opskrift » kangjöre 수소 틸트노르스크 인더스트리벤티르 Teknisk Ukeblad, .
- ^ Stolten, Detlef (Jan 4, 2016). Hydrogen Science and Engineering: Materials, Processes, Systems and Technology. John Wiley & Sons. p. 898. ISBN 9783527674299. Retrieved 22 April 2018.
- ^ thyssenkrupp. "Hydrogen from water electrolysis – solutions for sustainability". thyssenkrupp-uhde-chlorine-engineers.com. Archived from the original on 19 July 2018. Retrieved 28 July 2018.
- ^ "ITM – Hydrogen Refuelling Infrastructure – February 2017" (PDF). level-network.com. Retrieved 17 April 2018.
- ^ "Cost reduction and performance increase of PEM electrolysers" (PDF). fch.europa.eu. Fuel Cells and Hydrogen Joint Undertaking. Retrieved 17 April 2018.
- ^ Bjørnar Kruse; Sondre Grinna; Cato Buch (13 February 2002). "Hydrogen—Status and Possibilities" (PDF). The Bellona Foundation. p. 20. Archived from the original on 16 September 2013.
{{cite web}}: CS1 maint : 잘못된 URL (링크) - ^ Fickling, David (2 December 2020). "Hydrogen Is a Trillion Dollar Bet on the Future". Bloomberg.com. Archived from the original on 2 December 2020.
green hydrogen .. current pricing of around $3 to $8 a kilogram .. gray hydrogen, which costs as little as $1
- ^ Werner Zittel; Reinhold Wurster (1996-07-08). "Chapter 3: Production of Hydrogen. Part 4: Production from electricity by means of electrolysis". HyWeb: Knowledge – Hydrogen in the Energy Sector. Ludwig-Bölkow-Systemtechnik GmbH.
- ^ Bjørnar Kruse; Sondre Grinna; Cato Buch (2002-02-13). "Hydrogen—Status and Possibilities". The Bellona Foundation. Archived from the original (PDF) on 2011-07-02.
Efficiency factors for PEM electrolysers up to 94% are predicted, but this is only theoretical at this time.
- ^ "high-rate and high efficiency 3D water electrolysis". Grid-shift.com. Archived from the original on 2012-03-22. Retrieved 2011-12-13.
- ^ "DOE Technical Targets for Hydrogen Production from Electrolysis". energy.gov. US Department of Energy. Retrieved 22 April 2018.
- ^ Deign, Jason. "Xcel Attracts 'Unprecedented' Low Prices for Solar and Wind Paired With Storage". greentechmedia.com. Wood MacKenzie. Retrieved 22 April 2018.
- ^ 2021년 6월 22일 접속
- ^ Giddey, S; Kulkarni, A; Badwal, S.P.S (2015). "Low emission hydrogen generation through carbon assisted electrolysis". International Journal of Hydrogen Energy. 40 (1): 70–4. doi:10.1016/j.ijhydene.2014.11.033.
- ^ Uhm, Sunghyun; Jeon, Hongrae; Kim, Tae Jin; Lee, Jaeyoung (2012). "Clean hydrogen production from methanol–water solutions via power-saved electrolytic reforming process". Journal of Power Sources. 198: 218–22. doi:10.1016/j.jpowsour.2011.09.083.
- ^ Ju, Hyungkuk; Giddey, Sarbjit; Badwal, Sukhvinder P.S (2017). "The role of nanosized SnO2 in Pt-based electrocatalysts for hydrogen production in methanol assisted water electrolysis". Electrochimica Acta. 229: 39–47. doi:10.1016/j.electacta.2017.01.106.
- ^ Ju, Hyungkuk; Giddey, Sarbjit; Badwal, Sukhvinder P.S; Mulder, Roger J (2016). "Electro-catalytic conversion of ethanol in solid electrolyte cells for distributed hydrogen generation". Electrochimica Acta. 212: 744–57. doi:10.1016/j.electacta.2016.07.062.
- ^ a b Lamy, Claude; Devadas, Abirami; Simoes, Mario; Coutanceau, Christophe (2012). "Clean hydrogen generation through the electrocatalytic oxidation of formic acid in a Proton Exchange Membrane Electrolysis Cell (PEMEC)". Electrochimica Acta. 60: 112–20. doi:10.1016/j.electacta.2011.11.006.
- ^ a b Badwal, Sukhvinder P. S; Giddey, Sarbjit S; Munnings, Christopher; Bhatt, Anand I; Hollenkamp, Anthony F (2014). "Emerging electrochemical energy conversion and storage technologies". Frontiers in Chemistry. 2: 79. Bibcode:2014FrCh....2...79B. doi:10.3389/fchem.2014.00079. PMC 4174133. PMID 25309898.
- ^ Ju, H; Badwal, S.P.S; Giddey, S (2018). "A comprehensive review of carbon and hydrocarbon assisted water electrolysis for hydrogen production". Applied Energy. 231: 502–533. Bibcode:2018ApEn..231..502J. doi:10.1016/j.apenergy.2018.09.125. S2CID 117669840.
- ^ Ju, Hyungkuk; Badwal, Sukhvinder; Giddey, Sarbjit (2018). "A comprehensive review of carbon and hydrocarbon assisted water electrolysis for hydrogen production". Applied Energy. 231: 502–533. Bibcode:2018ApEn..231..502J. doi:10.1016/j.apenergy.2018.09.125. S2CID 117669840.
- ^ Sasidhar, Nallapaneni (November 2023). "Carbon Neutral Fuels and Chemicals from Standalone Biomass Refineries" (PDF). Indian Journal of Environment Engineering. 3 (2): 1–8. doi:10.54105/ijee.B1845.113223. ISSN 2582-9289. S2CID 265385618. Retrieved 3 December 2023.
- ^ http://www.nedstack.com/images/stories/news/documents/20120202_Press%20release%20Solvay%20PEM%20Power%20Plant%20start%20up.pdf Wayback Machine Nedstack에 보관된 2014-12-08
- ^ "Different Gases from Steel Production Processes". Archived from the original on 27 March 2016. Retrieved 5 July 2020.
- ^ "Production of Liquefied Hydrogen Sourced by COG" (PDF). Archived (PDF) from the original on 8 February 2021. Retrieved 8 July 2020.
- ^ "Hydrogen technologies". www.interstatetraveler.us.
- ^ [1][영구 데드링크][전체 인용 필요]
- ^ "Kværner-process with plasma arc waste disposal technology". Archived from the original on 2014-03-13. Retrieved 2009-10-13.
- ^ "Emissions Advantages of Gasification". National Energy Technology Laboratory. U.S. Department of Energy.
- ^ "Emissions from burning coal". U.S. EIA. U.S. Energy Information Administration.
- ^ Lee, Woon-Jae; Lee, Yong-Kuk (2001). "Internal Gas Pressure Characteristics Generated during Coal Carbonization in a Coke Oven". Energy & Fuels. 15 (3): 618–23. doi:10.1021/ef990178a.
- ^ Gemayel, Jimmy El; MacChi, Arturo; Hughes, Robin; Anthony, Edward John (2014). "Simulation of the integration of a bitumen upgrading facility and an IGCC process with carbon capture". Fuel. 117: 1288–97. doi:10.1016/j.fuel.2013.06.045.
- ^ Blain, Loz (2022-10-04). "Oil-eating microbes excrete the world's cheapest "clean" hydrogen". New Atlas. Retrieved 2022-10-06.
- ^ 방사선화학 개론 7장
- ^ 핵수소 생산 핸드북 8장
- ^ Li-Hung Lin; Pei-Ling Wang; Douglas Rumble; Johanna Lippmann-Pipke; Erik Boice; Lisa M. Pratt; Barbara Sherwood Lollar; Eoin L. Brodie; Terry C. Hazen; Gary L. Andersen; Todd Z. DeSantis; Duane P. Moser; Dave Kershaw; T. C. Onstott (2006). "Long-Term Sustainability of a High-Energy, Low-Diversity Crustal Biome". Science. 314 (5798): 479–82. Bibcode:2006Sci...314..479L. doi:10.1126/science.1127376. PMID 17053150. S2CID 22420345.
- ^ "Dream or Reality? Electrification of the Chemical Process Industries". www.aiche-cep.com. Retrieved 2021-08-22.
- ^ Guoxin, Hu; Hao, Huang (May 2009). "Hydrogen rich fuel gas production by gasification of wet biomass using a CO2 sorbent". Biomass and Bioenergy. 33 (5): 899–906. doi:10.1016/j.biombioe.2009.02.006. ISSN 0961-9534.
- ^ Ping, Zhang; Laijun, Wang; Songzhe, Chen; Jingming, Xu (2018-01-01). "Progress of nuclear hydrogen production through the iodine–sulfur process in China". Renewable and Sustainable Energy Reviews. 81: 1802–1812. doi:10.1016/j.rser.2017.05.275. ISSN 1364-0321.
- ^ 수소 생산: 열화학적 주기
- ^ IEA 에너지 기술 에센셜 – Wayback Machine에서 2011-11-03 보관 중인 수소 생산 및 유통, 2007년 4월
- ^ "HTTR High Temperature engineering Test Reactor". Httr.jaea.go.jp. Archived from the original on 2014-02-03. Retrieved 2014-01-23.
- ^ https://smr.inl.gov/Document.ashx?path=DOCS%2FGCR-Int%2FNHDDELDER.pdf Wayback Machine에 보관된 2016-12-21. 원자력 에너지의 발전 수소 생산을 위한 원자력 열: 매우 고온/고온 반응기를 수소 생산 공장에 결합하는 것. 2009
- ^ "Status report 101 – Gas Turbine High Temperature Reactor (GTHTR300C)" (PDF).
- ^ "JAEA'S VHTR FOR HYDROGEN AND ELECTRICITY COGENERATION: GTHTR300C" (PDF). Archived from the original (PDF) on 2017-08-10. Retrieved 2013-12-04.
- ^ Chukwu, C., Naterer, G.F., Rosen, M.A., "Cu-Cl 사이클을 갖는 핵 생산 수소의 공정 시뮬레이션", 캐나다 온타리오주 토론토, 제29차 캐나다 원자력 학회, 2008년 6월 1일부터 4일까지.
- ^ 보고서 40호: 수소 발생을 위한 페로실리콘 공정
- ^ 후보 과학: 유명한 화학자들과의 대화, 이스반 하기타이, 마그돌나 하기타이, p. 261, Imperial College Press (2000) ISBN 1-86094-228-8
- ^ Hemschemeier, Anja; Melis, Anastasios; Happe, Thomas (2009). "Analytical approaches to photobiological hydrogen production in unicellular green algae". Photosynthesis Research. 102 (2–3): 523–40. Bibcode:2009PhoRe.102..523H. doi:10.1007/s11120-009-9415-5. PMC 2777220. PMID 19291418.
- ^ "DOE 2008 Report 25 %" (PDF).
- ^ Jenvanitpanjakul, Peesamai (February 3–4, 2010). Renewable Energy Technology And Prospect On Biohydrogen Study In Thailand (PDF). Steering Committee Meeting and Workshop of APEC Research Network for Advanced Biohydrogen Technology. Taichung: Feng Chia University. Archived from the original (PDF) on July 4, 2013.
- ^ Navarro Yerga, Rufino M.; Álvarez Galván, M. Consuelo; Del Valle, F.; Villoria De La Mano, José A.; Fierro, José L. G. (2009). "Water Splitting on Semiconductor Catalysts under Visible-Light Irradiation". ChemSusChem. 2 (6): 471–85. Bibcode:2009ChSCh...2..471N. doi:10.1002/cssc.200900018. PMID 19536754.
- ^ Navarro, R.M.; Del Valle, F.; Villoria De La Mano, J.A.; Álvarez-Galván, M.C.; Fierro, J.L.G. (2009). "Photocatalytic Water Splitting Under Visible Light: Concept and Catalysts Development". Photocatalytic Technologies. Advances in Chemical Engineering. Vol. 36. pp. 111–43. doi:10.1016/S0065-2377(09)00404-9. ISBN 978-0-12-374763-1.
- ^ Ropero-Vega, J.L.; Pedraza-Avella, J.A.; Niño-Gómez, M.E. (September 2015). "Hydrogen production by photoelectrolysis of aqueous solutions of phenol using mixed oxide semiconductor films of Bi–Nb–M–O (M=Al, Fe, Ga, In) as photoanodes". Catalysis Today. 252: 150–156. doi:10.1016/j.cattod.2014.11.007.
- ^ Low, Jingxiang; Yu, Jiaguo; Jaroniec, Mietek; Wageh, Swelm; Al-Ghamdi, Ahmed A. (May 2017). "Heterojunction Photocatalysts". Advanced Materials. 29 (20). Bibcode:2017AdM....2901694L. doi:10.1002/adma.201601694. ISSN 0935-9648. PMID 28220969. S2CID 21261127.
- ^ Djurišić, Aleksandra B.; He, Yanling; Ng, Alan M. C. (2020-03-01). "Visible-light photocatalysts: Prospects and challenges". APL Materials. 8 (3): 030903. Bibcode:2020APLM....8c0903D. doi:10.1063/1.5140497. ISSN 2166-532X.
- ^ Sasidhar, Nallapaneni (November 2023). "Carbon Neutral Fuels and Chemicals from Standalone Biomass Refineries" (PDF). Indian Journal of Environment Engineering. 3 (2): 1–8. doi:10.54105/ijee.B1845.113223. ISSN 2582-9289. S2CID 265385618. Retrieved 29 December 2023.
- ^ a b Asadi, Nooshin; Karimi Alavijeh, Masih; Zilouei, Hamid (2017). "Development of a mathematical methodology to investigate biohydrogen production from regional and national agricultural crop residues: A case study of Iran". International Journal of Hydrogen Energy. 42 (4): 1989–2007. doi:10.1016/j.ijhydene.2016.10.021.
- ^ Tao, Y; Chen, Y; Wu, Y; He, Y; Zhou, Z (2007). "High hydrogen yield from a two-step process of dark- and photo-fermentation of sucrose". International Journal of Hydrogen Energy. 32 (2): 200–6. doi:10.1016/j.ijhydene.2006.06.034.
- ^ Rajanandam, Brijesh; Kiran, Siva (2011). "Optimization of hydrogen production by Halobacterium salinarium coupled with E coli using milk plasma as fermentative substrate". Journal of Biochemical Technology. 3 (2): 242–4. Archived from the original on 2013-07-31. Retrieved 2013-03-09.
- ^ Asadi, Nooshin; Zilouei, Hamid (March 2017). "Optimization of organosolv pretreatment of rice straw for enhanced biohydrogen production using Enterobacter aerogenes". Bioresource Technology. 227: 335–344. Bibcode:2017BiTec.227..335A. doi:10.1016/j.biortech.2016.12.073. PMID 28042989.
- ^ Percival Zhang, Y-H; Sun, Jibin; Zhong, Jian-Jiang (2010). "Biofuel production by in vitro synthetic enzymatic pathway biotransformation". Current Opinion in Biotechnology. 21 (5): 663–9. doi:10.1016/j.copbio.2010.05.005. PMID 20566280.
- ^ Strik, David P. B. T. B.; Hamelers (Bert), H. V. M.; Snel, Jan F. H.; Buisman, Cees J. N. (2008). "Green electricity production with living plants and bacteria in a fuel cell". International Journal of Energy Research. 32 (9): 870–6. Bibcode:2008IJER...32..870S. doi:10.1002/er.1397. S2CID 96849691.
- "Living plants produce energy". Wageningen University and Research Centre (Press release). Archived from the original on 2010-05-17.
- ^ Timmers, Ruud (2012). Electricity generation by living plants in a plant microbial fuel cell (PhD Thesis). Wageningen University. ISBN 978-94-6191-282-4.[페이지 필요]
- ^ "Aluminum Based Nanogalvanic Alloys for Hydrogen Generation". U.S. Army Combat Capabilities Development Command Army Research Laboratory. Retrieved January 6, 2020.
- ^ McNally, David (July 25, 2017). "Army discovery may offer new energy source". U.S. Army. Retrieved January 6, 2020.
- ^ Gaucher, Éric C. (February 2020). "New Perspectives in the Industrial Exploration for Native Hydrogen". Elements: An International Magazine of Mineralogy, Geochemistry, and Petrology. 16 (1): 8-9. Bibcode:2020Eleme..16....8G. doi:10.2138/gselements.16.1.8.
- ^ Hand, Eric. "Hidden hydrogen". science.org. Science. Retrieved 9 December 2023.
- ^ "The Potential for Geologic Hydrogen for Next-Generation Energy U.S. Geological Survey".
- ^ Fernandez, Sonia. "Researchers develop potentially low-cost, low-emissions technology that can convert methane without forming CO2". Phys-Org. American Institute of Physics. Archived from the original on 19 October 2020. Retrieved 19 October 2020.
- ^ BASF. "BASF researchers working on fundamentally new, low-carbon production processes, Methane Pyrolysis". United States Sustainability. BASF. Archived from the original on 19 October 2020. Retrieved 19 October 2020.
- ^ Schneider, Stefan; Bajohr, Siegfried; Graf, Frank; Kolb, Thomas (October 2020). "State of the Art of Hydrogen Production via Pyrolysis of Natural Gas". ChemBioEng Reviews. 7 (5): 150–158. doi:10.1002/cben.202000014.
- ^ Upham, D. Chester; Agarwal, Vishal; Khechfe, Alexander; Snodgrass, Zachary R.; Gordon, Michael J.; Metiu, Horia; McFarland, Eric W. (17 November 2017). "Catalytic molten metals for the direct conversion of methane to hydrogen and separable carbon". Science. 358 (6365): 917–921. Bibcode:2017Sci...358..917U. doi:10.1126/science.aao5023. PMID 29146810. S2CID 206663568.
- ^ Palmer, Clarke; Upham, D. Chester; Smart, Simon; Gordon, Michael J.; Metiu, Horia; McFarland, Eric W. (January 2020). "Dry reforming of methane catalysed by molten metal alloys". Nature Catalysis. 3 (1): 83–89. doi:10.1038/s41929-019-0416-2. S2CID 210862772.
- ^ Cartwright, Jon. "The reaction that would give us clean fossil fuels forever". NewScientist. New Scientist Ltd. Archived from the original on 26 October 2020. Retrieved 30 October 2020.
- ^ Karlsruhe Institute of Technology. "Hydrogen from methane without CO2 emissions". Phys.Org. Archived from the original on 21 October 2020. Retrieved 30 October 2020.
- ^ 절차 hcei.tsc.ru
- ^ Lumbers, Brock (2022). "Mathematical modelling and simulation of the thermo-catalytic decomposition of methane for economically improved hydrogen production". International Journal of Hydrogen Energy. 47 (7): 4265–4283. doi:10.1016/j.ijhydene.2021.11.057. S2CID 244814932. Retrieved 16 March 2022.
- ^ Tao, Yongzhen; Chen, Yang; Wu, Yongqiang; He, Yanling; Zhou, Zhihua (1 February 2007). "High hydrogen yield from a two-step process of dark- and photo-fermentation of sucrose". International Journal of Hydrogen Energy. 32 (2): 200–206. doi:10.1016/j.ijhydene.2006.06.034. INIST 18477081.
- ^ "Hydrogen production from organic solid matter". Biohydrogen.nl. Archived from the original on 2011-07-20. Retrieved 2010-07-05.
- ^ Hemschemeier, Anja; Melis, Anastasios; Happe, Thomas (December 2009). "Analytical approaches to photobiological hydrogen production in unicellular green algae". Photosynthesis Research. 102 (2–3): 523–540. Bibcode:2009PhoRe.102..523H. doi:10.1007/s11120-009-9415-5. PMC 2777220. PMID 19291418.
- ^ "NanoLogix generates energy on-site with bioreactor-produced hydrogen". Solid State Technology. September 20, 2007. Archived from the original on 2018-05-15. Retrieved 14 May 2018.
- ^ "Power from plants using microbial fuel cell" (in Dutch). Archived from the original on 2021-02-08. Retrieved 2010-07-05.
- ^ Janssen, H; Emonts, B.; Groehn, H. G.; Mai, H.; Reichel, R.; Stolten, D. (1 July 2001). High pressure electrolysis : the key technology for efficient H2 production (PDF). Hypothesis IV: Hydrogen power – theoretical and engineering solutions international symposium.[영구 데드링크]
- ^ Carmo, M; Fritz D; Mergel J; Stolten D (2013). "A comprehensive review on PEM water electrolysis". Journal of Hydrogen Energy. 38 (12): 4901–4934. doi:10.1016/j.ijhydene.2013.01.151.
- ^ "2003-PHOEBUS-Pag.9" (PDF). Archived from the original (PDF) on 2009-03-27. Retrieved 2010-07-05.
- ^ "Finland exporting TEN-T fuel stations". December 2015. Archived from the original on 2016-08-28. Retrieved 2016-08-22.
- ^ "Steam heat: researchers gear up for full-scale hydrogen plant" (Press release). Science Daily. 2008-09-18. Archived from the original on 2008-09-21. Retrieved 2008-09-19.
- ^ "Nuclear Hydrogen R&D Plan" (PDF). U.S. Dept. of Energy. March 2004. Archived from the original (PDF) on 2008-05-18. Retrieved 2008-05-09.
- ^ Valenti, Giovanni; Boni, Alessandro; Melchionna, Michele; Cargnello, Matteo; Nasi, Lucia; Bertoni, Giovanni; Gorte, Raymond J.; Marcaccio, Massimo; Rapino, Stefania; Bonchio, Marcella; Fornasiero, Paolo; Prato, Maurizio; Paolucci, Francesco (December 2016). "Co-axial heterostructures integrating palladium/titanium dioxide with carbon nanotubes for efficient electrocatalytic hydrogen evolution". Nature Communications. 7 (1): 13549. Bibcode:2016NatCo...713549V. doi:10.1038/ncomms13549. PMC 5159813. PMID 27941752.
- ^ William Ayers, 미국 특허 4,466,869 광분해 수소 제조
- ^ a b Navarro Yerga, Rufino M.; Álvarez Galván, M. Consuelo; del Valle, F.; Villoria de la Mano, José A.; Fierro, José L. G. (22 June 2009). "Water Splitting on Semiconductor Catalysts under Visible-Light Irradiation". ChemSusChem. 2 (6): 471–485. Bibcode:2009ChSCh...2..471N. doi:10.1002/cssc.200900018. PMID 19536754.
- ^ a b Navarro, R.M.; Del Valle, F.; Villoria de la Mano, J.A.; Álvarez-Galván, M.C.; Fierro, J.L.G. (2009). "Photocatalytic Water Splitting Under Visible Light". Advances in Chemical Engineering - Photocatalytic Technologies. Vol. 36. pp. 111–143. doi:10.1016/S0065-2377(09)00404-9. ISBN 978-0-12-374763-1.
- ^ Nann, Thomas; Ibrahim, Saad K.; Woi, Pei-Meng; Xu, Shu; Ziegler, Jan; Pickett, Christopher J. (22 February 2010). "Water Splitting by Visible Light: A Nanophotocathode for Hydrogen Production". Angewandte Chemie International Edition. 49 (9): 1574–1577. doi:10.1002/anie.200906262. PMID 20140925.
- ^ Yamamura, Tetsushi (August 2, 2015). "Panasonic moves closer to home energy self-sufficiency with fuel cells". Asahi Shimbun. Archived from the original on August 7, 2015. Retrieved 2015-08-02.
- ^ "DLR Portal – DLR scientists achieve solar hydrogen production in a 100-kilowatt pilot plant". Dlr.de. 2008-11-25. Archived from the original on 2013-06-22. Retrieved 2009-09-19.
- ^ "353 Thermochemical cycles" (PDF). Archived (PDF) from the original on 2009-02-05. Retrieved 2010-07-05.
- ^ UNLV 열화학주기 자동 채점 데이터베이스(공용)[영구 데드링크]
- ^ "Development of Solar-powered Thermochemical Production of Hydrogen from Water" (PDF). Archived (PDF) from the original on 2007-04-17. Retrieved 2010-07-05.
- ^ Jie, Xiangyu; Li, Weisong; Slocombe, Daniel; Gao, Yige; Banerjee, Ira; Gonzalez-Cortes, Sergio; Yao, Benzhen; AlMegren, Hamid; Alshihri, Saeed; Dilworth, Jonathan; Thomas, John; Xiao, Tiancun; Edwards, Peter (2020). "Microwave-initiated catalytic deconstruction of plastic waste into hydrogen and high-value carbons" (PDF). Nature Catalysis. 3 (11): 902–912. doi:10.1038/s41929-020-00518-5. ISSN 2520-1158. S2CID 222299492. Archived (PDF) from the original on 2021-07-16. Retrieved 2021-10-24.
- ^ "Bellona-HydrogenReport". Interstatetraveler.us. Archived from the original on 2016-06-03. Retrieved 2010-07-05.
- ^ https://www.hfpeurope.org/infotools/energyinfos__e/hydrogen/main03.html[영구 데드링크]
- ^ Prinzhofer, Alain; Tahara Cissé, Cheick Sidy; Diallo, Aliou Boubacar (October 2018). "Discovery of a large accumulation of natural hydrogen in Bourakebougou (Mali)". International Journal of Hydrogen Energy. 43 (42): 19315–19326. doi:10.1016/j.ijhydene.2018.08.193. S2CID 105839304.
- ^ Larin, Nikolay; Zgonnik, Viacheslav; Rodina, Svetlana; Deville, Eric; Prinzhofer, Alain; Larin, Vladimir N. (September 2015). "Natural Molecular Hydrogen Seepage Associated with Surficial, Rounded Depressions on the European Craton in Russia". Natural Resources Research. 24 (3): 369–383. Bibcode:2015NRR....24..369L. doi:10.1007/s11053-014-9257-5. S2CID 128762620.
- ^ Gaucher, Eric C. (1 February 2020). "New Perspectives in the Industrial Exploration for Native Hydrogen". Elements. 16 (1): 8–9. Bibcode:2020Eleme..16....8G. doi:10.2138/gselements.16.1.8.
- ^ Truche, Laurent; Bazarkina, Elena F. (2019). "Natural hydrogen the fuel of the 21 st century". E3S Web of Conferences. 98: 03006. Bibcode:2019E3SWC..9803006T. doi:10.1051/e3sconf/20199803006.
- ^ "The Potential for Geologic Hydrogen for Next-Generation Energy U.S. Geological Survey".
- ^ Rapier, Robert (May 26, 2020). "Life Cycle Emissions of Hydrogen Climate". 4thgeneration.energy. Retrieved 2023-12-12.
- ^ Hessler, Uwe (December 6, 2020). "First element in periodic table: Why all the fuss about hydrogen?". dw.com. Deutsche Welle.
- ^ "유럽 최대 블루수소 공장 건설 및 장기 계약 강화를 위한 에어프로덕츠", 에어프로덕츠 보도자료, 2023년 11월 6일 2023-11-14 회수.
- ^ Robert W. Howarth; Mark Z. Jacobson (12 August 2021). "How green is blue hydrogen?". Energy Science & Engineering. doi:10.1002/ESE3.956. ISSN 2050-0505. Wikidata Q108067259.
- ^ Antonini, Cristina, et al. "탄소 포집 및 저장을 통해 천연 가스 및 바이오메탄으로부터 수소 생산 – 기술-환경 분석", 지속 가능한 에너지 & 연료, 왕립 화학 협회, 2020. 2023-12-12 확정
- ^ 2021년 10월 ZEP "저탄소 수소에 관한 사실 – 유럽적 관점" 2023-12-12 확정
- ^ "New Horizons for Hydrogen" (PDF). Research Review (2). National Renewable Energy Laboratory: 2–9. April 2004.
- ^ 드보락, 프레드 "WSJ 뉴스 독점: 그린 수소, 40억 달러 규모의 공장으로 미국에서 성장: Air Products와 AES의 합작 공장인 계획된 공장..."], 월스트리트저널, 2022년 12월 8일. 2023-11-14 회수. (가입 필요)
- ^ Collins, Leigh (25 January 2022). "World first for nuclear-powered pink hydrogen as commercial deal signed in Sweden Recharge". Recharge Latest renewable energy news.
- ^ a b Collins, Leigh (19 March 2020). "A wake-up call on green hydrogen: the amount of wind and solar needed is immense Recharge". Recharge Latest renewable energy news. Archived from the original on 4 June 2021.
- ^ "How does the energy crisis affect the transition to net zero?". European Investment Bank. Retrieved 2022-12-23.
- ^ "Hydrogen – Fuels & Technologies". IEA. Retrieved 2022-12-23.
- ^ Castelvecchi, Davide (2022-11-16). "How the hydrogen revolution can help save the planet — and how it can't". Nature. 611 (7936): 440–443. Bibcode:2022Natur.611..440C. doi:10.1038/d41586-022-03699-0. PMID 36385542. S2CID 253525130.
- ^ "Hydrogen". energy.ec.europa.eu. Retrieved 2022-12-23.
- ^ Ritchie, Hannah. "How many people does synthetic fertilizer feed?". Our World in Data. Global Change Data Lab. Retrieved 16 September 2021.
추가읽기
- Francesco Calise; et al., eds. (2019). Solar Hydrogen Production. Academic Press. ISBN 978-0-12-814853-2.


