질산암모늄
Ceric ammonium nitrate | |
| 이름 | |
|---|---|
| IUPAC 이름 세륨 직경(Diammonium cerium)IV) 질산염 | |
| 기타 이름 질산암모늄(CAN) | |
| 식별자 | |
3D 모델(JSmol) | |
| 켐스파이더 | |
| ECHA InfoCard | 100.037.100 |
| EC 번호 |
|
펍켐 CID | |
| 유니 | |
CompTox 대시보드 (EPA) | |
| |
| |
| 특성. | |
| H8N8CeO18 | |
| 어금질량 | 548.218 g·190−1 |
| 외관 | 주황색 적색 결정체 |
| 녹는점 | 107~108°C(225~226°F, 380~381K) |
| 141 g/100 mL(25 °C) 227 g/100 mL (80 °C) | |
| 구조 | |
| 단음이의 | |
| 이코사헤드랄 | |
| 위험 | |
| GHS 라벨 표시: | |
  [1] [1] | |
| 위험 | |
| H272, H302, H315, H319, H335 | |
| P220, P261, P305+P351+P338 | |
| 관련 화합물 | |
관련 화합물 | 질산암모늄 세륨(IV) 산화물 |
달리 명시된 경우를 제외하고, 표준 상태(25°C [77°F], 100 kPa)의 재료에 대한 데이터가 제공된다. | |
| Infobox 참조 자료 | |
질산 세리암모늄(Ceric 암모늄, 2질산염, CAN)은 (NH4)Ce(NO3)라는 공식을 가진 무기 화합물이다.6 이 오렌지색 적색의 수용성 세륨 소금은 유기합성에 특화된 산화제로서 정량 분석에는 표준 산화제다.
준비, 특성 및 구조
음이온 [Ce(NO
3)]
62−
는 CeO를
2
3 고온 농축 HNO에3 녹여 생성된다.
소금은 음이온[Ce(NO
3)]
62−
과 NH4+ 카운터 이온 한 쌍으로 구성된다. 암모늄 이온은 이 소금의 산화 반응에 관여하지 않는다. 음이온에서 각 질산염 그룹은 아래와 같이 세륨 원자를 bidentate 방식으로 첼로화한다.
음이온 [Ce(NO
3)]
62−
에는 Th(이상화된 Oh) 분자 대칭이 있다. CeO12 core는 이코사면체를 정의한다.[3]
ce는4+ 강한 일렉트로닉 산화제다. 리독스 전위(E° ~ 1.61V vs. N.H.E.)로 볼 때 Cl2(E° ~ 1.36V)보다 더 강한 산화제다. 선반 고정형 시약 중 더 강한 산화제인 경우는 거의 없다. redox 공정에서 Ce(IV)는 Ce(III)로 변환되는데, 한 전자의 변화로, 주황색에서 옅은 노란색으로 용액 색상이 퇴색됨(기질과 제품이 강하게 색칠되지 않음)으로 신호된다.
유기화학분야의 응용
유기 합성에서 CAN은 C-H 결합, 특히 벤질릭 결합뿐만 아니라 많은 기능 그룹(알코올, 페놀, 에테르)의 산화제로 유용하다. 알케네는 용제에 의존하지만 다이닛록실화를 겪는다. 퀴논은 카테콜과 하이드로퀴논에서 생산되며 니트로알카인까지 산화된다.
예를 들어, CAN은 Nef 반응에 대한 대안을 제공한다. 예를 들어, 복잡한 측면 반응이 보통 다른 시약을 사용하여 마주치는 케토마크로라이드 합성의 경우. 산화 할로겐화는 벤질릭 브롬화 및 케톤과 우라실 유도체의 요오드화합물로서 CAN에 의해 촉진될 수 있다.
헤테로사이클의 합성을 위해
수용성 CAN의 촉매 양은 퀴녹살린 유도체의 효율적인 합성을 가능하게 한다. 퀴녹살린은 염료, 유기 반도체, DNA 절삭제 등으로 잘 알려져 있다. 이 유도체들은 또한 에치노마이신과 액티노마이신과 같은 항생제의 성분들이다. 아일린과 알킬 비닐에테르 사이의 CAN 분석 3성분 반응은 2-메틸-1,2,3,4-테트라하이드로퀴놀린과 그 아로마화를 통해 얻은 해당 퀴놀린에 효율적으로 진입할 수 있다.
제거 시약으로
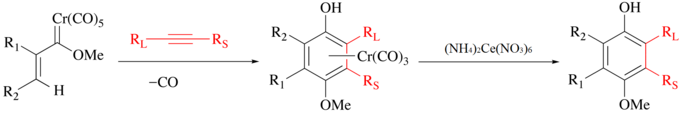
CAN은 전통적으로 금속 카보닐로부터 유기 리간드를 방출하는 데 사용된다. 이 과정에서 금속이 산화되고, CO가 진화되며, 유기 리간드가 방출되어 추가 조작을 하게 된다.[4] 예를 들어 Wulff-Döz 반응으로 알킨, 일산화탄소, 크롬 카베네가 결합되어 크롬 반샌드위치 콤플렉스를[5][6] 형성하고 페놀 리간드는 경미한 CAN 산화에 의해 격리될 수 있다.
CAN은 파라-메톡시벤질(Para-Methoxybenzyl)과 3,4-디메트호시벤질 에테르(Dimethoxybenzyl Ethers)를 분쇄하는 데 사용되며, 이는 알코올의 그룹을 보호하는 역할을 한다.[7][8] 각각 파라메톡시벤질 에테르 등가물에 대해 CAN 등가물 2개가 필요하다. 알코올이 방출되고 파라메톡시벤질 에테르가 파라메톡시벤츠알데히드로 변환된다. 균형 방정식은 다음과 같다.
- 2 (NH4)2Ce(NO3)6 + HCOCHCHOR3642 + HOR2 → 4NH4+ + 2 Ce3+ + 12 NO3− + 2H+ + HCOCHCHO364 + HOR
기타 응용 프로그램
CAN은 포토마스크와 액정표시장치(액정표시장치) 생산에 쓰이는 재료인 [9]크롬 에칭트(chrome etchant)의 성분이기도 하다.[citation needed]
참조
- ^ 시그마알드리히 주식회사, 암모늄 세륨(Amonium cerium)IV) 질산염. 2015-05-13년에 검색됨.
- ^ "CSD Entry 1598999, ICSD Entry 22219, H8CeN8O18". Cambridge Structural Database: Access Structures. Cambridge Crystallographic Data Centre. Retrieved 2021-11-05.
- ^ a b Thomas A. Beineke; J. Delgaudio (1968). "Crystal structure of ceric ammonium nitrate". Inorg. Chem. 7 (4): 715–721. doi:10.1021/ic50062a020.
- ^ L. Brener, J. S. McKennis, R. 페티트 "합성에서의 사이클로부타디엔: 엔도 트리시클로[4.4.0.02,5]데카-3,8-diene-7,10-dione" 조직. 신스. 1976, 55, 43.doi:10.15227/orgsynx.055.0043
- ^ Waters, M.; Wulff, W. D. (2008). "The Synthesis of Phenols and Quinones via Fischer Carbene Complexes". Organic Reactions. 70 (2): 121–623. doi:10.1002/0471264180.or070.02.
- ^ Dötz, K. H. (1983). "Carbon-Carbon Bond Formation via Carbonyl-Carbene Complexes". Pure and Applied Chemistry. 55 (11). doi:10.1351/pac198355111689.
- ^ 분스, 거트-잔; 헤일, 칼 J(2000년) 탄수화물을 이용한 유기합성(1차 개정) 영국 셰필드: 셰필드 학술지 33페이지
- ^ 코시엔스키, 필립 J. (1994년). 그룹 보호, Stuttgart, New York Georg Tieme Verlag. 페이지 8-9, 52-54
- ^ Walker, Perrin; William H. Tarn (1991). CRC Handbook of Metal Etchants. pp. 287–291. ISBN 0-8493-3623-6.