네프 반응
Nef reaction
| 네프 반응 | |
|---|---|
| 이름을 따서 명명됨 | 존 울릭 네프 |
| 반응형 | 치환반응 |
| 식별자 | |
| 유기화학포털 | nef-beating |
| RSC 온톨로지 ID | RXNO:0000157 |
네프 반응은 1차 또는 2차 니트로알카인 염분의 산 가수분해(1)를 알데히드나 케톤(3)과 아산화질소(4)에 설명하는 유기 반응이다. 그 반응은 여러 문학 평론의 주제가 되어 왔다.[1][2][3]
화학자 존 울릭 네프는 1894년 니트로에탄 나트륨 소금을 황산으로 처리해 아산화질소의 85-89% 수율과 아세트알데히드의 최소 70% 수율을 보였다고 보고했다.[4] 그러나 이러한 반응은 1893년 1페닐니트로에탄의 칼륨소금을 황산으로 환산한 고노발로프에 의해 1년 앞서 개척되었다.[5]
반응 메커니즘
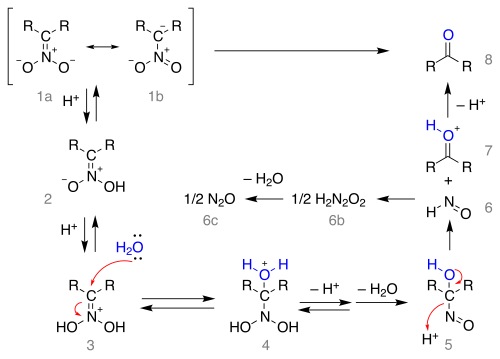
공진 구조 1a 및 1b로서 니트로나이트 소금에서 시작되는 반응 메커니즘은 다음과 같다.
소금은 니트로닉산 2(일부 경우 이 니트로나이트가 격리된 경우)를 형성하고 이미늄 이온 3에 다시 한 번 양성된다. 이 중간은 많은 네프 반응에서 반응 혼합물의 진한 청색에 책임이 있는 것으로 여겨지는 1-니트로소-알칼놀 5에 양성자를 잃고 나서 물을 형성하는 핵 첨가물에서 물의 공격을 받는다. 이 중간재배는 저포니톨산 6(아산화질소 6c~6b를 형성함)과 옥소늄 이온 7로, 양성자를 손실하여 카보닐 화합물을 형성한다.
니트로 화합물에서 질산염의 형성은 알파 수소 원자를 필요로 하기 때문에 3차 질산 화합물에서 반응이 실패한다는 점에 유의한다.
범위
Nef 반응은 유기적 합성에서 자주 발생한다. 탄수화물 화학에는 예를 들어 D-아라비노스와 C-14-니트로메탄의 C-D-만노스와14 C-D-글루코스의14 동위원소 라벨링에서 알도스에 대한 체인 확장법으로 적용되었다(여기서 첫 번째 단계는 헨리 반응이다).
그 반대반응은 워홀 분해다.
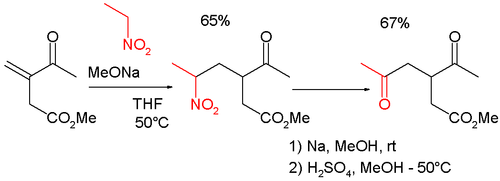
이 반응은 다음과 같은 γ-케토-카르보닐의 합성에서도 마이클 반응과 함께 사용된다.[6]
또는 2,5 헵탄데디온[7]
중간 염기 없이 강한 산을 가진 니트로 화합물을 가수분해하면 카르복실산과 히드록실아민 염이 형성된다.
네프 반응의 가수분해 단계는 또한 주석(IV) 염화나[8] 철(III) 염화나[9] 옥소네와 같은 산화제와 같은 루이스 산으로도 수행할 수 있다.[10]
참조
- ^ Noland, Wayland E. (1955). "The NEF Reaction". Chemical Reviews. 55 (1): 137–155. doi:10.1021/cr50001a003.
- ^ Pinnick, Harold W. (1990). "The Nef Reaction". In Paquette, Leo A. (ed.). Organic Reactions Volume 38 (1st ed.). New York: Wiley. pp. 655–792. doi:10.1002/0471264180.or038.03. ISBN 9780471515944.
- ^ Grierson, David S.; Husson, Henri-Philippe (1991). "4.7 – Polonovski- and Pummerer-type Reactions and the Nef Reaction". In Trost, Barry; Fleming, Ian (eds.). Comprehensive Organic Synthesis: Selectivity, Strategy and Efficiency in Modern Organic Synthesis, Volume 6 (1st ed.). New York: Pergamon. pp. 909–947. doi:10.1016/B978-0-08-052349-1.00175-X. ISBN 9780080359298.
- ^ Nef, John Ulric (1894). "Ueber die Constitution der Salze der Nitroparaffine". Justus Liebigs Annalen der Chemie. 280 (2–3): 263–291. doi:10.1002/jlac.18942800209.
- ^ 고노발로프, : J. 러스. 물리 화학 Soc. 2 1893, 6(I), 509.
- ^ γ기능성 사이클로펜테논 Nour Lahmar, Taïcir Ben Ayed, Moncef Bellassoued 및 Hassen Amri Beilstein Journal of Organic Chemistry 2005, 1:11 doi:10.11860-5397-1-11.
- ^ McMurry, John E.; Melton, Jack (1977). "Conversion of Nitro to Carbonyl by Ozonolysis of Nitronates: 2,5-Heptandione". Organic Syntheses. 56: 36. doi:10.15227/orgsyn.056.0036.
- ^ Miyashita, Masaaki; Yanami, Tetsuji; Yoshikoshi, Akira (1981). "Synthesis of 1,4-Diketones from Silyl Enol Ethers and Nitroolefins: 2-(2-Oxopropyl)cyclohexanone". Organic Syntheses. 60: 117. doi:10.15227/orgsyn.060.0117.
- ^ Heinzelman, R. V. (1955). "o-Methoxyphenylacetone". Organic Syntheses. 35: 74. doi:10.15227/orgsyn.035.0074.
- ^ Ceccherelli, Paolo; Curinia, Massimo; Marcotullioa, Maria Carla; Epifanoa, Francesco; Rosatia, Ornelio (1998). "Oxone® Promoted Nef Reaction. Simple Conversion of Nitro Group Into Carbonyl". Synthetic Communications. 28 (16): 3057–3064. doi:10.1080/00397919808004885.