사지 발달
Limb development| 사지의 발달 | |
|---|---|
 임신 6주의 인간 배아 그림 | |
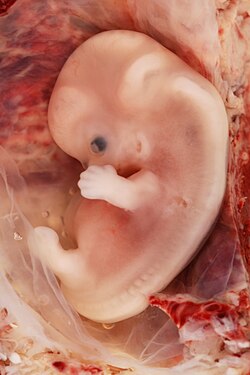 자궁외 임신으로 인한 9주간의 인간 태아 | |
| 해부학 용어 |
척추동물의 사지 발달은 발달생물학과 진화생물학 모두에서 활발한 연구 분야이며, 후자의 연구는 지느러미에서 사지로의 [1]전환에 초점을 맞추고 있다.
외배엽이 부풀어 올라 사지 싹을 형성할 정도로 측판 중배엽의 중간엽 세포가 증식하면서 사지 형성이 시작된다.섬유아세포 성장인자(FGF)는 세포 발달을 유도하고 세포사멸을 조절하는 원추외배엽능선(AER)이라고 불리는 사지 싹 끝에 조직체를 형성하도록 유도한다.숫자 사이의 웨빙을 제거하기 위해 프로그램된 셀 데스가 필요합니다.
사지장은 특정 Hox 유전자, 동종 유전자의 서브셋 및 T박스 전사 인자의 발현에 의해 특정되는 영역이다. 즉, 앞다리 또는 날개 발달의 경우 Tbx5, 다리 또는 뒷다리 발달의 경우 Tbx4이다.앞다리장(뒷다리장이 아님)을 확립하려면 사지 싹이 [2][3]나오는 배아의 발달 중인 몸통에서 레티노산 신호가 필요하다.또한 레티노산 과잉은 Sh 또는 Meis1/Meis2 발현을 외부활성화함으로써 사지패터링을 변화시킬 수 있지만 레티노산 합성을 제거하는 생쥐의 유전자 연구에 따르면 [4]사지패터닝에 RA가 필요하지 않다.
사지 싹은 두 가지 신호 영역의 생성과 양성 피드백 유지를 자극하기 때문에 사지 발달의 많은 부분에서 활동적이다: AER와 중간엽 [5]세포와 함께 분극 활동 구역(ZPA)의 후속 생성.경쟁적인 Wnt7a 및 BMP 신호의 외배엽 발현에 의해 생성되는 배측축과 더불어 이들 AER 및 ZPA 시그널링 센터는 발달하는 [6][7]유기체에서 대응하는 축방향 극성과 정확히 배향되는 사지의 적절한 형성에 매우 중요하다.이러한 신호 시스템은 서로의 활동을 상호 유지하므로, 이러한 신호 영역이 확립된 후 [5]사지 발달은 근본적으로 자율적입니다.
사지 형성
사지의 꽃봉오리
사지의 형성은 형태발생적 사지장에서 시작된다.사지 형성은 외측판 중배엽의 중간조직과 외측배엽에서 파생된 상피세포 사이의 일련의 상호조직 상호작용에서 비롯된다.측판 중배엽과 미오톰에서 나온 세포는 사지장으로 이동해 위쪽 외배엽이 부풀어 올라 사지 싹을 형성할 정도로 증식한다.측판 세포는 사지의 연골과 골격 부분을 생성하는 반면 근막 세포는 근육 구성요소를 생성합니다.
측판 중배엽 세포는 섬유아세포 성장인자(FGF7 및 FGF10)를 분비하여, 외배엽이 사지 봉오리의 끝에 조직체를 형성하도록 유도하고, 이는 세포 발달을 촉진하고 세포사를 [8]조절합니다.AER는 FGF8과 FGF4의 추가적인 성장 인자를 분비하여 FGF10 신호를 [citation needed]유지하고 중배엽에서 증식을 유도합니다.FGF10 표현의 위치는 다음 2개의 Wnt 시그널링 패스에 의해 규제됩니다.뒷다리에는 Wnt8c, 앞다리에는 Wnt2b가 있습니다.앞다리와 뒷다리는 앞/뒤 축을 따른 위치 및 Tbx5와 Tbx4의 두 가지 전사 인자에 의해 각각 [9][10]특정된다.
사전 응축
사지의 골격 요소는 카틸라지 전 간엽 [11]세포의 세포 응축으로 알려진 타이트한 골재에 의해 미리 구성되어 있다.중간 축합은 세포외 매트릭스 및 세포접착 [12]분자에 의해 매개된다.연골생성 과정에서 연골세포는 응축과 분화되어 연골을 형성하고 골격 원시를 형성한다.대부분의 척추동물 사지의 발달에서 (일부 양서류는 아니지만) 연골 골격은 나중에 뼈로 대체된다.
사지 패턴의 주기성
사지는 세 가지 영역으로 구성되어 있습니다: 스타일포드, 조고포드, 그리고 오토포드(근위부부터 원위부 순서로).zeugopod와 autopod는 많은 주기적 및 준주기적 패턴 모티브를 포함한다.zeugopod는 전후 축을 따라 두 개의 병렬 요소로 구성되며, 자동 포드는 동일한 축을 따라 3-5개(대부분의 경우)의 요소를 포함합니다.자릿수는 또한 골격 요소의 탠덤 체인으로 구성된 근위축의 준주기적 배열이 있습니다.발육 중 기본 사지 계획의 생성은 사전 관절 응축을 촉진하는 요인과 이를 [13]억제하는 요인의 상호작용에 의한 간엽의 패턴 형성에서 비롯된다.
기본 사지 계획의 개발은 요소들 사이의 국소적인 차이 발생을 수반한다.예를 들어 앞다리의 요골과 척골, 뒷다리의 정강이뼈와 종아리뼈는 오토포드의 다른 손가락 또는 발가락과 마찬가지로 서로 구별된다.이러한 차이는 사지의 세 가지 주요 축 각각에 어떻게 반영되는지를 고려함으로써 도식적으로 처리될 수 있습니다.
일반적인 합의는 사지 골격의 패턴화는 하나 이상의 튜링형 반응-확산 메커니즘을 [1]수반한다는 것이다.
진화 및 개발
쌍지느러미에서 사지의 진화는 많은 [1]관심을 받아왔다.팔다리 발달에 관여하는 것으로 밝혀진 특정 유전자와 전사 인자를 해명하기 위한 많은 연구가 있었다(아래 표 1 참조).특히, 연구는 SH, DAH1, 그리고 BMP, HOX, T-box, FGF, 그리고 WNT 유전자 패밀리가 모두 성공적인 사지 발달과 [14][15]형성에 중요한 역할을 한다는 것을 보여주었다.뱀의 사지 발달과 (그리고 진화) 사지 감소와 사지 손실에 관련된 유전자를 연구하는 것은 상호 보완적인 [16]접근법이다.사지의 발달에 관여하는 보존 배열은 뱀의 게놈에 보존된다.팔뚝의 [16][17]팔다리와 같은 다른 형태의 부속물 사이에 특정한 팔뚝 강화 서열이 보존되기도 한다.예를 들어, 사지발달신호는 [16][17]생쥐의 사지발달과 생식기결절의 발달에 모두 역할을 한다.사지 감소와 사지 손실에 대한 연구는 사지 [16]발달을 조절하는 유전적 경로를 밝혀내고 있다.튜링 시스템은 네트워크 [1]패턴 생성의 진화 단계에서 많은 가능한 결과를 가능하게 했다.
| 표 1: 사지 발달을 담당하는 것으로 알려진 다양한 유전자(유전자족별로 구분) |
|---|
| Bmp2, Bmp4, Bmp7 |
| Dach1 |
| En1 |
| Fgf4, Fgf8, Fgf9, Fgf10, Fgf17, Fgfr1 |
| Gli3 |
| 그렘린 1 |
| 핸드 2 |
| Hoxa13, Hoxd13 |
| Msx1, Msx2 |
| 피트x1 |
| 쉿. |
| Tbx4, Tbx5 |
| Wnt3, Wnt5a |
표 1에 나열된 많은 유전자들은 배아 발달, 특히 골격 패턴 형성 및 사지 싹 [18]형성에서 중요한 역할을 한다.Shh 유전자와 BMP, Hox, T-box, FGF, Wnt 패밀리에 속하는 유전자는 모두 성공적인 사지 형성을 조절하고 촉진하기 위해 세포 신호 전달과 분화에 중추적인 역할을 합니다.Dach1을 예로 들며 위에 나열된 다양한 다른 유전자들은 유전자 발현을 조절하는 DNA 결합 단백질이다.유전자 발현, 조절, 활성화, 그리고 비활성화의 복잡한 조합은 이러한 유전자들이 배아 발달 동안 사지를 생산하도록 합니다.흥미롭게도, 이러한 유전자들 중 많은 것들이 뱀과 같이 팔다리가 없는 동물들에게도 여전히 존재한다.
뱀의 진화 및 사지 손실
사지 발달을 이해하는 데 있어 흥미로운 측면은 뱀이 어떻게 다리를 잃었는지에 대한 문제를 해결하는 것이다.뱀은 완전히 다리를 잃기 전에 진화 과정에서 여러 번 사지 상실과 재생을 겪었기 때문에 사지 상실을 연구하는 데 특히 좋은 예이다.배아발달 중 유전자 발현 대부분은 오른쪽 그림과 같이 시공간적 [20]및 화학적 신호를 통해 조절된다.최근의 증거는 사지 발달에 책임이 있는 고도로 보존된 유전자가 사지 없는 척추 [21]동물에 여전히 존재한다는 것을 암시하고 있으며, 이는 배아 발달 중에 사지의 생산 또는 부족이 유전자 조절에 의해 가장 잘 설명될 수 있음을 나타낸다.
뱀의 사지를 잃었을 때 Shhenhancer의 가능한 역할
한 이론은 강화제 배열의 열화가 뱀의 진화에서 점진적인 사지 손실에 기여했을 수도 있다는 것을 암시한다.특히, 많은 연구들이 소닉 헤지호그 유전자의 강화제인 ZRS에 초점을 맞추고 있다.이 장거리 인핸서는 여러 척추동물 종에서 적절한 사지 형성을 위해 필요하며, 이 순서의 돌연변이는 사지 [17]기형을 일으키는 것으로 알려져 있습니다.따라서 이 배열은 다양한 척추동물 종에 걸쳐 보존성이 높다.

여러 뱀 종에서 핵심 ZRS를 쥐와 도마뱀 시퀀스와 비교한 결과 뱀 고유의 [23]변화가 나타났다.핵심 ZRS는 보아 콘트롤러와 비단뱀과 같은 기초 뱀에서 주로 보존되는 것으로 입증되었으며, 이들은 여전히 골반 거들 [22]뼈를 포함하고 있다.반대로, 골격 사지 구조가 남아 있지 않은 독사나 코브라 같은 발달된 뱀은 쥐나 도마뱀 [22]ZRS에 비해 뉴클레오티드의 변화율이 훨씬 높다.뱀 ZRS의 이러한 누적적인 변화는 뱀의 [22]진화 전반에 걸쳐 이 증강제에서 점진적인 기능 상실을 나타내는 것으로 생각된다.

이러한 변화에 대한 추가 조사 결과, ZRS에 대한 결합이 Sh [24]전사를 활성화하는 것으로 나타난 ETS1과 같은 전사 인자에 대한 결합 부위의 치환율이 증가하였다.ZRS의 이러한 열화는 이 증강제가 뱀의 형태학적 진화를 촉진한 분자 메커니즘을 더 탐구하는 데 중요할 수 있다는 것을 암시한다.
현재의 결론과 제한
뱀은 일반적인 모델 유기체가 아니다. 즉, 그들은 유전적으로 다루기 쉽지 않다.게다가 그들의 게놈 배열 데이터는 불완전하고 주석과 품질이 좋지 않다.이러한 요소들은 유전자 및 조절 강화제의 존재와 활동을 대상으로 하고 관찰하는 유전적 접근법을 사용하여 뱀의 사지 손실 메커니즘을 이해하는 것을 어렵게 만든다.사지 형성에 필요한 많은 유전자들이 뱀에게 여전히 남아 있기 때문에, 사지 손실은 아마도 유전자 [citation needed]손실로 설명될 수 없을 것이다.
발달하는 사지는 대칭의 [25]세 축을 기준으로 정렬해야 합니다.이 축은 머리부터 꼬리까지(머리부터 꼬리까지), 도르소벤트랄(뒤에서 앞으로), 근위(근위부터 먼) [25]축입니다.
팔다리 골격 패턴의 발달에 대한 많은 [26]연구는 1971년 루이스 울퍼트에 의해 제안된 위치 정보 개념에 의해 영향을 받았다.이 생각에 따라 발달하는 사지의 직교 축을 가로지르는 확산 신호 분자(모르포겐)를 식별하고 골격 요소의 위치와 동일성을 농도에 의존하는 방식으로 결정하려는 노력이 이루어졌다.
근위부 패턴 형성
Hox 유전자는 문체동물, 동물동물 및 자동동물의 특정에 기여한다.Hox 유전자의 돌연변이는 근위부 손실이나 [27]이상을 초래한다.이들 지역의 패턴을 설명하기 위해 세 가지 다른 모델이 발전했다.
진행 영역 모델
정점 외배엽 융기(AER)는 진행 [28]구역으로 알려진 세포 증식 구역을 만들고 유지합니다.여기 세포들은 그들이 목적지로 [28]이동하는 데 필요한 위치 정보를 얻는 것으로 생각된다.셀이 진행 영역에 있는 시간에 의해 위치 값이 결정되었다고 제안되었지만, [28]이는 아직 증명되지 않았다(2001년 현재).근위부 구조는 구역을 떠난 첫 번째 세포와 나중에 [28]떠난 세포에 의해 형성될 것을 제안했다.
프로그레스 존 모델은 30년 전에 제안되었지만 최근의 [29]증거는 이 모델과 상충된다.
실험 근거:
- 개발 후기에 AER를 제거하면 개발 초기에 AER를 제거한 경우보다 원위 구조의 교란이 줄어듭니다.
- 초기 사지 봉오리 끝을 후기 날개에 이식하면 구조가 복제되는 반면, 후기 날개 봉오리 끝을 초기 사지에 이식하면 구조가 삭제됩니다.
초기 할당 및 전구체 확장 모델(또는 사전 지정 모델)
세포는 초기 사지 봉오리의 각 세그먼트에 대해 지정되며, 이 세포군은 사지 봉오리가 성장함에 따라 확장됩니다.이 모형은 다음 관측치와 일치합니다.세포 분열은 팔다리 싹 전체에 나타난다.세포사멸은 제거될 때 AER에 인접한 200μm 구역 내에서 발생하며, 세포사멸은 일부 패턴화를 예고한다.FGF 방출 비즈는 이러한 세포 사멸을 방지하여 AER를 제거했을 때 사지 발달을 구할 수 있습니다.
실험 근거:
- 초기 사지 싹의 다른 위치에 있는 라벨이 붙은 세포는 [30]사지의 단일 세그먼트로 제한되었다.
- 필요한 FGF4와 FGF8의 표현이 결여된 팔다리는 [31]근위부뿐만 아니라 사지의 모든 구조를 보여주었다.
그러나 최근에는 진행 영역과 사전특정 모델 모두를 주로 담당하는 조사자들이 이들 모델 중 어느 것도 이용 가능한 실험 [29]데이터를 적절히 설명하지 못한다는 것을 인정했다.
튜링형 반응 확산 모형
1979년에 [32]처음 제안된 반응 확산 모델인 이 모델은 1952년 [33]앨런 튜링에 의해 기술된 흥분성 매체의 자기 조직화 특성에 기초한다.흥분성 매체는 사지 봉오리의 중간 조직으로 세포가 변환 성장인자 베타(TGF-β) 및 섬유아세포 성장인자(FGF)와 노치 신호 전달을 포함하는 억제 신호 경로와 같은 양의 자기 조절 형태소에 의해 상호작용한다.근위 및 두개 청각 축은 독립적으로 지정된 것으로 간주되지 않고, 대신 성장 중인 사지 봉오리의 구별되지 않은 원단부가 재형성을 [34]거치면서 평행 요소 수의 변화에 의해 나타난다.이 모델은 "맨 뼈" 패턴만 지정합니다.다른 모델의 주요 정보 분자인 소닉 헤지호그(Shh)와 Hox 단백질과 같은 다른 요소들이 미세 조정 역할을 하도록 제안되었다.
실험 근거:
- 사지 간엽 세포는 분리되고 배양에서 성장하거나 외배엽 "허" 내에 재도입될 때 패턴 형성, 형태 형성 및 [35][36]분화의 필수적인 측면을 반복할 수 있습니다.
- 마우스 더블풋 돌연변이에서의 사지 골격 패턴의 특이성은 튜링형 [37]메커니즘의 예측 결과이다.
- Gli3-null 배경에서 원위 Hox 유전자의 점진적인 감소는 점차적으로 더 심각한 다지증을 초래하고, 더 얇고 촘촘하게 채워진 자릿수를 표시하며, 원위 Hox 유전자의 선량이 [38]튜링형 메커니즘에 의해 지정된 자릿수의 주기 또는 파장을 조절한다는 것을 암시한다.
두개관절 패턴화
1957년 팔다리 싹의 편광 활동 구역(ZPA)의 발견은 소닉 고슴도치의 형태 유발 구배(Shh)[39]의 작용에 의한 패턴 형성 활동을 이해하기 위한 모델을 제공했다.쉿은 사지에 특화된 강화제로 [40]알려져 있다.Shh는 ZPA를 생성하고 원위 사지에 두개음 패턴을 지정하는 데 충분하며 필요합니다(스타일 포드의 극성에는 Shh가 필요하지 않습니다).Hoxd 유전자의 초기 발현, Hoxb8의 발현, dHAND의 발현을 통해 후방에 Shh가 켜집니다.Shh는 ZPA와 AER 사이의 피드백 루프를 통해 후방으로 유지됩니다.Shh는 AER가 Sh의 발현을 유지하는 FGF4 및 FGF8을 생성하도록 유도합니다.
숫자 3, 4, 5는 시간적 구배인 Shh로 지정됩니다.디지트 2는 장거리 확산형식의 Sh로 지정되며 디지트1은 Sh를 필요로 하지 않습니다.Shh는 Ci/Gli3 전사억제기 복합체를 분해하여 전사인자 Gli3를 두개내를 따라 HoxD 유전자의 전사를 활성화하는 활성제로 변환한다.Gli3 억제기가 상실되면 [41]추가 수량으로 일반(비개별화) 자릿수가 형성됩니다.
도르소벤트랄 패턴닝
도르소벤트럴 패턴닝은 중배엽이 아닌 외배엽의 Wnt7a 신호에 의해 매개된다.Wnt7a는 사지의 등쪽에 필요한 동시에 충분합니다.또한 Wnt7a는 두개골에 영향을 미치며 Wnt7a의 상실은 팔다리의 등쪽을 복측으로 만들고 뒷자리를 잃게 한다.Wnt7a 신호를 교체하면 이 결함이 해결됩니다.Wnt7a는 또한 Shh의 발현을 유지하기 위해 필요합니다.
Wnt-7a는 또한 림 홈박스 유전자(따라서 전사 인자)인 Lmx-1을 발현시킨다.Lmx-1은 사지의 등쪽화에 관여하며,[42] 이는 생쥐의 Lmx-1 유전자를 녹아웃함으로써 나타났다.Lmx-1이 없는 쥐들은 발 양쪽에서 복부 피부를 만들어냈다.DV패턴을 제어하는 것으로 생각되는 다른 요소들이 있다; Engrailed-1은 팔다리의 [43]복측에서 Wnt-7a의 등위화 효과를 억제한다.
「 」를 참조해 주세요.
레퍼런스
- ^ a b c d Stewart, TA; Bhat, R; Newman, SA (2017). "The evolutionary origin of digit patterning". EvoDevo. 8: 21. doi:10.1186/s13227-017-0084-8. PMC 5697439. PMID 29201343.
- ^ Stratford T, Horton C, Maden M (1996). "Retinoic acid is required for the initiation of outgrowth in the chick limb bud". Curr Biol. 6 (9): 1124–33. doi:10.1016/S0960-9822(02)70679-9. PMID 8805369. S2CID 14662908.
- ^ Zhao X, Sirbu IO, Mic FA, et al. (June 2009). "Retinoic acid promotes limb induction through effects on body axis extension but is unnecessary for limb patterning". Curr. Biol. 19 (12): 1050–7. doi:10.1016/j.cub.2009.04.059. PMC 2701469. PMID 19464179.
- ^ Cunningham, T.J.; Duester, G. (2015). "Mechanisms of retinoic acid signalling and its roles in organ and limb development". Nat. Rev. Mol. Cell Biol. 16 (2): 110–123. doi:10.1038/nrm3932. PMC 4636111. PMID 25560970.
- ^ a b Tickle, C (October 2015). "How the embryo makes a limb: determination, polarity and identity". Journal of Anatomy. 227 (4): 418–30. doi:10.1111/joa.12361. PMC 4580101. PMID 26249743.
- ^ Parr, BA; McMahon, AP (23 March 1995). "Dorsalizing signal Wnt-7a required for normal polarity of D-V and A-P axes of mouse limb". Nature. 374 (6520): 350–3. Bibcode:1995Natur.374..350P. doi:10.1038/374350a0. PMID 7885472. S2CID 4254409.
- ^ Pizette, S; Abate-Shen, C; Niswander, L (November 2001). "BMP controls proximodistal outgrowth, via induction of the apical ectodermal ridge, and dorsoventral patterning in the vertebrate limb". Development. 128 (22): 4463–74. doi:10.1242/dev.128.22.4463. PMID 11714672.
- ^ Yonei-Tamura S, Endo T, Yajima H, Ohuchi H, Ide H, Tamura K (1999). "FGF7 and FGF10 directly induce the apical ectodermal ridge in chick embryos". Dev. Biol. 211 (1): 133–43. doi:10.1006/dbio.1999.9290. PMID 10373311.
- ^ Ohuchi H, Takeuchi J, Yoshioka H, Ishimaru Y, Ogura K, Takahashi N, Ogura T, Noji S (1998). "Correlation of wing-leg identity in ectopic FGF-induced chimeric limbs with the differential expression of chick Tbx5 and Tbx4". Development. 125 (1): 51–60. doi:10.1242/dev.125.1.51. PMID 9389663.
- ^ Rodriguez-Esteban C, Tsukui T, Yonei S, Magallon J, Tamura K, Izpisua Belmonte JC (1999). "The T-box genes Tbx4 and Tbx5 regulate limb outgrowth and identity". Nature. 398 (6730): 814–8. Bibcode:1999Natur.398..814R. doi:10.1038/19769. PMID 10235264. S2CID 4330287.
- ^ DeLise, AM; Fischer, L; Tuan, RS (September 2000). "Cellular interactions and signaling in cartilage development". Osteoarthritis and Cartilage. 8 (5): 309–34. doi:10.1053/joca.1999.0306. PMID 10966838.
- ^ Hall BK, Miyake T (2000). "All for one and one for all: condensations and the initiation of skeletal development". BioEssays. 22 (2): 138–47. doi:10.1002/(SICI)1521-1878(200002)22:2<138::AID-BIES5>3.0.CO;2-4. PMID 10655033.
- ^ Newman SA, Bhat R (2007). "Activator-inhibitor dynamics of vertebrate limb pattern formation". Birth Defects Research Part C: Embryo Today: Reviews. 81 (4): 305–19. CiteSeerX 10.1.1.128.3260. doi:10.1002/bdrc.20112. PMID 18228262.
- ^ Leal, Francisca; Cohn, Martin J. (2016-11-07). "Loss and Re-emergence of Legs in Snakes by Modular Evolution of Sonic hedgehog and HOXD Enhancers". Current Biology. 26 (21): 2966–2973. doi:10.1016/j.cub.2016.09.020. ISSN 0960-9822. PMID 27773569. S2CID 4495482.
- ^ Cohn, Martin J. (2008-10-07), Cardew, Gail; Goode, Jamie A. (eds.), "Developmental Mechanisms of Vertebrate Limb Evolution", Novartis Foundation Symposium, Novartis Foundation Symposia, Chichester, UK: John Wiley & Sons, Ltd, 232: 47–62, doi:10.1002/0470846658.ch5, ISBN 978-0-471-49433-1, PMID 11277086
- ^ a b c d Infante, CR; Rasys, AM; Menke, DB (January 2018). "Appendages and gene regulatory networks: Lessons from the limbless". Genesis. 56 (1): e23078. doi:10.1002/dvg.23078. PMC 5783778. PMID 29076617.
- ^ a b c Leal F, Cohn MJ (2016). "Loss and Re-emergence of Legs in Snakes by Modular Evolution of Sonic hedgehog and HOXD Enhancers". Curr Biol. 26 (21): 2966–2973. doi:10.1016/j.cub.2016.09.020. PMID 27773569. S2CID 4495482.
- ^ Tickle, Cheryll; Towers, Matthew (2017). "Sonic Hedgehog Signaling in Limb Development". Frontiers in Cell and Developmental Biology. 5: 14. doi:10.3389/fcell.2017.00014. ISSN 2296-634X. PMC 5328949. PMID 28293554.
- ^ Harfe, Brian D.; Scherz, Paul J.; Nissim, Sahar; Tian, Hua; McMahon, Andrew P.; Tabin, Clifford J. (2004-08-20). "Evidence for an Expansion-Based Temporal Shh Gradient in Specifying Vertebrate Digit Identities". Cell. 118 (4): 517–528. doi:10.1016/j.cell.2004.07.024. ISSN 0092-8674. PMID 15315763. S2CID 16280983.
- ^ Harfe, Brian D.; Scherz, Paul J.; Nissim, Sahar; Tian, Hua; McMahon, Andrew P.; Tabin, Clifford J. (2004-08-20). "Evidence for an Expansion-Based Temporal Shh Gradient in Specifying Vertebrate Digit Identities". Cell. 118 (4): 517–528. doi:10.1016/j.cell.2004.07.024. ISSN 0092-8674. PMID 15315763. S2CID 16280983.
- ^ Kvon, Evgeny Z.; Kamneva, Olga K.; Melo, Uirá S.; Barozzi, Iros; Osterwalder, Marco; Mannion, Brandon J.; Tissières, Virginie; Pickle, Catherine S.; Plajzer-Frick, Ingrid; Lee, Elizabeth A.; Kato, Momoe (2016-10-20). "Progressive Loss of Function in a Limb Enhancer during Snake Evolution". Cell. 167 (3): 633–642.e11. doi:10.1016/j.cell.2016.09.028. ISSN 0092-8674. PMC 5484524. PMID 27768887.
- ^ a b c d e Kvon EZ, Kamneva OK, Melo US, Barozzi I, Osterwalder M, Mannion BJ, et al. (2016). "Progressive Loss of Function in a Limb Enhancer during Snake Evolution". Cell. 167 (3): 633–642.e11. doi:10.1016/j.cell.2016.09.028. PMC 5484524. PMID 27768887.
- ^ Burgess DJ (2016). "Development: Sonic snakes and regulation of limb formation". Nat Rev Genet. 17 (12): 715. doi:10.1038/nrg.2016.149. PMID 27843141. S2CID 28930888.
- ^ Xu C, Yang X, Zhou H, Li Y, Xing C, Zhou T, et al. (2020). "A novel ZRS variant causes preaxial polydactyly type I by increased sonic hedgehog expression in the developing limb bud". Genet Med. 22 (1): 189–198. doi:10.1038/s41436-019-0626-7. PMC 6944640. PMID 31395945.
- ^ a b Larsen, William (2001). Human embryology (3rd ed.). Philadelphia, Pa.: Churchill Livingstone. p. 335. ISBN 978-0-443-06583-5.
- ^ Wolpert L (1971). Positional information and pattern formation. Curr Top Dev Biol. Current Topics in Developmental Biology. Vol. 6. pp. 183–224. doi:10.1016/S0070-2153(08)60641-9. ISBN 9780121531065. PMID 4950136.
- ^ Wellik D, Capecchi M (2003). "Hox10 and Hox11 genes are required to globally pattern the mammalian skeleton". Science. 301 (5631): 363–7. Bibcode:2003Sci...301..363W. doi:10.1126/science.1085672. PMID 12869760. S2CID 9751891.
- ^ a b c d Larsen, William (2001). Human embryology (3rd ed.). Philadelphia, Pa.: Churchill Livingstone. p. 337. ISBN 978-0-443-06583-5.
- ^ a b Tabin C, Wolpert L (2007). "Rethinking the proximodistal axis of the vertebrate limb in the molecular era". Genes Dev. 21 (12): 1433–42. doi:10.1101/gad.1547407. PMID 17575045.
- ^ Dudley A, Ros M, Tabin C (2002). "A re-examination of proximodistal patterning during vertebrate limb development". Nature. 418 (6897): 539–44. Bibcode:2002Natur.418..539D. doi:10.1038/nature00945. PMID 12152081. S2CID 1357061.
- ^ Sun X, Mariani F, Martin G (2002). "Functions of FGF signalling from the apical ectodermal ridge in limb development". Nature. 418 (6897): 501–8. Bibcode:2002Natur.418..501S. doi:10.1038/nature00902. PMID 12152071. S2CID 4409248.
- ^ Newman SA, Frisch HL (1979). "Dynamics of skeletal pattern formation in developing chick limb". Science. 205 (4407): 662–668. Bibcode:1979Sci...205..662N. doi:10.1126/science.462174. PMID 462174.
- ^ Turing, AM (1952). "The Chemical Basis of Morphogenesis". Philosophical Transactions of the Royal Society B. 237 (641): 37–72. Bibcode:1952RSPTB.237...37T. doi:10.1098/rstb.1952.0012.
- ^ Zhu J, Zhang YT, Alber MS, Newman SA (2010). "Bare bones pattern formation: a core regulatory network in varying geometries reproduces major features of vertebrate limb development and evolution". PLOS ONE. 5 (5): e:10892. Bibcode:2010PLoSO...510892Z. doi:10.1371/journal.pone.0010892. PMC 2878345. PMID 20531940.
- ^ Moftah MZ, Downie SA, Bronstein NB, Mezentseva N, Pu J, Maher PA, Newman SA (2002). "Ectodermal FGFs induce perinodular inhibition of limb chondrogenesis in vitro and in vivo via FGF receptor 2". Dev. Biol. 249 (2): 270–82. doi:10.1006/dbio.2002.0766. PMID 12221006.
- ^ Ros MA, Lyons GE, Mackem S, Fallon JF (1994). "Recombinant limbs as a model to study homeobox gene regulation during limb development". Dev. Biol. 166 (1): 59–72. doi:10.1006/dbio.1994.1296. PMID 7958460.
- ^ Miura T, Shiota K, Morriss-Kay G, Maini PK (2006). "Mixed-mode pattern in Doublefoot mutant mouse limb−Turing reaction-diffusion model on a growing domain during limb development". J Theor Biol. 240 (4): 562–73. Bibcode:2006JThBi.240..562M. doi:10.1016/j.jtbi.2005.10.016. PMID 16364368.
- ^ Sheth R, Marcon L, Bastida MF, Junco M, Quintana L, Dahn R, Kmita M, Sharpe J, Ros MA (2012). "Hox genes regulate digit patterning by controlling the wavelength of a Turing-type mechanism". Science. 338 (6113): 1476–1480. Bibcode:2012Sci...338.1476S. doi:10.1126/science.1226804. PMC 4486416. PMID 23239739.
- ^ Zhu, J; Mackem, S (15 September 2017). "John Saunders' ZPA, Sonic hedgehog and digit identity - How does it really all work?". Developmental Biology. 429 (2): 391–400. doi:10.1016/j.ydbio.2017.02.001. PMC 5540801. PMID 28161524.
- ^ Leal F, Cohn MJ (January 2018). "Developmental, genetic, and genomic insights into the evolutionary loss of limbs in snakes". Genesis. 56 (1): e23077. doi:10.1002/dvg.23077. PMID 29095557. S2CID 4510082.
- ^ Chiang C, Litingtung Y, Harris M, Simandl B, Li Y, Beachy P, Fallon J (2001). "Manifestation of the limb prepattern: limb development in the absence of sonic hedgehog function". Dev Biol. 236 (2): 421–35. doi:10.1006/dbio.2001.0346. PMID 11476582.
- ^ Riddle RD, Ensini M, Nelson C, Tsuchida T, Jessell TM, Tabin C (1995). "'Induction of the LIM homeobox gene Lmx1 by WNT7a establishes dorsoventral pattern in the vertebrate limb". Cell. 83 (2): 631–40. doi:10.1016/0092-8674(95)90103-5. PMID 7585966. S2CID 16272219.
- ^ Johnson RL, Tabin CJ (September 19, 1997). "Molecular Models for Vertebrate Limb Development". Cell. 90 (6): 979–990. doi:10.1016/S0092-8674(00)80364-5. PMID 9323126.





