식물개발
Plant development식물 발달에 있어 중요한 구조는 꽃봉오리, 새싹, 뿌리, 잎 그리고 꽃이다; 식물은 장기의 끝에 위치한 메리스템[1] 또는 성숙한 조직 사이에서 일생 동안 이러한 조직과 구조를 생산한다. 그러므로 살아있는 식물은 항상 배아 조직을 가지고 있다. 이와는 대조적으로, 동물 배아는 일생 동안 가질 모든 신체 부위를 매우 일찍 생산하게 될 것이다. 동물이 태어날 때(혹은 알에서 부화한다)에는 몸의 모든 부분이 있고 그 때부터 몸집이 커지고 성숙해질 뿐이다. 그러나 식물과 동물 모두 독립적으로[2] 진화하여 형태학적 다양화를 제한하는 발달적 제약을 초래하는 계통형 단계를 거친다.[3][4][5][6]
식물 생리학자 A에 따르면. 칼 레오폴드, 식물에서 볼 수 있는 조직의 성질은 개별 부분의 합보다 더 많은 새로운 성질이다. "이러한 조직과 기능을 통합된 다세포 유기체로 결합하면 분리된 부품과 프로세스의 특성뿐만 아니라, 개별 부품에 대한 검사에 기초해 예측할[by whom?] 수 없었을 상당히 새로운 특성 집합을 산출하게 된다."[7]
성장
혈관 식물은 정자 세포에 의한 난자 세포의 수정으로 형성된 단세포의 지고테로부터 시작된다. 그 시점부터 발생의 과정을 통해 식물 배아를 형성하기 위해 분열되기 시작한다. 이렇게 되면 결과 세포들은 한쪽 끝이 첫 번째 뿌리가 되고 다른 쪽 끝은 촬영의 끝을 형성하도록 조직될 것이다. 씨앗 식물에서, 배아는 하나 이상의 "씨드 잎"(코틸돈)을 개발할 것이다. 발생이 끝날 때쯤이면 이 어린 식물은 삶에서 시작하는 데 필요한 모든 부분을 갖게 될 것이다.
일단 배아는 씨앗이나 모식물에서 발아하면 유기생성 과정을 통해 추가 장기(잎, 줄기, 뿌리)를 생산하기 시작한다. 뿌리의 끝에 위치한 뿌리 메리스템에서 새로운 뿌리가 자라고, 촬영 끝에 위치한 새 줄기와 잎사귀에서 새 줄기와 잎이 자란다.[8] 가지치기란 메리스템이 남긴 세포의 작은 덩어리가 세포 분화를 거치지 않아 전문화된 조직을 형성하지 못한 상태에서 새로운 뿌리의 끝이나 총살로 자라기 시작할 때 발생한다. 뿌리나 총의 끝에 있는 어떤 메리스템에서 나오는 성장은 일차 성장이라고 불리며, 그 뿌리나 총의 길이가 길어지게 된다. 이차적 성장은 뿌리가 넓어지거나 캠비움의 세포 분열에서 발사되는 결과를 낳는다.[9]
세포분열에 의한 성장 외에도, 식물은 세포연장을 통해 자랄 수 있다. 이는 개별 세포나 세포군이 더 길어질 때 발생한다. 모든 식물 세포가 같은 길이로 자라는 것은 아니다. 줄기 한쪽의 세포가 다른 쪽의 세포보다 더 길고 빠르게 자랄 때, 줄기는 그 결과 천천히 자라는 세포의 옆으로 구부러진다. 이러한 방향성 성장은 빛(광전자파), 중력(중력파), 물(수력파), 신체 접촉(지명파)과 같은 특정 자극에 대한 식물의 반응을 통해 발생할 수 있다.
식물 성장과 발육은 특정 식물 호르몬과 식물 성장 규제 기관(PGRs)에 의해 매개된다([10]Ros et al. 1983). 내생성 호르몬 수준은 식물 나이, 냉간성, 숙면성 및 기타 대사 조건, 광선 기간, 가뭄, 온도 및 기타 외부 환경 조건, 그리고 PGR의 외생적 공급원(예: 외부적으로 적용됨 및 발광성 발원)에 의해 영향을 받는다.
성장 중의 형태학적 변화
식물은 형태와 구조에서 자연적인 변화를 보인다. 모든 유기체는 개인마다 다르지만, 식물은 추가적인 형태의 변이를 보인다. 한 개인 내에서, 다른 유사한 부분들과 형태와 구조가 다를 수 있는 부분이 반복된다. 줄기나 꽃과 같은 다른 장기들도 비슷한 변화를 보일 수 있지만, 이러한 변화는 식물의 잎에서 가장 쉽게 나타난다. 이러한 변동의 주된 원인은 위치효과, 환경효과, 그리고 후숙성의 세 가지가 있다.
장기가 생산되는 상대적 위치에서 비롯되는 성숙한 식물의 부분들 사이에는 변화가 있다. 예를 들어, 새 가지를 따라 잎은 가지를 따라 일정한 패턴으로 변할 수 있다. 가지 밑부분 근처에서 생산되는 잎의 형태는 식물의 끝에서 생산되는 잎과 다르며, 이러한 차이는 주어진 식물의 가지마다, 그리고 주어진 종마다 일치한다.
새로운 구조물이 생산될 때 성숙하는 방법은 발전하기 시작할 때 식물 생물의 점뿐만 아니라 구조물이 노출되는 환경에도 영향을 받을 수 있다. 온도는 식물의 크기와 상태, 노출 온도와 지속시간 등 다양한 요인에 따라 식물에 미치는 영향이 다양하다. 식물이 작고 다육할수록 너무 높거나 낮은 기온으로 인한 손상이나 사망에 대한 민감도가 높아진다. 온도는 생화학적, 생리적 공정의 속도에 영향을 미치며, 온도에 따라 일반적으로 (한계 이내) 증가하는 속도에 영향을 미친다.
후천성 또는 이단성형이란 모종과 같이 어린 식물이 생산한 장기와 조직이 나이가 들었을 때 같은 식물이 생산하는 장기와 다른 경우가 많은 것을 말한다. 예를 들어, 어린 나무들은 그들이 다 자란 나무로서 생산할 나뭇가지보다 위로 더 길게, 더 가늘게 자라는 가지를 만들어 낼 것이다. 또 초기 성장기에 생산되는 잎은 성인식물의 잎보다 크고 얇으며 불규칙한 경향이 있다. 청소년 식물의 표본은 같은 종의 성인 식물과 매우 다르게 보일 수 있기 때문에 알을 낳는 곤충은 식물을 새끼의 먹이로 인식하지 못한다. 초기 성장 형태에서 후기로의 전환을 '식물 단계 변화'라고 부르지만, 용어에 대해서는 다소 이견이 있다.[11]
재림건축물
특이한 장소에서 발달한 뿌리, 싹, 새싹을 포함한 식물 구조를 어드벤처드라고 부른다. 그러한 구조는 혈관 식물에서 흔히 볼 수 있다.
돌발적인 뿌리와 싹은 대개 기존의 혈관 조직 근처에서 발달하여 자일름과 혈관에 연결할 수 있다. 그러나 정확한 위치는 크게 다르다. 어린 줄기에서, 돌발적인 뿌리는 종종 혈관 뭉치 사이의 실질마로부터 형성된다. 2차 성장과 함께 줄기에서, 돌발적인 뿌리는 종종 혈관 캠비움 근처의 골반 실질마에서 유래한다. 줄기 절단에서, 때론, 자연발생적인 뿌리는 잘린 표면에서 형성되는 굳은살 세포에서 유래하기도 한다. 크라술라의 잎자루는 표피에 부수적인 뿌리를 형성한다.[12]
싹과 새싹
재림봉오리는 1차 성장기에 그곳에 남아 있는 잎 축사에서 줄기 끝이나 촬영 노드에서 발생하는 총상봉오리가 아닌 다른 곳에서 발달한다. 그것들은 뿌리나 잎, 또는 새싹에서 새로운 성장으로 발전할 수 있다. 발사용 메리스템은 각 노드에서 하나 이상의 축 또는 측면 봉오리를 생성한다. 줄기가 상당한 2차 성장을 할 때, 축사봉오리는 파괴될 수 있다. 그리고 나서 싹은 2차 성장과 함께 줄기에 생길 수 있다.
싹은 종종 줄기가 다치거나 가지치기된 후에 형성된다. 싹이 트는 것은 잃어버린 가지를 대체하는 데 도움이 된다. 또한 주변의 나무들이 잘려져 그늘진 줄기가 밝은 햇빛에 노출되면 성숙한 나무 줄기에 싹과 새싹이 생길 수 있다. 삼나무(Sequoia sempervirens) 나무는 종종 그들의 아랫줄기에 많은 돌발적인 싹이 생긴다. 만약 주 트렁크가 죽으면, 새로운 트렁크는 종종 우연히 생겨나는 꽃봉오리 중 하나에서 나온다. 작은 삼나무 줄기 조각들은 삼나무 버리라고 불리는 기념품으로 팔린다. 그것들은 물받이에 놓이고, 우연히 싹이 돋아나 새싹이 돋아난다.
어떤 식물들은 보통 그들의 뿌리에 싹이 돋아나는데, 이것은 식물에서 꽤 멀리까지 뻗어나갈 수 있다. 뿌리에 싹이 돋아나는 새싹을 빨갱이라고 부른다. 그것들은 많은 종의 자연적인 식물 번식의 한 유형이다. 예를 들어, 많은 풀, 사시나무 떨기, 캐나다 엉겅퀴 등이 그것이다. 판도를 뒤흔드는 열망은 하나의 뿌리 시스템에 우연히 싹을 틔워 하나의 줄기에서 47,000개의 줄기로 성장했다.
어떤 잎들은 돌발적인 싹이 생기는데, 이것은 식물 번식의 일부로서 즉흥적인 뿌리를 형성한다. 예를 들어 피기백 식물(Tolmiea menziesii)과 수천 마리의 어미(Kalanchoe digremontiana)와 같은 것이다. 그 다음, 어드밴티지한 식물들은 모공장을 버리고 어미의 개별적인 복제식물로 개발된다.
코피싱은 새싹의 빠른 성장을 촉진하기 위해 나무 줄기를 땅으로 자르는 관행이다. 전통적으로 장대, 울타리 재료 또는 땔감을 생산하는데 사용된다. 포플러나 버드나무 등 연료용으로 재배하는 바이오매스 작물에도 행해진다.
뿌리
돌발적인 뿌리 뽑기는 저산소증이나[13] 영양소 결핍과 같은 입력에 의해 움직이는 일부 종에 대한 스트레스 회피 적응증일 수 있다. 자연적으로 중요한 또 다른 자연발생적 뿌리 뽑기의 중요한 기능은 살릭스나 세쿼이아 같은 나무 종을 익사적으로 번식시키는 것이다.[14]
식물 줄기의 능력은 절토에 의한 상업적 전파에 이용된다. 즉흥적 뿌리뽑기 이면의 생리학적 메커니즘을 이해함으로써 합성 보조제를 뿌리는 가루로 적용하고 선택적 기저부상을 사용함으로써 절단작업의 뿌리를 개선하는 데 어느 정도 진전이 있을 수 있었다.[15] 상업적 전파에 다른 규제 메커니즘에 대한 연구를 적용하고 '뿌리가 단단하다' 대 '뿌리가 쉽다' 종에 대한 우발적 뿌리의 분자 및 생태생리학적 제어의 비교 분석을 통해 향후 몇 년 동안 더 많은 진전이 이루어질 수 있다.
사람들이 베기, 층화, 조직 배양 등을 통해 식물을 번식시킬 때, 비옥한 뿌리와 싹은 매우 중요하다. 식물 호르몬인 보조제(Auxins)는 흔히 줄기, 총살 또는 잎자루에 적용되어 아프리카 바이올렛과 세덤 잎과 포인세티아와 콜루스의 새싹과 같은 우연한 뿌리 형성을 촉진한다. 뿌리 절단을 통한 전파는 예를 들어 고추냉이와 사과와 같은 돌발적인 싹 형성이 필요하다. 계층화에서, 새로운 식물을 만들기 위해 줄기 부분을 제거하기 전에 공중 줄기에 우발적인 뿌리가 형성된다. 대형 화초는 공기 층화에 의해 전파되는 경우가 많다. 싹트는 뿌리와 싹은 식물의 조직 배양에서 발달해야 한다.
수정된 양식
- 덩이뿌리는 확실한 모양이 없다. 예: 고구마.
- 파시컬레이션된 뿌리(투과성 뿌리)는 줄기의 밑부분에 있는 군집에서 발생한다. 예: 아스파라거스, 달리아.
- 노들로스 뿌리는 끝부분 근처에서 부풀어 오른다. 예: 강황색.
- 길쭉한 뿌리는 줄기의 처음 몇 개의 마디에서 생긴다. 이것들은 비스듬히 흙 속으로 스며들어 식물을 지탱해 준다. 예를 들면 옥수수, 사탕수수.
- 받침 뿌리는 공중 가지를 기계적으로 지탱해 준다. 측면의 가지들은 수직으로 아래쪽으로 흙 속으로 자라나 기둥 역할을 한다. 예: 반얀.
- 노드에서 발생하는 클라이밍 뿌리는 어떤 지지대에 스스로를 부착하고 그 위로 기어오른다. 예를 들면 머니 플랜트.
- 단일형 또는 비늘 뿌리 살찐 뿌리는 비늘 모양(예: 쓴 박, 포툴라카, 일부 풀)을 낸다.
잎 개발
아라비도시스 탈리아나의 잎 모양 발달의 유전학은 세 단계로 나누어진다. 잎사귀의 시작, 등축성의 확립, 한계적 메리템의 개발. 리프 프리모듐은 I KNOX 계열의 유전자와 단백질의 억제에 의해 시작된다(SHOT APICAL MERISTEMREEST 등). 이 등급 I KNOX 단백질은 잎 프리모듐에서 지브렐린 생합성을 직접 억제한다. 많은 유전인자가 잎사귀 영장류에서 이러한 유전자의 억제에 관여하고 있는 것으로 밝혀졌다(YASHYTY LEPS1, BLADE-ON-PETIOL1, SOWTOT1 등). 따라서 이러한 억제와 함께 지브렐린 수치가 증가하고 잎 프라이모륨이 성장을 시작한다.
꽃발달
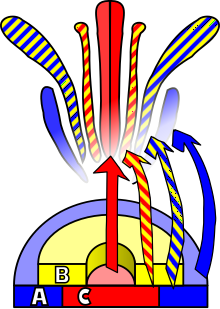
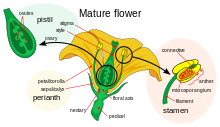
꽃발달은 혈관신경이 성 번식을 지향하는 기관인 꽃의 출현으로 이어지는 메리스템에서 유전자 발현 패턴을 만들어 내는 과정이다. 이러한 일이 일어나기 위해서는 세 가지 생리적 발달이 일어나야 한다: 첫째, 식물은 성적 미성숙에서 성적으로 성숙한 상태로 전달되어야 한다(즉, 꽃을 피우는 방향으로의 전환). 둘째, 식물성 메리스템에서 식물성 메리스템 또는 꽃무늬 메리스템으로의 아피셜 메리스템의 기능 전환, 그리고 fi.nally 꽃의 개별 장기의 성장 후기는 분자와 발달 유전학의 관점에서 프로세스의 생물학적 기초를 설명하는 ABC 모델을 사용하여 모델링되었다.
메리템의 분화를 꽃 메리템으로 유도하기 위해서는 외부 자극이 필요하다. 이 자극은 특히 새로운 영장류가 형성되는 메리스템의 측면에서 유사 세포 분열을 활성화시킬 것이다. 이와 같은 자극은 또한 메리스템이 식물성 메리스템과 반대로 꽃무늬 메리스템의 성장을 이끄는 발달 패턴을 따르도록 할 것이다. 이 두 가지 유형의 메리템은 목표 기관 사이의 명백한 차이와는 별개로, 진균(또는 황갈색) 식물성, 즉 연성( stem性)의 연성( stem性)이 프리모듐의 연성( stem性)은 연성( of性)의 부재에 있다. 이 진달래들은 아크로페탈의 발달에 따라 세팔, 꽃잎, 더듬이, 카펠을 낳는다. 식물성 도축체 메리스템과의 또 다른 차이점은 꽃무늬 메리스템이 결정되었다는 점인데, 이는 한 번 분화하면 세포가 더 이상 분열되지 않는다는 것을 의미한다.[16]
네 가지 꽃무늬 진균에 존재하는 장기의 정체는 각각 뚜렷한 기능을 가진 적어도 세 가지 유형의 유전자 생산물의 상호작용의 결과물이다. ABC 모델에 따르면, 각각 페리안의 verticil과 생식 verticil의 정체성을 결정하기 위해서는 함수 A와 C가 필요하다. 이러한 기능들은 배타적이며, 그 중 하나가 없는 것은 다른 것이 모든 꽃무늬 진화의 정체를 결정한다는 것을 의미한다. B 기능은 제2차 버티실(Sepal)에서 꽃잎과 꽃잎을 구별할 수 있으며, 3차 버티실(Carpel)의 카펠(Carpel)에서 스탬프를 구별할 수 있다.
꽃향기
식물은 꽃 모양, 꽃, 향기를 이용하여 수분작용을 위해 다른 곤충을 유인한다. 방출된 향 안에 있는 특정 화합물은 특정 꽃가루 매개체에 호소한다. 페투니아 히브리다에서는 휘발성 벤제노이드들이 생산되어 꽃향기를 발산한다. 벤제노이드 생합성 경로의 구성 요소는 알려져 있지만, 경로 내의 효소와 그 효소의 후속 조절은 아직 발견되지 않았다.[17]
경로 규제를 결정하기 위해 P. hybrida Mitchell 꽃은 꽃잎 특유의 미세배열에 사용되어 향기를 막 생산하려던 꽃을 휘발성 벤제노이드를 거의 생산하지 않는 P. hybrida cultivar W138 꽃과 비교했다. 두 식물의 유전자의 cDNA가 배열되었다. 그 결과는 미첼 꽃에 조절된 전사 인자가 있다는 것을 증명했지만, 꽃 향기가 부족한 W138 꽃에는 없다는 것을 보여주었다. 이 유전자의 이름은 ODORANT1(ODORANT1)이다. 하루 종일 ODO1의 발현을 결정하기 위해 RNA 겔 블랏 분석을 실시했다. 이 젤은 ODO1 기록 수준이 1300~1600h 사이에서 증가하기 시작했으며, 2200h로 정점을 찍고 1000h로 가장 낮다는 것을 보여주었다. 이러한 OSO1 성적증명서 수준은 휘발성 벤제노이드 배출의 연대표와 직접적으로 일치한다. 게다가, 이 젤은 W138 비파괴 꽃들이 미첼 꽃의 ODO1 성적 수준이 10분의 1에 불과하다는 이전의 발견을 지지했다. 따라서, ODO1의 양은 휘발성 벤제노이드 배출량에 해당하며, 이는 ODO1이 벤제노이드 생합성을 조절한다는 것을 나타낸다.[17]
Additional genes contributing to the biosynthesis of major scent compounds are OOMT1 and OOMT2. OOMT1 and OOMT2 help to synthesize orcinol O-methyltransferases (OOMT), which catalyze the last two steps of the DMT pathway, creating 3,5-dimethoxytoluene (DMT). DMT is a scent compound produced by many different roses yet, some rose varieties, like Ros갈리카와 다마스크 장미 로사 다마스케네는 DMT를 배출하지 않는다. 이 품종들은 OOMT 유전자를 가지고 있지 않기 때문에 DMT를 만들지 않는 것이 제안되었다. 그러나 면역초점화 실험에 이어 꽃잎 표피에서 OOMT가 검출됐다. 이를 더 연구하기 위해 장미 꽃잎은 초밀접화 작용을 받았다. 초산염과 알갱이는 서부산 얼룩으로 검사되었다. 상등액과 펠릿에서 15만 g에서 OOMT 단백질을 검출해 OOMT 단백질이 꽃잎 표피막과 밀접하게 연관돼 있다는 결론을 내릴 수 있도록 했다. 그러한 실험은 로사 갈리카와 다마스크 장미 로사 다마스케네 품종 내에 OOMT 유전자가 존재한다는 것을 알아냈지만 DMT가 만들어지는 꽃 조직에서는 OOMT 유전자가 발현되지 않는다.[18]
참조
- ^ Bäurle, I; Laux, T (2003). "Apical meristems: The plant's fountain of youth". BioEssays. 25 (10): 961–70. doi:10.1002/bies.10341. PMID 14505363. 복습하다.
- ^ Drost, Hajk-Georg; Janitza, Philipp; Grosse, Ivo; Quint, Marcel (2017). "Cross-kingdom comparison of the developmental hourglass". Current Opinion in Genetics & Development. 45: 69–75. doi:10.1016/j.gde.2017.03.003. PMID 28347942.
- ^ Irie, Naoki; Kuratani, Shigeru (2011-03-22). "Comparative transcriptome analysis reveals vertebrate phylotypic period during organogenesis". Nature Communications. 2: 248. doi:10.1038/ncomms1248. ISSN 2041-1723. PMC 3109953. PMID 21427719.
- ^ Domazet-Lošo, Tomislav; Tautz, Diethard (2010-12-09). "A phylogenetically based transcriptome age index mirrors ontogenetic divergence patterns". Nature. 468 (7325): 815–818. doi:10.1038/nature09632. ISSN 0028-0836. PMID 21150997. S2CID 1417664.
- ^ Quint, Marcel; Drost, Hajk-Georg; Gabel, Alexander; Ullrich, Kristian Karsten; Bönn, Markus; Grosse, Ivo (2012-10-04). "A transcriptomic hourglass in plant embryogenesis". Nature. 490 (7418): 98–101. doi:10.1038/nature11394. ISSN 0028-0836. PMID 22951968. S2CID 4404460.
- ^ Drost, Hajk-Georg; Gabel, Alexander; Grosse, Ivo; Quint, Marcel (2015-05-01). "Evidence for Active Maintenance of Phylotranscriptomic Hourglass Patterns in Animal and Plant Embryogenesis". Molecular Biology and Evolution. 32 (5): 1221–1231. doi:10.1093/molbev/msv012. ISSN 0737-4038. PMC 4408408. PMID 25631928.
- ^ Leopold, A. Carl (1964). animal and there young one. McGraw-Hill. p. 183.
- ^ Brand, U; Hobe, M; Simon, R (2001). "Functional domains in plant shoot meristems". BioEssays. 23 (2): 134–41. doi:10.1002/1521-1878(200102)23:2<134::AID-BIES1020>3.0.CO;2-3. PMID 11169586. 복습하다.
- ^ Barlow, P (2005). "Patterned cell determination in a plant tissue: The secondary phloem of trees". BioEssays. 27 (5): 533–41. doi:10.1002/bies.20214. PMID 15832381.
- ^ 로스, 쉴드; 파리스, R.P.; 바인더, W.D. 성장 규제 기관과 해결사: 임업에서의 그들의 생리학과 잠재적 사용. L.G. (에드) 니켈의 35–78, 식물 성장을 조절하는 화학 물질. 제2권, CRC 프레스, 보카 라톤 FL.
- ^ Jones, Cynthia S. (1999-11-01). "An Essay on Juvenility, Phase Change, and Heteroblasty in Seed Plants". International Journal of Plant Sciences. 160 (S6): 105–S111. doi:10.1086/314215. ISSN 1058-5893. PMID 10572025. S2CID 21757481.
- ^ 맥베이, 1938년 Crassula 멀티카바에서의 재생. 미국 식물학 저널 25: 7-11. [1]
- ^ 드루 외 1979년 에틸렌이 추진하는 우발적 뿌리 뽑기 및 뿌리 내 피질 공기 공간(에렌치마)의 개발은 Zea mays L. Planta 147 1; 83-88, (Visser 외 1996)의 홍수에 대한 적응적 대응일 수 있다.
- ^ Naiman and Decamps, 1997, The Ecology of Interfaces: 리파리아 구역. 생태시스템 연차검토
- ^ Klerk et al. 1999. 소개된 뿌리의 형성을 검토한다: 새로운 개념, 새로운 가능성. 체외세포 및 발달생물학 - 제35공장 3.189-199
- ^ Azcón-Bieto; et al. (2000). Fundamentos de fisiología vegetal. McGraw-Hill/Interamericana de España, SAU. ISBN 84-486-0258-7.[페이지 필요]
- ^ a b 슈우링크, R.C., 헤링, M. A., 클라크, D. G.(2006) "페투니아 꽃의 휘발성 벤제노이드 생합성률 규제" Trends Plant Sci, 11(1) 도이: 10.1016/j.tplants. 2005.09.009
- ^ Scalliet, G., Lionnet, C., Le Bechec, M., Dutron, L., Magnard, J. L., Baudino, S., Bergougnoux, V., Jullien, F., Chambrier, P., Vergne, P., Dumas, C., Cock, J. M., Hugueney, P. (2006). "로즈향의 진화에서 페탈 특유의 오르시놀 O-메틸전달효소의 역할." 식물 물리올, 140: 18-29. 도이: https://doi.org/10.1104/pp.105.070961