정기간
Periodate 전위 이온 | |
 정형외과 이온 | |
| 이름 | |
|---|---|
| 체계적 IUPAC 이름 사색소조도(1-) 헥사옥소다이오드(5-) | |
| 식별자 | |
| |
3D 모델(JSmol) | |
| 켐스파이더 | |
펍켐 CID | |
| 유니 |
|
| |
| |
| 특성. | |
| IO4− 또는 IO65- | |
| 콘게이트산 | 주기산 |
| 관련 화합물 | |
기타 음이온 | 과염소산염 과브로마이트 과망간산염 |
달리 명시된 경우를 제외하고, 표준 상태(25°C [77°F], 100 kPa)의 재료에 대한 데이터가 제공된다. | |
| Infobox 참조 자료 | |
주기 /praraɪ.ədeɪt/는 요오드와 산소로 구성된 음이온이다.요오드의 여러 가지 옥사니온 중 하나로 시리즈 중 가장 높으며, 산화상태 +7에 요오드가 존재한다.과염소산염 등 다른 과할로겐산염과 달리 메타피오다이오드 IO와−
4 정형외과기5−
6 IO의 두 가지 형태로 존재할 수 있다.이 점에서 인접 그룹의 텔루레이트 이온과 견줄 만하다.그것은 주기성을 형성하기 위해 다수의 카운터 이온과 결합할 수 있으며, 주기산의 염으로도 간주될 수 있다.
주기는 하인리히 구스타프 마그누스와 C에 의해 발견되었다.F. 암머뮐러, 1833년에 처음으로 주기산을 합성했다.[1]
합성
고전적으로, 주기산은 가장 흔하게 수소 주기산 나트륨(NaHIO326)의 형태로 생산되었다.[2]이것은 상업적으로 구할 수 있지만, 염소와 수산화나트륨을 요오드산염으로 산화시킴으로써도 생산될 수 있다.[3]또는 마찬가지로 브로민 및 수산화나트륨과의 산화에 의한 요오드화합물:
- NaIO3 + Cl2 + 4 NaOH → Na3H2IO6 + 2 NaCl + H2O
- NaI + 4 Br2 + 10 NaOH → Na3H2IO6 + 8 NaBr + 4 H2O
현대의 산업 규모 생산은 PbO2 양극에서 요오드화학의 전기화학적 산화를 수반하며, 다음과 같은 표준 전극 전위를 가지고 있다.
메타페이퍼레이드는 일반적으로 질산 나트륨의 탈수 또는 [2]진공 상태에서 100 °C까지 가열하여 정형외과적산을 탈수하여 제조한다.
- Na3H2IO6 + 2 HNO3 → NaIO4 + 2 NaNO3 + 2 H2O
- H5IO6 → HIO4 + 2 H2O
또한 차아염소산염과 같은 다른 강한 산화제를 사용하여 요오드산염으로부터 직접 생성될 수 있다.
형태 및 상호 변환
주기성은 수용성 매체에서 다양한 형태로 존재할 수 있으며, pH는 제어 요인이 된다.정형외과에는 다수의 산 분해 상수가 있다.[5][6]
히오56 ⇌ 히오
4−
6+ H+ pKa = 3.29 히오
4−
6⇌ 히오
32−
6+ H+ pKa = 8.31 히오
32−
6⇌ 히오
23−
6+ H+ pKa = 11.60
정형외과와 계량형도 평형상태로 존재한다.
- HIO
4−
6 ⇌ IO−
4 + 2 HO2, K = 29
이러한 이유로 정형외과적합은 때때로 메타페리오데이트의 dihydrate,[7] 서면 IO−
4/2라고 불린다.HO2. 그러나 이 설명은56 HIO의 X선 결정학에서 5개의 동등한 I-OH 그룹을 나타내기 때문에 엄격하게 정확하지 않다.[8]
pH의 극한에서는 추가 종들이 형성될 수 있다.기본 조건 하에서 탈수 반응은 디페리오데이트(때로는 중수기데이트라고도 한다)를 형성하기 위해 발생할 수 있다.
- 2 HIO
32−
6 ⇌ HIO
2
24−
10 + 2 HO2, K = 820
강한 산 조건에서 주기산은 정형외과로오듐 양이온을 주기 위해 양성될 수 있다.[9]
- HIO
6+
6 ⇌ HIO56 + H+, pKa = -0.8
구조 및 본딩
정형외과와 전이과 모두에서 요오드는 고밸런스인데, 이는 요오드가 일반적으로 허용되는 것보다 더 많은 결합을 형성하기 때문이다.이는 데이터 결합의 관점에서 설명되어 이들 분자에 이중 결합이 없음을 확인시켜 주었다.[10]
정확한 구조는 카운터 이온에 따라 다르지만, 평균 정형외과에서는 I-O 결합 길이를 나타내는 X선 회절의 약간 변형된 옥타헤드 형상을 채택하고 있다.[11][8] 계측기에서는 평균 I-O 거리 1.78 å의 왜곡된 사면체 형상을 채택한다.[12][13]
반응
갈라짐 반응
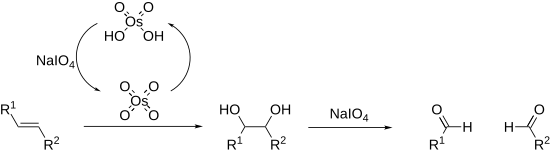
주기는 다양한 1,2 차동 알칸에 탄소-탄소 결합을 분리할 수 있다.[14][15]이것의 가장 흔한 예는 diol cleavage인데, 이 또한 가장 먼저 발견된 (말라프라이드 반응)이다.[16]주기는 디올 외에도 1,2-히드록시 케톤, 1,2-디케톤, α-케토산, α-히드록시산, 아미노산,[17] 1,2-아미노알코올,[18] 1,2-다이아민,[19] 에폭시드를[20] 분해하여 알데히드, 케톤, 카복시산을 투여할 수 있다.
알케인은 또한 레미유-존슨 산화에서 산화되고 분해될 수 있다.이것은 오스뮴 테트로크사이드의 촉매 하중을 사용하며, 시차제에 의해 현장에서 재생된다.전체 과정은 오조놀리시스 과정과 동일하다.
갈라진 반응은 주기율 에스테르라고 불리는 주기적인 중간을 통해 진행된다.이것의 형성은 pH와 온도에[21] 의해 영향을 받을 수 있지만, 시스 디올이 트랜스 디올보다 상당히 빠르게 반응하는 기질의 기하학에 가장 큰 영향을 받는다.[22]반응은 발열성이며 일반적으로 0°C에서 수행된다.정기염은 물 반응에만 쉽게 용해되기 때문에 일반적으로 수용성 매체로 행해진다.용해성이 문제인 경우 알코올에 용해되기 때문에 주기산을 사용할 수 있다. 위상 전달 촉매는 비파하스 반응 혼합물에도 효과적이다.극단적인 경우, 주기는 유사한 방식으로 반응하며 유기 용매(Criege oxide)에 용해되는 납 사트라아세테이트와 교환될 수 있다.
정기간 분열은 종종 당분자 고리를 수정하기 위한 목적으로 분자 생화학에 활용되는데, 많은 5-membarges 당분자는 대뇌동, 6-membride diol을 가지고 있기 때문이다.역사적으로 그것은 또한 단당류의 구조를 결정하는 데 사용되었다.[23][24]
주기율 분리는 종이 생산에 사용되는 다이얼알데히드 전분을 형성하기 위해 산업적 규모로 수행될 수 있다.[25]
산화반응
주기는 강력한 산화제다.그들은 카테콜을 1,2-벤조퀴논으로, 하이드로퀴논을 1,4-벤조퀴논으로 산화시킬 수 있다.[26]황화물은 효과적으로 황산화물로 산화될 수 있다.[27]주기는 과망간산염,[28] 오스뮴 테트로크사이드[29], 루테늄 테트로크사이드와 같은 다른 강력한 무기 산화제를 발생시킬 수 있을 만큼 충분히 강력하다.
틈새 용도
정기간행물은 특정 루테늄에 기초한 산화물에 대해 고도로 선택적인 식각제다.[30]
현미경 검사에 사용되는 여러 얼룩 물질은 주기산(예: 주기적인 산성-시프 얼룩 및 존스의 얼룩)에 기초한다.
주기는 폭약에 사용되는 산화제로도 사용되어 왔다.[31]2013년에 미 육군은 추적기 탄약에 사용하기 위해 환경적으로 해로운 화학 물질 바륨 질산염과 과염소산칼륨을 메타페리오데이트 나트륨으로 교체할 것이라고 발표했다.[32]
기타옥시온
치주산은 요오드가 -1, +1, +3, +5 또는 +7의 산화 상태를 가정할 수 있는 일련의 옥시온의 부분이다.중성 요오드산화물도 다수 알려져 있다.
| 요오드 산화 상태 | −1 | +1 | +3 | +5 | +7 |
|---|---|---|---|---|---|
| 이름 | 요오드화합물 | 저자극의 | 요오드산염 | 요오드산염 | 기간을 정하다 |
| 공식 | I− | IO− | IO− 2 | IO− 3 | IO− 4 또는 IO5− 6 |
| 구조 |  |
참고 항목
참조
- ^ Ammermüller, F.; Magnus, G. (1833). "Ueber eine neue Verbindung des Jods mit Sauerstoff, die Ueberjodsäure". Annalen der Physik und Chemie (in German). 104 (7): 514–525. Bibcode:1833AnP...104..514A. doi:10.1002/andp.18331040709.
- ^ a b Riley, edited by Georg Brauer; translated by Scripta Technica, Inc. Translation editor Reed F. (1963). Handbook of preparative inorganic chemistry. Volume 1 (2nd ed.). New York, N.Y.: Academic Press. pp. 323–324. ISBN 012126601X.
{{cite book}}:first=일반 이름 포함(도움말) - ^ Hill, Arthur E. (October 1928). "Ternary Systems. VII. The Periodates of the Alkali Metals". Journal of the American Chemical Society. 50 (10): 2678–2692. doi:10.1021/ja01397a013.
- ^ Parsons, Roger (1959). Handbook of electrochemical constants. Butterworths Scientific Publications Ltd. p. 71.
- ^ Aylett, founded by A.F. Holleman; continued by Egon Wiberg; translated by Mary Eagleson, William Brewer; revised by Bernhard J. (2001). Inorganic chemistry (1st English ed., [edited] by Nils Wiberg. ed.). San Diego, Calif.: Berlin: Academic Press, W. de Gruyter. p. 454. ISBN 0123526515.
- ^ Burgot, Jean-Louis (30 March 2012). Ionic equilibria in analytical chemistry. New York: Springer. p. 358. ISBN 978-1441983824.
- ^ Ropp, Richard C. (31 December 2012). Encyclopedia of the alkaline earth compounds. Oxford: Elsevier Science. p. 96. ISBN 978-0444595539.
- ^ a b Feikema, Y. D. (1966). "The crystal structures of two oxy-acids of iodine. I. A study of orthoperiodic acid, H5IO6, by neutron diffraction". Acta Crystallographica. 20 (6): 765–769. doi:10.1107/S0365110X66001828.
- ^ Greenwood, N.N.; Earnshaw, A. (2006). Chemistry of the elements (2nd ed.). Oxford: Butterworth-Heinemann. p. 874. ISBN 0750633654.
- ^ Ivanov, A.; Popov, A.; Boldyrev, A.; Zhdankin, V. (2014). "The I=X (X = O,N,C) Double Bond in Hypervalent Iodine Compounds: Is it Real?". Angew. Chem. Int. Ed. 53 (36): 9617–9621. doi:10.1002/anie.201405142. PMID 25045143.
- ^ Tichý, K.; Rüegg, A.; Beneš, J. (1980). "Neutron diffraction study of diammonium trihydrogen periodate, (NH4)2H3IO6, and its deuterium analogue, (ND4)2D3IO6". Acta Crystallographica Section B. 36 (5): 1028–1032. doi:10.1107/S0567740880005225.
- ^ Levason, W.; Webster, M. (15 June 1999). "Ammonium tetraoxoiodate(VII)". Acta Crystallographica Section C. 55 (6): IUC9900052. doi:10.1107/S0108270199099394.
- ^ Kálmán, A.; Cruickshank, D. W. J. (1970). "Refinement of the structure of NaIO4". Acta Crystallographica Section B. 26 (11): 1782–1785. doi:10.1107/S0567740870004880.
- ^ Sklarz, B. (1967). "Organic chemistry of periodates". Quarterly Reviews, Chemical Society. 21 (1): 3. doi:10.1039/QR9672100003.
- ^ Bamford, edited by C.H.; Tipper, C.F.H. (1972). Reactions of non-metallic inorganic compounds. Amsterdam: Elsevier Pub. Co. p. 435. ISBN 9780080868011.
{{cite book}}:first=일반 이름 포함(도움말) - ^ L. Malapray, Bull. Soc. Chim. 3, 1, 833호 (1934년)
- ^ Clamp, J.R.; Hough, L. (Jan 1965). "The Periodate Oxidation of Amino Acids with Reference to Studies on Glycoproteins". The Biochemical Journal. 94: 17–24. doi:10.1042/bj0940017. PMC 1206400. PMID 14342227.
- ^ Nicolet, Ben H.; Shinn, Leo A. (June 1939). "THE ACTION OF PERIODIC ACID ON α-AMINO ALCOHOLS". Journal of the American Chemical Society. 61 (6): 1615. doi:10.1021/ja01875a521.
- ^ Maros, László; Molnár-Perl, Ibolya; Schissel, Enikó; Szerdahelyi, Vilmos (1980). "Mechanism of the periodate oxidation of ethane-1,2-diamine, N,N′-dimethylethane-1,2-diamine, and 2-aminoethanol". Journal of the Chemical Society, Perkin Transactions 2 (1): 39–45. doi:10.1039/P29800000039.
- ^ Telvekar, Vikas N.; Patel, Dharmeshkumar J.; Mishra, Sanket J. (2008). "Oxidative Cleavage of Epoxides Using Aqueous Sodium Paraperiodate". Synthetic Communications. 39 (2): 311–315. doi:10.1080/00397910802372574. S2CID 97403497.
- ^ Buist, G. J.; Bunton, C. A.; Hipperson, W. C. P. (1971). "The mechanism of oxidation of α-glycols by periodic acid. Part X. The oxidation of pinacol, and a general discussion of the stability of periodate esters and their role in the mechanism of oxidation". Journal of the Chemical Society B: Physical Organic: 2128–2142. doi:10.1039/J29710002128.
- ^ McMurry, John (2012). Organic chemistry (8th ed., [international ed.] ed.). Singapore: Brooks/Cole Cengage Learning. p. 312. ISBN 978-0840054531.
- ^ Jackson, Ernest L.; Hudson, C. S. (June 1937). "Studies on the Cleavage of the Carbon Chain of Glycosides by Oxidation. A New Method for Determining Ring Structures and Alpha and Beta Configurations of Glycosides". Journal of the American Chemical Society. 59 (6): 994–1003. doi:10.1021/ja01285a010.
- ^ Robyt, John F. (1998). Essentials of carbohydrate chemistry. New York: Springer. ISBN 0387949518.
- ^ Yu, Jiugao; Chang, Peter R.; Ma, Xiaofei (January 2010). "The preparation and properties of dialdehyde starch and thermoplastic dialdehyde starch". Carbohydrate Polymers. 79 (2): 296–300. doi:10.1016/j.carbpol.2009.08.005.
- ^ Weidman, S. W.; Kaiser, E. T. (December 1966). "The Mechanism of the Periodate Oxidation of Aromatic Systems. III. A Kinetic Study of the Periodate Oxidation of Catechol". Journal of the American Chemical Society. 88 (24): 5820–5827. doi:10.1021/ja00976a024.
- ^ Leonard, Nelson J.; Johnson, Carl R. (January 1962). "Periodate Oxidation of Sulfides to Sulfoxides. Scope of the Reaction". The Journal of Organic Chemistry. 27 (1): 282–284. doi:10.1021/jo01048a504.
- ^ Lemieux, R. U.; Rudloff, E. Von (November 1955). "Periodate–Permanganate Oxidations: I. Oxidation of Olefins". Canadian Journal of Chemistry. 33 (11): 1701–1709. doi:10.1139/v55-208.
- ^ Pappo, R.; Allen, Jr., D. S.; Lemieux, R. U.; Johnson, W. S. (1956). "Notes - Osmium Tetroxide-Catalyzed Periodate Oxidation of Olefinic Bonds". The Journal of Organic Chemistry. 21 (4): 478–479. doi:10.1021/jo01110a606. ISSN 0022-3263.
- ^ 디터 베버, 로자 뵈플리, 유화 첸, 율리아 무르지나, 울리치 포페: 습식 화학 식각제를 사용하여 산화층의 상피 침적과 석판 구조의 반복적인 단계에 의해 만들어진 가변 저항기.얇은 솔리드 필름(2013) DOI: 10.1016/j.tsf.2012.11.118
- ^ Moretti, Jared D.; Sabatini, Jesse J.; Chen, Gary (9 July 2012). "Periodate Salts as Pyrotechnic Oxidizers: Development of Barium- and Perchlorate-Free Incendiary Formulations". Angewandte Chemie International Edition. 51 (28): 6981–6983. doi:10.1002/anie.201202589. PMID 22639415.
- ^ "Picatinny to remove tons of toxins from lethal rounds". U.S. Army. Retrieved 31 October 2013.