부갑상선증
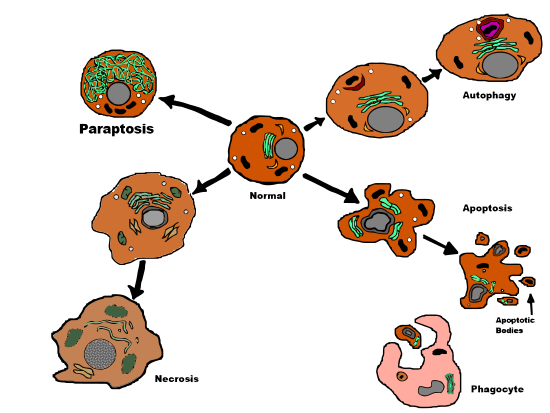
Paraptosis부갑상선증은 형태학적으로 아포토시스 및 괴사와는 다른 프로그램된 세포사의 한 종류이다.부갑상선의 명확한 특징은 카스파아제 활성화와 억제와는 무관한 세포질 공포화, 그리고 아포토시스 형태학의 결여이다.부갑상선증은 세포막 블리징, 염색질 응축, 핵 파편화와 같은 아포토시스의 특징 중 몇 가지가 부족하다.아포토시스나 다른 유형의 프로그램된 세포사망과 마찬가지로 세포는 스스로 죽음을 초래하는 데 관여하며 유전자 발현을 필요로 한다.이것은 세포 손상으로 인해 발생하는 프로그램되지 않은 세포사망인 괴사와는 대조적이다.
부갑상선증은 몇몇 암 약물에 의해 유발될 뿐만 아니라 일부 발달 및 신경변성 세포 사망에서 발견되었다.
역사
"부갑상선"이라는 용어가 처음 사용된 것은 2000년 사비나 스페란디오 외 연구진에 의해 보고되었다.이 그룹은 인간 인슐린 유사 성장인자 1 수용체(IGF-1R)를 사용하여 293T 세포와 쥐 배아 섬유아세포의 세포사를 자극하여 다른 형태의 세포사와 뚜렷한 차이를 관찰했다.그들은 그리스어의 전치사 파라(paraptosis)와 아포토시스([1][2]apotosis)에서 파생된 "파라캡토시스"라는 용어를 만들었다.
Sperandio가 부갑상선이라는 용어를 최초로 발표했지만, 부갑상선의 특성을 가진 세포사멸이 관찰된 것은 이번이 처음은 아니다."세포질"과 "타입 3 세포사"와 같은 용어는 이전에 이러한 세포사 형태를 묘사하기 위해 사용되었습니다.이 형태들은 형태학적으로 부갑상증과 매우 유사하며, 원래 이러한 형태들 중 하나로 묘사된 세포 사멸의 몇 가지 예가 [1][3]부갑상증의 발생일 수 있습니다.
형태학
부갑상선증은 특정 아포토시스적 특성과 괴사적 특징의 독특한 조합을 가진 III형 프로그램된 세포사의 한 형태이다.부갑상선증은 핵분열, 아포토시스체 형성 또는 염색질 응축의 결정적인 증명이 아니며, 모두 아포토시스(apoptosis)에서 나타난다.대신, 부갑상증은 특징적인 세포질 액포 형성, 늦은 미토콘드리아의[1] 붓기와 [5]뭉침을 포함한 괴사에 필적하는 다소 원시적인 세포사 [4]경로를 나타낸다.액포의 수와 크기는 시간이 지남에 따라 증가합니다.최종적으로 vacuole 사이즈는 반환되지 않는 지점에 도달하고 셀은 [5]회복할 수 없습니다.
아포토시스와 마찬가지로 염색 기술은 혈장막 세포질(내부) 리플릿에서 세포 표면 또는 외부 [6]리플릿으로의 포스파티딜세린의 전이를 강조함으로써 부엽토시스 세포를 식별하기 위해 사용될 수 있다.
부갑상선 형태학적 변화는 신경계가 [1]발달하는 동안 겪는 형태학적 변화와 유사하다.
주요 구조 재배치
광현미경 [7]검사를 통해 원형세포, 세포질 재구성, 부갑상선세포의 액포화 등 주요 구조 재배열을 거의 즉시 알 수 있다.미토콘드리아와 소포체의 물리적 확대가 있다.이러한 부은 외관은 세포 내 이온 불균형과 최종 삼투압 용해에 기인할 수 있다.파열되면 (1) 고이동성 그룹 B-1(HMGB1)[8] (2) 히트쇼크[9] 단백질 및 (3) 기타 각종 단백질 분해효소 등의 입자 및 물질이 방출된다.이러한 물질은 "위험 신호"로 염증을 [10]유발합니다.
경로
프로그램된 세포사의 특정 템플릿은 de novo 단백질 합성에 의존하는 것으로 알려져 있지만, 293T 세포에서 IGFIR-IC에 의해 유도되는 부갑상세포사는 액티노마이신 D와 시클로헥시미드에 의해 억제되어 전사 및 [1]번역에 대한 의존성을 나타낸다.
부갑상선 유도는 수용체 수준에서 IGF-IR을 사용하여 MAPK와 JNK라는 두 가지 양성 신호 전달 경로를 통해 매개되는 것으로 결정되었다.따라서 이들 [3]경로의 특정 단백질 키나아제를 억제함으로써 부갑상선증을 예방할 수 있다.
AIP1과 엔도필린과의 (카복실 말단을 통해) 상호작용은 세포 내 액포 [11]형성을 유도할 수 있다.AIP1/Alix는 부갑상선증의 "[3]최초의 특이적 억제제"로 확인되었다.
부갑상선 발현형은 또한 비수용체 티로신인산화효소 c-Src의 과잉활성화에 따른 인간 대장암 세포에서 설명되었으며 부갑상선에서의 [12]Src 시그널링의 잠재적 관여를 시사한다.
다른 세포사 경로와의 차이점
293T 세포에서 IGFIR-IC에 의해 유도된 세포사는 관련 카스파아제 활성 없이 세포사를 나타냈다.이것은 프로아포토시스 단백질 백스가 카스파아제 활성화와 세포사멸을 유도한 아포토시스와 비교된다.또한 연구결과 카스파아제 억제제(zVAD.fmk, p53, BAF), x-염색체 연결 억제제(xiap), Bcl-xL(Bcl-2 패밀리)은 IGFIR-IC에 의해 유도되었을 때 293T 세포에서 세포사멸을 방지하지 않았다.따라서 부갑상선은 아포토시스 억제제의 영향을 받지 않는다는 점에서 아포토시스([1]세포사형 1)와 다른 것으로 결론났다.
아포토시스에서는 염색질 단백질인 HMGB1이 핵내에 유지되어 아포토시스체의 형성이 이루어지는 한편, 파라포토시스에서는 HMGB1이 [13]방출된다.
(2014년 4월 현재) 부갑상증과 자가마법 세포사망([1]세포사망 유형 2) 사이에 관찰된 가장 명확한 차이는 자가마법 세포사망에서 볼 수 있는 특징적인 자가마법 액포의 부족이다.예상대로 자가세포사 억제제(예를 들어 3-메틸아데닌)는 부갑상선 [7]억제에는 효과가 없다.
세포사형 비교
| 부갑상선증 | 아포토시스 | 네크로시스 | |
|---|---|---|---|
| 형태학 | |||
| 세포질공포화 | 네. | 아니요. | 네. |
| 염색질 응축 | 아니요. | 네. | 아니요. |
| 핵분할 | 아니요. | 네. | 아니요. |
| 아포토시스체 | 아니요. | 네. | 아니요. |
| 미토콘드리아의 팽창 | 네. | 가끔씩 | 네. |
| 멤브레인 블리징 | 아니요. | 네. | 네, 늦었습니다 |
| 프로그램된 세포사망 | 네. | 네. | 아니요. |
| 캐스페이즈 액티비티 | 아니요. | 네. | 가끔씩 |
| 억제제 | |||
| 악티노마이신D, 시클로헥시미드 | 네. | 가끔씩 | 아니요. |
| AIP1/Alix | 네. | 아니요. | 아니요. |
| Caspase 억제제(zVAD.fmk, p53, BAF) | 아니요. | 네. | 아니요. |
| 샤프 | 아니요. | 네. | 아니요. |
| BCL-XL | 아니요. | 네. | 대개는 그렇지 않다 |
프로테옴 프로파일
세포는 부갑상선증을 겪을 때 형태학적 변화와 프로테옴 변화를 모두 경험한다.구조, 신호 전달 및 미토콘드리아 단백질의 변화는 모두 부갑상선증 [7]동안 관찰되었다.
구조단백질
부갑상선증이 있는 세포:
신호전달단백질
PEBP 또는 Raf 키나제 억제제 단백질(RKIP)은 부갑상세포에서 감소하며, 따라서 PEBP 및/또는 다른 키나제 억제제의 하향 조절은 MAPK 및 JNK 경로의 참여를 나타내는 것으로 보인다. 감소된 PEBP는 MAPK 및 JNK의 수준이 충분히 축적될 수 있도록 허용하기 때문이다.
미토콘드리아 단백질
ATP 합성효소는 여러 개의 소단위들로 구성되어 있고 미토콘드리아에서 발견된다.P20에서는 [7]부갑상선증(Paraptosis)이 있을 때 더 많은 양의 ATP 합성효소 γ-subunits가 확인되었다.
미토콘드리아 염색은 미토콘드리아 [7]네트워크의 재구성을 진행 중인 것으로 보인다.
부갑상선세포는 금지제가 3.4배 증가하였다.부갑상선 자극과의 결합에서 증가된 금지인자는 카스파아제 [7]억제제에 의해 억제될 수 없는 세포사를 초래할 수 있다.
잠재적인 의학적 중요성
암
많은 항암물질들이 광범위한 인간 암세포에서 부갑상증을 일으키는 것으로 나타났다.여기에는 금속 [16][17]복합체뿐만 아니라 천연[14][15] 소스에서 파생된 여러 화합물이 포함됩니다.부갑상선은 또한 암연구에서 아포토시스 저항성 [14][18]암을 치료하는 방법으로서 관심 분야이다.
Paclitaxel은 일반적으로 Taxol이라는 상표명으로 유통되며 유방암과 난소암 치료에 사용되는 암 치료제이다.한 연구에서는 고농도(70μM)에서 부갑상선세포사(paraptosis)를 유도하는 것으로 나타났으며, 아포토시스 내성암 [18]치료에 중요한 메커니즘이 될 수 있다.
연구진은 팜유에서 유래한 비타민 E의 일종인 γ-토코트리에놀이 대장암세포에서 부갑상선세포와 같은 세포사를 유발한다는 사실을 밝혀냈다고 보고했다.γ-to-cotrienol은 부갑상선증 유발과 함께 종양발달에 관여하는 Wnt 시그널링 경로도 억제했다.이 두 가지 특징의 조합은 대장암을 [15]치료하기 위한 새로운 메커니즘을 제공할 수 있다.
찐 미국산 인삼 추출물은 "대장암 세포를 잠재적으로 죽인다"[19]고 보고되었다.구체적으로는 프로토파낙사디올 Rg3 및 Rh2 유도체가 추출물에서 [19]발견되는 주요 진세노사이드이다.대장암세포주 HCT116에서는 Rh2에 [20]의해 세포성 진공화가 유도되었다.또한 MEK1/2특이억제제 U0126,[20] 시클로헥시미드에 의해 Rh2유기성 액포화를 억제함으로써 부갑상선의 2가지 특성, 즉 MAP인산화효소에 의한 시그널링과 필요한 단백질 [3]번역이 확인되었다.또한 Rh2는 NF-δB 시그널링 경로를 활성화하는 ROS 수치의 증가를 유도하는 한편, NAC 또는 카탈라아제에 의한 ROS 차단은 NF-δB 시그널링의 활성화를 방지하고 Rh2에 의해 유도되는 세포사를 더욱 증가시킨다.이는 Rh2의 [20]항산화 증강 항암 효과를 시사한다.
호노키올은 목련에서 유래한 화합물로 백혈병 세포에 부갑상증을 유발할 수 있다.NB4 세포주에서는 부갑상선이 세포사멸의 주요 방법이었다.K562 세포에서는 아포토시스가 주요 메커니즘이었으며, 때때로 부갑상선증이 발견되었다.[14]연구자들은 이것이 백혈병 세포 사멸이 여러 [14]경로로 유발될 수 있음을 시사한다고 말했다.
한 실험에서 포스핀 구리(I) 복합체는 소포체 스트레스를 [16]유도함으로써 대장암 세포에 부갑상증을 유발했다.또 다른 구리 복합체인 A0 티옥소트리아졸 구리(II) 복합체도 내소형 망막 응력과 세포질 진공화를 통해 HT1080 섬유육종 세포에 부갑상증을 유발했다.A0은 산화글루타티온의 증가 및 프로테아솜 활성의 방지와 같은 세포독성 효과와 함께 아포토시스를 억제하고 부접종을 [17]통해 세포를 죽게 할 수 있는 카스파아제-3의 활성을 방지하였다.
신경변성세포사
포유동물 종양 억제제 p53의 활성은 p53, p44의 동질체 수준에 따라 달라진다.p44의 과잉 발현을 가진 트랜스제닉 마우스 실험에서 IGF-1R의 과활성화가 일어나 노화와 사망이 가속화되었다.이 쥐들은 또한 기억 형성과 회복과 관련된 뇌의 영역에서 신경계 죽음을 경험했다.이 IGF-1R 유도 신경변성은 부갑상선증과 자가마법 세포사 [21]둘 다에 의해 야기되었다.IGF-1R은 알츠하이머 환자의 [22]뇌에서 IGF-1R의 수치 증가를 포함한 IGF-1R 시그널링의 결함이 발견되었기 때문에 신경퇴행성 질환에 대한 중요한 연구 영역이다.
기타 예
부갑상선증과 같은 프로그램된 세포사멸은 식물과 원생동물 모두에서 관찰되었다.동물에서 발견되는 것과 유사한 아포토시스 죽음은 식물세포의 세포벽이 식세포증을 막기 때문에 식물에서 일어나지 않는다.담배를 이용한 실험에서, 블레오마이신은 세포의 DNA에 이중 가닥이 끊어지는 것을 도입하기 위해 사용되었다.이것은 세포들이 상당한 액포화와 함께 프로그램된 세포사멸을 겪게 했고,[23] 부갑상증과 유사하게 DNA 조각화와 카스파아제 억제의 부재를 초래했다.조류 Dunaliella viridis에 대한 연구는 다른 환경 [24]자극에 따라 부갑상선증과 아포토시스를 포함한 몇 가지 유형을 통해 원생동물들이 프로그램된 세포 사멸을 겪을 수 있다는 것을 보여주었다.이러한 요소들의 조합은 부갑상선이 다른 [23]생명체들에 걸쳐 보존되는 프로그램된 세포사의 조상 형태일 수도 있다는 추측을 불러 일으켰다.
「 」를 참조해 주세요.
레퍼런스
- ^ a b c d e f g h Sperandio, S; de Belle, I; Bredesen, DE (Dec 19, 2000). "An alternative, nonapoptotic form of programmed cell death". Proceedings of the National Academy of Sciences of the United States of America. 97 (26): 14376–81. Bibcode:2000PNAS...9714376S. doi:10.1073/pnas.97.26.14376. PMC 18926. PMID 11121041.
- ^ "Paraptosis - Oxford Dictionaries".
- ^ a b c d e Sperandio S, Poksay K, de Belle I, Lafuente MJ, Liu B, Nasir J, Bredesen DE (Oct 2004). "Paraptosis: mediation by MAP kinases and inhibition by AIP-1/Alix". Cell Death and Differentiation. 11 (10): 1066–75. doi:10.1038/sj.cdd.4401465. PMID 15195070.
- ^ "Paraptosis — new pathway to programmed cell death". Bioresearch Online (news item). December 19, 2000.
- ^ a b Cagle, Philip T.; Allen, Timothy Craig (2009-06-10). Basic Concepts of Molecular Pathology. Springer. p. 30. ISBN 9780387896267. Retrieved 19 April 2014.
- ^ Wang, Y; Li, X; Wang, L; Ding, P; Zhang, Y; Han, W; Ma, D (Mar 15, 2004). "An alternative form of paraptosis-like cell death, triggered by TAJ/TROY and enhanced by PDCD5 overexpression". Journal of Cell Science. 117 (Pt 8): 1525–32. doi:10.1242/jcs.00994. PMID 15020679.
- ^ a b c d e f g h i j Sperandio, S; Poksay, KS; Schilling, B; Crippen, D; Gibson, BW; Bredesen, DE (Dec 15, 2010). "Identification of new modulators and protein alterations in non-apoptotic programmed cell death". Journal of Cellular Biochemistry. 111 (6): 1401–12. doi:10.1002/jcb.22870. PMC 5668132. PMID 20830744.
- ^ Yang, H; Wang, H; Czura, CJ; Tracey, KJ (Jul 2005). "The cytokine activity of HMGB1". Journal of Leukocyte Biology. 78 (1): 1–8. doi:10.1189/jlb.1104648. PMID 15734795.
- ^ Melcher, A; Todryk, S; Hardwick, N; Ford, M; Jacobson, M; Vile, RG (May 1998). "Tumor immunogenicity is determined by the mechanism of cell death via induction of Heat shock protein expression". Nature Medicine. 4 (5): 581–7. doi:10.1038/nm0598-581. PMID 9585232. S2CID 21603158.
- ^ Gallucci, S; Matzinger, P (Feb 2001). "Danger signals: SOS to the immune system". Current Opinion in Immunology. 13 (1): 114–9. doi:10.1016/s0952-7915(00)00191-6. PMID 11154927.
- ^ Chatellard-Causse, C; Blot, B; Cristina, N; Torch, S; Missotten, M; Sadoul, R (Aug 9, 2002). "Alix (ALG-2-interacting protein X), a protein involved in apoptosis, binds to endophilins and induces cytoplasmic vacuolization". The Journal of Biological Chemistry. 277 (32): 29108–15. doi:10.1074/jbc.M204019200. PMID 12034747.
- ^ Welman A, Cawthorne C, Ponce-Perez L, et al. (2006). "Increases in c-Src expression level and activity do not promote the growth of human colorectal carcinoma cells in vitro and in vivo". Neoplasia. 8 (11): 905–16. doi:10.1593/neo.06475. PMC 1716016. PMID 17132222.
- ^ Cohen, JJ (Mar 1993). "Apoptosis". Immunology Today. 14 (3): 126–30. doi:10.1016/0167-5699(93)90214-6. PMID 8466628.
- ^ a b c d Wang, Y; Zhu, X; Yang, Z; Zhao, X (Jan 18, 2013). "Honokiol induces caspase-independent paraptosis via reactive oxygen species production that is accompanied by apoptosis in leukemia cells". Biochemical and Biophysical Research Communications. 430 (3): 876–82. doi:10.1016/j.bbrc.2012.12.063. PMID 23262230.
- ^ a b Zhang, JS; Li, DM; Ma, Y; He, N; Gu, Q; Wang, FS; Jiang, SQ; Chen, BQ; Liu, JR (2013). "γ-Tocotrienol induces paraptosis-like cell death in human colon carcinoma SW620 cells". PLOS ONE. 8 (2): e57779. Bibcode:2013PLoSO...857779Z. doi:10.1371/journal.pone.0057779. PMC 3585143. PMID 23469066.
- ^ a b Gandin, V; Pellei, M; Tisato, F; Porchia, M; Santini, C; Marzano, C (Jan 2012). "A novel copper complex induces paraptosis in colon cancer cells via the activation of ER stress signalling". Journal of Cellular and Molecular Medicine. 16 (1): 142–51. doi:10.1111/j.1582-4934.2011.01292.x. PMC 3823100. PMID 21388518.
- ^ a b Tardito, S; Isella, C; Medico, E; Marchiò, L; Bevilacqua, E; Hatzoglou, M; Bussolati, O; Franchi-Gazzola, R (Sep 4, 2009). "The thioxotriazole copper(II) complex A0 induces endoplasmic reticulum stress and paraptotic death in human cancer cells". The Journal of Biological Chemistry. 284 (36): 24306–19. doi:10.1074/jbc.M109.026583. PMC 2782024. PMID 19561079.
- ^ a b Guo, WJ; Chen, TS; Wang, XP; Chen, R (2010). "Taxol induces concentration-dependent apoptotic and paraptosis-like cell death in human lung adenocarcinoma (ASTC-a-1) cells". Journal of X-Ray Science and Technology. 18 (3): 293–308. doi:10.3233/XST-2010-0261. PMID 20714087.
- ^ a b Li, B; Wang, CZ; He, TC; Yuan, CS; Du, W (Mar 1, 2010). "Antioxidants potentiate American ginseng-induced killing of colorectal cancer cells". Cancer Letters. 289 (1): 62–70. doi:10.1016/j.canlet.2009.08.002. PMC 2824022. PMID 19716228.
- ^ a b c Li, B; Zhao, J; Wang, CZ; Searle, J; He, TC; Yuan, CS; Du, W (Feb 28, 2011). "Ginsenoside Rh2 induces apoptosis and paraptosis-like cell death in colorectal cancer cells through activation of p53". Cancer Letters. 301 (2): 185–92. doi:10.1016/j.canlet.2010.11.015. PMC 3022099. PMID 21194832.
- ^ Pehar M, O'Riordan KJ, Burns-Cusato M, Andrzejewski ME, del Alcazar CG, Burger C, Scrable H, Puglielli L (Apr 2010). "Altered longevity-assurance activity of p53:p44 in the mouse causes memory loss, neurodegeneration and premature death". Aging Cell. 9 (2): 174–90. doi:10.1111/j.1474-9726.2010.00547.x. PMC 2848983. PMID 20409077.
- ^ Moloney, AM; Griffin, RJ; Timmons, S; O'Connor, R; Ravid, R; O'Neill, C (Feb 2010). "Defects in IGF-1 receptor, insulin receptor and IRS-1/2 in Alzheimer's disease indicate possible resistance to IGF-1 and insulin signalling". Neurobiology of Aging. 31 (2): 224–43. doi:10.1016/j.neurobiolaging.2008.04.002. PMID 18479783. S2CID 14265087.
- ^ a b Smetana, O; Široký, J; Houlné, G; Opatrný, Z; Chabouté, ME (Apr 2012). "Non-apoptotic programmed cell death with paraptotic-like features in bleomycin-treated plant cells is suppressed by inhibition of ATM/ATR pathways or NtE2F overexpression". Journal of Experimental Botany. 63 (7): 2631–44. doi:10.1093/jxb/err439. PMID 22268149.
- ^ Jiménez, C; Capasso, JM; Edelstein, CL; Rivard, CJ; Lucia, S; Breusegem, S; Berl, T; Segovia, M (2009). "Different ways to die: cell death modes of the unicellular chlorophyte Dunaliella viridis exposed to various environmental stresses are mediated by the caspase-like activity DEVDase". Journal of Experimental Botany. 60 (3): 815–28. doi:10.1093/jxb/ern330. PMC 2652065. PMID 19251986.