수성(I
Mercury(I) sulfate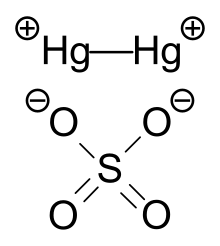 | |
| 이름 | |
|---|---|
| IUPAC 이름 수성(I | |
| 기타 이름 수은황산염 | |
| 식별자 | |
| |
3D 모델(JSmol) | |
| 켐스파이더 | |
| ECHA InfoCard | 100.029.084 |
| EC 번호 |
|
펍켐 CID | |
| 유니 | |
CompTox 대시보드 (EPA) | |
| |
| |
| 특성. | |
| Hg2SO4 | |
| 어금질량 | 497.24 g/190 |
| 외관 | 희끄무레한 황색 결정체 |
| 밀도 | 7.56 g/cm3 |
| 0.051 g/100 mL(25 °C) 0.09 g/100 mL(100 °C) | |
용해성 제품(Ksp) | 6.5×10−7[1] |
| 용해성 | 희석된 질산에 녹고, 물에 녹지 않으며, 뜨거운 황산에 녹는다. |
자기 감수성(magnetic susibility) | -123.0·10cm−63/192 |
| 구조 | |
| 단색의 | |
| 열화학 | |
열 용량 (C) | 132 J·몰−1·K−1[2] |
성 어금니 엔트로피 (S | 200.7 J·몰−1·K−1 |
의 성 엔탈피 대형화 (ΔfH⦵298) | -743.1 kJ·몰−1 |
| 관련 화합물 | |
기타 음이온 | 플루오르화 수은(I) 염화 수은(I) 수성(I)브로마이드 요오드화 수은(I) |
기타 양이온 | 수성(Mercury)II) 황산염 황산 카드뮴 탈륨(I)황산염 |
달리 명시된 경우를 제외하고, 표준 상태(25°C [77°F], 100 kPa)의 재료에 대한 데이터가 제공된다. | |
| Infobox 참조 자료 | |
흔히 수은(I)황산염(영국) 또는 수은(미국)으로 불리는 수은(I)황산염은 화학성분 HgSO이다24.[3] 머큐리(I)황산염은 금속성 화합물로 희고 옅은 황색 또는 베이지색 분말이다.[4] 두 수소 원자를 모두 수은(I)으로 대체해 형성된 황산의 금속염이다. 그것은 매우 독성이 강해서 흡입, 섭취 또는 피부에 흡수되면 치명적일 수 있다.
구조
수은 황산염의 결정구조는 주건물22+ 단위로[clarification needed] Hg 아령과42− SO 음이온으로 구성되어 있다. Hg22+ 아령은 4개의 산소 원자로 둘러싸여 있는데 Hg-O 거리는 2.23~2.93 å인 반면 Hg-Hg 거리는 약 2.50 å이다.[5]
연구에 따르면 수은(I) 황산염은 접착 거리 2.500㎛의 수은 원자를 이중으로 배열한 것으로 나타났다. 금속 원자 쌍둥이는 단위 셀의[clarification needed] 축에 평행하게 향한다. Mercury 더블렛은 무한4 체인(SO – Hg – Hg – Hg – SO4 – Hg – ...)의 일부를 형성한다. Hg – Hg – O 본드 각도는 165°±1° 사슬이 대각선으로 단위 세포를 가로지른다. 황산 수은 구조는 약한 Hg-O 상호작용에 의해 함께 유지된다. SO는4 단일 음이온으로 작용하지 않고 오히려 수은 금속으로 조정된다.[6]
준비
수은(I)황산염을 준비하는 한 가지 방법은 질산 수은(I)의 산성 용액과 1 ~ 6 황산 용액을 혼합하는 것이다.[7][8]
- Hg2(NO3)2 + H2SO4 → Hg2SO4 + 2 HNO3
또한 과도한 수은을 농축 황산과 반응시킴으로써 준비할 수 있다.[7]
- 2Hg + 2 HSO24 → HgSO24 + 2 HO2 + SO2
전기화학세포에 사용
황산 수은은 종종 전기화학 세포에 사용된다.[9][10][11] 1872년 라티머 클라크에 의해 전기화학 세포에 처음 도입되었고,[12] 그 후 1911년 조지 아우구스투스 휴렛이 만든 웨스턴 세포에서 대체적으로[clarification needed] 사용되었다.[12] 황산은과 함께 100℃ 이상의 고온에서 좋은 전극으로 밝혀졌다.[13]
황산수성은 고온에서 분해되는 것으로 밝혀졌다. 분해 과정은 내열성이 있으며 335 °C에서 500 °C 사이에 발생한다.
수성(I)황산염은 표준세포를 가능하게 하는 독특한 성질을 가지고 있다. 용해도가 다소 낮으며(리터당 약 1g), 음극계로부터의 확산이 과도하지 않으며 수은 전극에서 큰 전위를 주기에 충분하다.[14]
참조
- ^ John Rumble (June 18, 2018). CRC Handbook of Chemistry and Physics (99 ed.). CRC Press. pp. 5–189. ISBN 978-1138561632.
- ^ Lide, David R. (1998), Handbook of Chemistry and Physics (87 ed.), Boca Raton, FL: CRC Press, pp. 5–19, ISBN 0-8493-0594-2
- ^ J. W. Meller에 의한 중간 무기 화학, Longmans, Green and Company, 1941년 런던, 페이지 388
- ^ "Mercurous Sulfate 7783-36-0".
- ^ Preparation and Characterization of Dimercury(I)Monofluorophosphate(V), Hg2PO3F: Crystal Structure, Thermal Behavior, Vibrational Spectra, and Solid-State 31P and 19F NMR Spectra by Matthias Weil, Michael Puchberger, and Enrique J. Baran, published by Inorg. 2004년, 43페이지 8330–8335
- ^ 기숙사, E. 1969 수은(I) 화합물에 대한 구조 연구 VI. 황산 수은과 셀렌산염의 결정 구조. 액타 케미카 스칸디나비카(1947–1973) 23:1607–15.
- ^ a b Google Books 결과, 2010년 12월 11일 액세스
- ^ Mercuous Sulfate, 카드뮴 황산염, 카드뮴 전지. Hulett G. A. 신체검사. 1907. 페이지 19.
- ^ 마티외 투핀, 티에리 브루스, 다니엘 벨랑거의 "화학적으로 합성된 망간 이산화물의 충전 저장 특성에 대한 마이크로 스틱의 영향" 화학. 어머니. 2002, 14, 3945–3952
- ^ 소메쉬 차크라바티와 수쿠마르 아디티의 "세포, CdHgxy CdSO4, (m) I HgSO24, Hg, Dioxane-Water Media에 대한 전기력 연구" 1972년 제17권 제1호, 화학 및 엔지니어링 데이터 저널
- ^ Christiana L의 "Aquous – 유기용제 혼합물의 액체 접합 전위 최소화를 위한 비대칭-Valance Salt Bridge로서의 리튬 황산염 특성" 파베리오, 파트리아지아 R. 무시니, 토르콰토 무시니. 논어. 화학. 1998, 70, 2589–2595
- ^ a b 존 T의 "조지 아우구스투스 휴렛: 리퀴드 크리스털에서 스탠더드 셀까지" 주식. 황소. 히스, 화학. 제25권, 제2호, 2000호, 페이지91-98
- ^ Lietzke, M. H.; Stoughton, R. W. (November 1953). "The Behavior of the Silver—Silver Sulfate and the Mercury—Mercurous Sulfate Electrodes at High Temperatures 1". Journal of the American Chemical Society. 75 (21): 5226–5227. doi:10.1021/ja01117a024.(필요한 경우)
- ^ "수성과 표준 세포의 설파테스." 엘리엇, R.B., Hulett, G. A. 물리 화학 저널 36.7 (1932): 2083–2086.


