표면상피-스트롬종양
Surface epithelial-stromal tumor| 표면상피-스트롬종양 | |
|---|---|
 | |
| 표면 상피-스트롬 종양의 일종인 브레너 종양의 고배율 마이크로그래프. H&E 얼룩. | |
| 전문 | 종양학 |
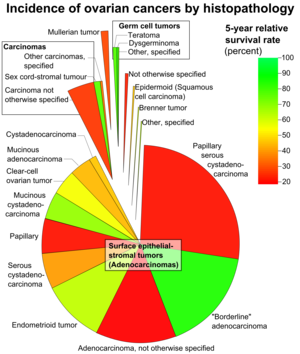
표면 상피성 종양은 양성 또는 악성일 수 있는 난소성 종양의 일종이다. 이 그룹의 신엽은 난소 표면 상피(수정된 복막) 또는 외경 내막 또는 나팔관(관) 조직에서 유래된 것으로 생각된다. 이런 형태의 종양을 난소성 아데노카르시노마라고도 한다.[1] 이 종양군은 모든 난소암 환자의 90%~95%를 차지하지만, 40세 미만 여성에서 7%가 발생하는 미국을 제외하고는 폐경 후 여성에게서만 주로 발견된다.[2][3][4][5][6][7] 혈청 CA-125는 종종 높아지지만 정확도가 50%에 불과해 치료 진행 상황을 평가하는 데 유용한 종양 마커는 아니다. 상피성 난소암에 걸린 여성의 75%가 난소암에서 발견된다. 그러나 젊은 환자들은 노인 환자들보다 더 나은 예후를 보일 가능성이 더 높다.[8][9][10][11] [12]
분류
상피-지혈종양은 상피세포 유형, 상피와 스트로마의 상대적 양, 유두과정의 유무, 상피원소의 위치 등을 기준으로 분류된다. 미세한 병리학적 특징에 따라 표면 상피-스트롬 종양이 양성인지, 경계선 종양인지, 악성인지(악성 및 기질침입의 징후)가 판별된다. 경계선 종양은 불확실한 악성 잠재력을 가지고 있다.
이 소분류는 여러 가지 혼합형, 미분화형, 미분류형, 미분류형 등이 있기는 하지만 톱니형, 점막형, 자궁내막형, 투명세포, 브레너형(전환세포)종양으로 구성되어 있다.
톱니 종양

- 이러한 종양은 크기가 작고 거의 감지할 수 없는 것에서부터 큰 것까지 다양하여 복강을 채운다.
- 양성, 경계선, 악성종양 등이 전체 난소종양의 약 30%를 차지한다.
- 75%는 양성 또는 경계선 악성이고, 25%는 악성이다.
- 이 종양의 악성 형태인 톱니시타데노카르시노종은 난소 전체 암의 약 40%를 차지하며 가장 흔한 악성 난소종양이다.
- 양성 종양과 경계선 종양은 20세에서 50세 사이에 가장 흔하다.
- 악성 종양은 가족적인 경우 좀 더 일찍 발생하긴 하지만 평균적으로 말년에 발생한다.
- 양성의 20%, 경계선의 30%, 악성종양의 66%가 양쪽 난소다.
구성 요소에는 다음이 포함될 수 있다.
- 낭포성 지역
- 낭포성 및 섬유성 영역
- 주로 섬유질이 많은 지역
종양의 악성 가능성은 유두 구조와 괴사 조직 모두를 포함하여 존재하는 고체 영역의 양에 따라 증가한다.
병리학
- 키가 크고 주상동맥이 있는 상피세포에 의해 정렬된.
- 투명한 톱니액으로 채워진
- 낭포액에 대한 설명에서 유래한 톱니라는 용어는 이러한 종양에서 보이는 상피세포의 특정 유형을 설명하게 되었다.
- 난소 표면과 관련이 있을 수 있음
- 양성, 경계선 및 악성 사이의 분열을 다음과 같이 평가하여 확인한다.
- 세포 아티피아(개별 세포가 비정상적으로 보이는지 여부)
- 주변 난소 스트로마 침공(세포가 주변 조직에 침투하고 있는지 여부)
- 경계선 종양에는 세포성 아티피아(atypia)가 있을 수 있지만 침입의 증거는 없다.
- 시스타데노카르시노마(systadenocarcinomas[15])의 특이적인 현미경 발견이다.
예후
대부분의 신엽과 마찬가지로 톱니 종양의 예후는 에 달려 있다.
- 분화 정도
- 이것이 종양세포가 양성세포와 얼마나 가깝게 닮았는가 하는 것이다.
- 잘 다듬어진 종양은 양성 종양과 매우 흡사하다.
- 잘 구분되지 않은 종양은 세포의 기원과 전혀 닮지 않을 수 있다.
- 적당히 분화된 종양은 보통 세포의 기원을 닮았지만, 솔직히 악성 종양이 나타난다.
- 종양의 다른 구조로의 확장
- 특히 경미한 악성종양의 경우, 예후와 관련하여 악성 종양이 복막에 퍼지는 것이 중요하다.
난소에 국한된 경계종양과 악성종양의 5년 생존율은 각각 100%와 70%이다. 복막과 관련되면 이 비율은 90%, 25%가 된다.
경계선 종양의 5년 생존율은 뛰어나지만, 수년 후에 재발할 수 있기 때문에 이것은 치료의 증거로 보아서는 안 된다.
점액종양

- 서로 매우 닮았지만 양자간일 가능성은 낮음
- 전체 난소세포의 약 25%를 차지하면서 다소 덜 흔하다.
- 어떤 경우에는 점액성 종양이 톱니종양에 비해 크기가 가변적이고 표면 관여가 드물게 나타나는 특징이 있다.
- 또한 경막종양과 비교하여 점막종양은 양막종양의 빈도가 낮으며, 1차 점막종양의 약 5%가 양막종양이다.
- 기록된 무게가 25kg을 초과하는 매우 큰 낭포성 질량을 형성할 수 있음
병리학
점액성 종양은 높은 주상피세포가 비피질 뮤신을 가지고 있고 실리아가 없는 것이 특징으로, 양성 자궁경부나 장내 상피와 외관이 유사하다. 외형은 대장암이나 난소암과 비슷하게 보일 수 있지만, 일반적으로 부록에서 발생한다(임상 질환인 점액성 자궁선두종(Phasmyxoma peripoti) 참조). 분명한 암석 침공은 경계선 종양과 악성 종양을 구별하기 위해 사용된다.
예후
난소 내에 포함된 경계선종양, 침입 없는 악성종양, 침습성 악성종양의 경우 각각 10년 생존율이 95%, 90%, 66%를 넘는다. 점막성 난소성 종양과 관련된 희귀하지만 주목할 만한 한 가지 질환은 가성근종 복막이다. 일차 난소 점막종양은 대개 일방적이므로(한 난소에서), 쌍방향 점막종양의 표시는 비 난소원, 대개 부록의 배제를 필요로 한다.
자궁내막종양
자궁내막종양은 전체 난소암의 약 20%를 차지하며 대부분 악성(내막암)이다. 양성 또는 악성 자궁내막과 유사한 관상샘으로 구성되며 자궁내막암의 15~30%가 자궁내막암에 걸린 개인에서 발생하며, 이들 환자는 예후가 좋다. 그것들은 고체 및 낭포성 부위가 있는 다른 표면 상피성 종양과 유사하게 보인다. 이러한 종양의 40%는 쌍방향일 때 전이되는 경우가 많다.
병리학
- 자궁내막형 분비선과 강한 유사성을 갖는 분비선
- 양성 종양은 섬유성 스트로마에서 성숙된 분비샘을 가지고 있다.
- 경계선 종양에는 암막 침투를 하지 않고 복잡한 분기 패턴이 있다.
- 발암(악성 종양)은 침습샘에 혼잡하고 비정형 세포가 많으며, 자주 분비된다. 분화가 잘 안되면 종양은 더 단단해진다.
예후
다시 예후는 종양이 얼마나 분화된 모습으로 나타나느냐 뿐만 아니라 종양의 확산에 따라 좌우된다. 전체 예후는 장막종양이나 점막종양보다 다소 좋지 않으며 난소에 국한된 종양 환자의 5년 생존율은 약 75%이다.
클리어 세포종양
클리어 세포종양은 상피세포가 크고 세포질이 선명하며, 자궁내막증이나 난소의 자궁내막암과 연관되어 자궁내막의 클리어 세포암과 유사하게 나타날 수 있다. 그것들은 대부분 고체이거나 낭포성일 수 있다. 만약 고체라면, 투명한 세포들은 시트나 관으로 배열되는 경향이 있다. 낭포성 품종에서는 신소성 세포가 낭포성 라이닝을 구성한다.
예후
이러한 종양들은 공격적인 경향이 있는데 난소에 국한된 종양의 5년 생존율은 약 65%이다. 진단 시 종양이 난소 이상으로 퍼진 경우 예후가 좋지 않다.
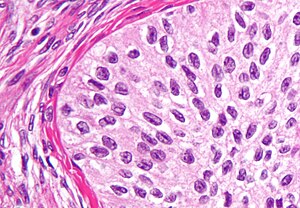
브레너 종양
브레너 종양은 상피세포(이 종양을 정의하는)가 전이세포인 흔치 않은 표면-피피피세포 종양이다. 이것들은 방광상피증과 외관이 비슷하다. 종양은 매우 작을 수도 있고 매우 클 수도 있으며, 고체 또는 낭포성일 수도 있다. 역사학적으로 종양은 정상 난소를 닮은 주변 조직 내에 전술한 과도기 세포의 둥지로 이루어져 있다. 브레너 종양은 종양 세포가 주변 조직을 침범하느냐에 따라 양성일 수도 있고 악성일 수도 있다.
소세포종양
소세포 난소암(SCCO)은 일반적으로 특색 있는 내분비 기능과 연관된 상피종양으로[16] 분류된다.[17]
세계보건기구(WHO)는 SCCO를 고혈당 유형의 소세포 난소암(SCCOHT)과 폐 유형의 소세포 난소암(SCCOPT)의 두 가지 뚜렷한 실체로 인식한다.[17]
작은 세포 종양은 드물고 공격적이며, 모든 자폐성 악성 종양의 2% 미만에 기여한다.[17] 평균 진단 연령은 24세로, 고혈당(62%)[18] 환자도 대부분이다. 그것은 전형적으로 일방적인 큰 종양을 가지고 있다.[18] 대부분의 여성은 진단 후 1년 이내에 사망한다.[18]
치료
자세한 내용은 난소암을 참조하십시오.
연구 결과 자궁내막 난소암(EOC)의 1차 치료에서 카보플라틴과 짝을 이룬 페길레이트 지질독소루비신이 카보플라틴을 함유한 팩리탁셀의 만족스러운 대안인 것으로 나타났다.[19] 백금에 민감한 EOC가 재발한 사람들의 경우, 연구결과 카보플라틴을 함유한 Paclitaxel보다 Pegylated Liposomal Doxorubicin이 더 나은 치료법이라는 것이 밝혀졌다.[20]
미국 국립암연구소는 이 조직학의 발달된 암에 대해 정맥(IV) 투여와 복막내(IP) 투여를 병행하는 화학요법 방법을 권고하고 있다.[21] 선호하는 화학요법제에는 백금약과 세제를 포함한다.
메타스타즈
표면 상피성 종양의 경우 전이가 가장 많이 발생하는 부위는 흉강(33%), 간(26%), 폐(3%)[22] 등이다.
다산성에 미치는 영향
표면 상피성 종양의 치료 이후 생식력은 주로 조직학 및 초기 경계선(또는 더 양성) 대 경계선(또는 더 악성)의 진보된 단계로 분리하기 위한 초기 준비 작업에 의존한다.[23] 초기 경계선 종양의 보수적인 관리(0.5%)는 자연 임신의 50% 이상이 될 가능성이 있고, 치사 재발 위험성이 낮은(0.5%)으로 추정됐다.[23] 반면 고도경계종양에서 보수적인 치료의 경우 자연발생 임신율이 35%, 치사 재발 위험이 2%[23]로 추정됐다.
참조
- ^ a b Kosary CL (2007). "Chapter 16: Cancers of the Ovary" (PDF). In Baguio RN, Young JL, Keel GE, Eisner MP, Lin YD, Horner MJ (eds.). SEER Survival Monograph: Cancer Survival Among Adults: US SEER Program, 1988-2001, Patient and Tumor Characteristics. SEER Program. Vol. NIH Pub. No. 07-6215. Bethesda, MD: National Cancer Institute. pp. 133–144.
- ^ 질병통제예방센터, CDC Wonder. 미국 및 푸에르토리코 암 통계, 1999–2013년 발병률 요청.http://wonder.cdc.gov/ 암-v2013.1987에서 이용 가능. 2016년 12월 1일 회수.
- ^ 가시마 K, 야하타 T, 후지타 K, 다나카 K. FIGO 단계 IC 상피 난소암에 걸린 생식 연령 여성에 대한 출산-보충 수술의 결과. Int J Gynaecol 산부인과 2013;121:53–5.
- ^ Rau-Hain JA, Foley O, Winograd D, Andray C, Clark RM, Vargas RJ 등. 폴로-피아노 튜브 암에 비해 1단계 상피 난소암에 걸린 환자의 임상 특성과 결과. Am J Cordet Gynecol 2015;212:600.e1–8.
- ^ 라이트 JD, 샤 M, 매튜 L, 버크 WM, 컬한 J, 골드맨 N 등. 후두 난소암에 걸린 젊은 여성의 출산율 보존. 암 2009;115:4118–26.
- ^ Melamed A, Rizzo A.E, Nitecki R, et al All-cause 수술 후 I 상피 난소암으로 사망. 산부인과. 지네콜.. 2017;130(1):71-79. doi:10.1097/AOG.0000000000002102
- ^ Bradshaw KD, Schorge JO, Schaffer J, Lisa M H, Hoffman BG (2008). Williams' Gynecology. McGraw-Hill Professional. ISBN 978-0-07-147257-9.
- ^ 스메들리 H, 시코라 K. 상피 난소암에 대한 예측인자로써 나이. Br J Cordet Gynaecol 2016;92:839–42.
- ^ 게지 F, 크로미 A, 판파니 F, 말조니 M, 디토 A, 데 이아코 P 등. 초기 난소 상피암을 위한 복강경 생식-보충 수술: 다기관 경험. 자네콜 온-콜 2016;141:461–5.
- ^ Melamed A, Keating NL, Clemmer JT, Bregar AJ, Wright JD, Boruta DM 등. 겉보기 1기 난소암에 대한 복강경 준비. Am J Cordet Gynecol 2017;216:50. e1–50.e12.
- ^ 가시마 K, 야하타 T, 후지타 K, 다나카 K. FIGO 단계 IC 상피 난소암에 걸린 생식 연령 여성에 대한 출산-보충 수술의 결과. Int J Gynaecol 산부인과 2013;121:53–5.
- ^ Melamed A, Rizzo A.E, Nitecki R, et al All-cause 수술 후 I 상피 난소암으로 사망. 산부인과. 지네콜.. 2017;130(1):71-79. doi:10.1097/AOG.0000000000002102
- ^ - Vaidya, SA; Kc, S; Sharma, P; Vaidya, S (2014). "Spectrum of ovarian tumors in a referral hospital in Nepal". Journal of Pathology of Nepal. 4 (7): 539–543. doi:10.3126/jpn.v4i7.10295. ISSN 2091-0908.
- 성숙한 낭포성 테라토마(난소암 위험 0.17~2%): Mandal, Shramana; Badhe, Bhawana A. (2012). "Malignant Transformation in a Mature Teratoma with Metastatic Deposits in the Omentum: A Case Report". Case Reports in Pathology. 2012: 1–3. doi:10.1155/2012/568062. ISSN 2090-6781. PMC 3469088. PMID 23082264. - ^ a b Baradwan, Saeed; Alalyani, Haneen; Baradwan, Amira; Baradwan, Afnan; Al-Ghamdi, Maram; Alnemari, Jameel; Al-Jaroudi, Dania (2018). "Bilateral ovarian masses with different histopathology in each ovary". Clinical Case Reports. 6 (5): 784–787. doi:10.1002/ccr3.1466. ISSN 2050-0904. PMC 5930217. PMID 29744056.
- Creative Commons Attribution 4.0 International(CC BY 4.0) 라이선스 - ^ Cotran RS, Kumar V, Nelson F, Robbins SL, Abbas AK (2005). Robbins and Cotran pathologic basis of disease (7th ed.). St. Louis, Mo: Elsevier Saunders. ISBN 978-0-7216-0187-8.
- ^ 종양학 및 혈액학에서의 유전학 및 세포유전학 지도책 - 난소: 상피종양. 2014년 6월 검색됨 L. Atlas Genet Cytogenet Oncol Hematol. 2004;8(2):115-133.
- ^ a b c Kaphan AA, Castro CM (2014-01-01). MPH rG, FRCPATH RH, MD JO, MD MJ (eds.). Small Cell and Neuroendocrine Cancers of the Ovary. John Wiley & Sons, Ltd. pp. 139–147. doi:10.1002/9781118655344.ch12. ISBN 9781118655344.
- ^ a b c Bakhru A, Liu JR, Lagstein A (2012). "A case of small cell carcinoma of the ovary hypercalcemic variant in a teenager". Gynecologic Oncology Case Reports. 2 (4): 139–42. doi:10.1016/j.gynor.2012.09.001. PMC 3861231. PMID 24371647.
- ^ Lawrie TA, Rabbie R, Thoma C, Morrison J, et al. (The Cochrane Collaboration) (October 2013). Lawrie TA (ed.). "Pegylated liposomal doxorubicin for first-line treatment of epithelial ovarian cancer". The Cochrane Database of Systematic Reviews. John Wiley & Sons, Ltd (10): CD010482. doi:10.1002/14651858.cd010482.pub2. PMC 6457824. PMID 24142521.
- ^ Lawrie TA, Bryant A, Cameron A, Gray E, Morrison J (July 2013). "Pegylated liposomal doxorubicin for relapsed epithelial ovarian cancer". The Cochrane Database of Systematic Reviews (7): CD006910. doi:10.1002/14651858.cd006910.pub2. PMC 6457816. PMID 23835762.
- ^ "NCI Issues Clinical Announcement for Preferred Method of Treatment for Advanced Ovarian Cancer". National Cancer Institute. January 2006. Archived from the original on 13 January 2009.
- ^ Kolomainen DF, Larkin JM, Badran M, A'Hern RP, King DM, Fisher C, et al. (February 2002). "Epithelial ovarian cancer metastasizing to the brain: a late manifestation of the disease with an increasing incidence". Journal of Clinical Oncology. 20 (4): 982–6. doi:10.1200/JCO.2002.20.4.982. PMID 11844820.
- ^ a b c Daraï E, Fauvet R, Uzan C, Gouy S, Duvillard P, Morice P (2012). "Fertility and borderline ovarian tumor: a systematic review of conservative management, risk of recurrence and alternative options". Human Reproduction Update. 19 (2): 151–66. doi:10.1093/humupd/dms047. PMID 23242913.
원천
- Braunwald E (2001). Harrison's principles of internal medicine (15th ed.). New York: McGraw-Hill. ISBN 978-0-07-913686-2.