아그로박테륨투메파시엔스
Agrobacterium tumefaciens| 아그로박테륨투메파시엔스 | |
|---|---|
 | |
| 당근 세포에 부착하는 아그로박테륨 라디오박터 | |
| 과학적 분류 | |
| 도메인: | 박테리아 |
| 문: | 슈도모나도타속 |
| 클래스: | 알파프로테오박테리아 |
| 주문: | 균사체 |
| 패밀리: | 뿌리비과 |
| 속: | 아그로박테륨속 |
| 종류: | A.라디오박터 |
| 이항명 | |
| 아그로박테륨라디오박터 | |
| 활자 변형률 | |
| ATCC 23308[a] B6 | |
| 동의어[4][5] | |
| |
아그로박테리움 라디오박터(Agrobacterium tumefaciens)[6][3][7]는 140종 이상의 유디코트에서 발생하는 크라운 담즙 질환(종양의 형성)의 원인 물질이다.막대 모양의 그램 음성 토양 박테리아입니다.[1]증상은 플라스미드에서 식물 세포로 삽입된 DNA의 작은 부분(단백질 합성 중에 아미노산을 전달하는 tRNA와 혼동하지 말 것)이 식물 게놈에 삽입됨으로써 발생합니다.[8]식물 게놈은 T-DNA 이진 벡터에 호스트된 배열을 전달하기 위해 아그로박테륨을 사용하여 조작될 수 있다.
아그로박테리움 투메파시엔스는 리조비과의 알파프로테오박테리움으로 질소 고정 콩 심비온을 포함한다.질소 고정 공생종과는 달리, 종양을 생성하는 아그로박테륨 종은 병원성이 있어 식물에 도움이 되지 않는다.Agrobacterium의 영향을 받는 다양한 식물들은 농업에 [9]큰 관심사가 되고 있다.
경제적으로, A. tumefaciens는 호두, 포도 덩굴, 돌과일, 견과류, 사탕무, 말무, 대황 등의 심각한 병원체이며, 이 질병으로 인한 종양이나 담낭의 지속적인 특성으로 인해 여러해살이 [10]작물에 특히 해롭다.
아그로박테륨 투메파시엔스는 28°C에서 최적으로 자란다.배지 시간은 배지, 배양 형식 및 [11]통기 수준에 따라 2.5~4시간입니다.30°C 이상의 온도에서 A. tumefaciens는 열 충격을 받기 시작하여 세포 [11]분열에 오류가 발생할 수 있습니다.
활용
이 박테리아는 T-DNA와 T-DNA를 식물 [12]세포로 옮기는 데 필요한 모든 유전자를 포함하는 200kbp의 종양 유도 플라스미드(Ti plasmid 또는 pTi)를 함유하고 있다.A. tumefaciens의 많은 변종들은 pTi를 포함하지 않는다.
Ti 플라스미드는 질병을 일으키는 데 필수적이기 때문에, 뿌리권에서 사전 침투 이벤트가 일어나 박테리아 간 플라스미드의 교환인 박테리아 결합을 촉진한다.오핀의 존재 하에서 A. tumefaciens는 30C8이라는 확산성 결합 신호를 생성한다.HSL 또는 아그로박테륨 자가[citation needed] 인듀서.이것은 전사인자 TraR을 활성화시켜 결합에 필요한[citation needed] 유전자의 전사를 확실히 조절한다.
감염 방법
아그로박테륨 투메파시엔스는 Ti 플라스미드를 통해 식물을 감염시킨다.Ti 플라스미드는 T-DNA로 알려진 DNA의 일부를 숙주 식물 세포의 염색체 DNA에 통합합니다.A. tumefaciens는 편모를 가지고 있는데, 편모는 뿌리 주변의 뿌리권에 축적되는 광촉매체를 향해 흙을 헤엄칠 수 있게 해줍니다.어떤 변종들은 아세토시링곤과 설탕과 같은 식물에서 나오는 화학 삼출액 쪽으로 화학적으로 이동할 수 있는데, 이는 박테리아가 들어갈 수 있는 식물에 상처가 있음을 나타냅니다.페놀 화합물은 Ti 플라스미드의 virA 유전자에 코드된 투과막 단백질인 VirA 단백질에 의해 인식된다.당은 증배 [13]공간에 위치한 염색체 유전자 암호화 단백질인 chvE 단백질에 의해 인식된다.
Ti 플라스미드의 최소 25개의 vir 유전자가 종양[citation needed] 유도에 필요하다.그들의 지각 역할 외에도, virA와 chvE는 다른 vir 유전자를 유도한다.VirA 단백질은 오토키나아제 활성을 가지고 있다: 그것은 히스티딘 잔기에 자신을 인산화한다.그리고 나서 VirA 단백질은 아스파르트산 잔기에 있는 VirG 단백질을 인산화한다.virG 단백질은 virG Ti 플라스미드 유전자에서 생성된 세포질 단백질이다.그것은 바이러스 오퍼론의 전사를 유도하는 전사 인자이다.ChvE 단백질은 바이러스 유전자의 활성화의 두 번째 메커니즘을 조절한다.페놀 [13]화합물에 대한 VirA 단백질 민감도를 높입니다.
첨부 파일은 2단계 프로세스입니다.처음 약하고 가역적인 부착에 이어 박테리아는 셀룰로오스 섬유를 합성하여 그들이 이끌린 상처 입은 식물 세포에 고정시킵니다.이 과정에는 chvA, chvB, pscA, 그리고 att의 네 가지 주요 유전자가 관여합니다.처음 세 유전자의 산물은 셀룰로오스 섬유의 실제 합성에 관여하는 것으로 보인다.이 섬유들은 또한 박테리아를 서로 고정시켜 미세 콜로니를 형성하는데 도움을 준다.
가장 중요한 독성 단백질인 VirC는 불법 재결합에 필요한 단계이다.그것은 대체될 숙주 식물의 DNA 부분을 선택하고 이 DNA 가닥을 잘라냅니다.
셀룰로오스 섬유의 생산 후, 리카데신이라고 불리는 칼슘 의존성 외막 단백질이 생성되는데, 이것은 또한 박테리아를 세포벽에 붙이는 것을 돕는다.이 단백질의 상동성은 다른 뿌리 공포증에서 발견될 수 있다.현재 아그로박테륨 매개 변환 프로토콜 표준화에 대한 여러 보고서가 있다.콩에서 감염 시간, 아세토시링곤, DTT, 시스테인과 같은 다양한 매개변수의 영향을 연구하였다(글리신 [14]최대치).
아그로박테륨이 식물 세포를 [15]감염시키는 원인이 될 수 있는 식물 화합물:
T-필러스의 형성
T-DNA를 식물 세포로 옮기기 위해 A. tumefaciens는 T-필러스의 생산을 포함한 IV형 분비 메커니즘을 사용합니다.아세토시링곤 등의 물질이 검출되면 신호전달이벤트가 T필러스의 형성을 담당하는 VirB 오퍼론 내의 11개 유전자의 발현을 활성화한다.
프로필린이 먼저 형성됩니다.T-필러스 서브유닛을 형성하기 위해 47개의 잔류물을 제거하여 가공해야 하는 121개의 아미노산 폴리펩타이드입니다.서브유닛은 폴리펩타이드 양끝 사이에 펩타이드 결합이 형성됨으로써 원형화된다.
다른 VirB 유전자의 산물은 혈장막을 가로질러 서브유닛을 전달하는데 사용된다.효모 2-하이브리드 연구는 VirB6, VirB7, VirB8, VirB9 및 VirB10이 모두 트랜스포터의 성분을 인코딩할 수 있다는 증거를 제공합니다.서브유닛의 활성수송을 위한 ATP화효소도 필요하다.
식물 세포로의 T-DNA 이행
T-DNA는 원형 플라스미드에서 잘라내야 합니다.VirD1/D2 복합체는 왼쪽 및 오른쪽 테두리 배열에서 DNA를 손상시킵니다.VirD2 단백질은 5' 끝에 공유 결합되어 있습니다.VirD2는 핵단백질 복합체가 IV형 분비계(T4SS)를 목표로 하는 모티브를 포함한다.
수용세포의 세포질에서 T-DNA 복합체는 VirE2 단백질로 피복되어 T-DNA 복합체와는 독립적으로 T4SS를 통해 수출된다.VirE2와 VirD2에 위치한 핵 국재 신호(NLS)는 임포틴 알파 단백질에 의해 인식되며, 임포틴 알파 단백질은 임포틴 베타 및 핵공 복합체와 관련지어 T-DNA를 핵으로 이동시킨다.또한 VIP1은 프로세스에서 중요한 단백질로 보여지며 VirE2를 Importin에 가져오는 어댑터 역할을 할 수 있습니다.일단 핵 안으로 들어가면, VIP2는 T-DNA를 활발하게 전사되고 있는 염색질 영역으로 표적을 하여 T-DNA가 숙주 게놈에 통합될 수 있다.
T-DNA 유전자
호르몬
담즙 형성을 유발하기 위해 T-DNA는 IAM 경로를 통해 옥신 또는 인돌-3-아세트산 생성을 위한 유전자를 암호화한다.이 생합성 경로는 옥신의 생산을 위해 많은 식물에서 사용되지 않기 때문에, 옥신은 그것을 조절하는 분자 수단이 없고 구성적으로 생산될 것이다.사이토키닌의 생성을 위한 유전자도 발현된다.이것은 세포 증식과 담즙 형성을 자극한다.
오피네
T-DNA는 식물이 [16]오핀이라고 불리는 박테리아가 대사시킬 수 있는 특별한 아미노산 유도체를 생성하도록 하는 효소를 코드하는 유전자를 포함하고 있다.오핀은 A. tumefaciens의 질소 공급원으로 사용되는 화학물질의 한 종류이지만, 대부분의 다른 유기체들에게는 그렇지 않다.A. tumefaciens C58 감염 식물에 의해 생성되는 오핀의 특정 유형은 노팔린이다(Escbar et al., 2003).
노팔린형 Ti 플라스미드 2종, pTi-SAKURA 및 pTiC58이 완전히 배열되었다."A. fabrum" C58은 체리수관 담낭에서 최초로 분리되었다.이 게놈은 2001년 굿너 외 연구진과 우드 외 연구진에 [17][18]의해 동시에 배열되었다.A. 투메파시엔스 C58의 게놈은 원형 염색체, 두 개의 플라스미드, 그리고 한 개의 선형 염색체로 구성되어 있다.공유 결합 원형 염색체의 존재는 박테리아에게 흔하지만 예외는 거의 없다.그러나 단일 원형 염색체와 단일 선형 염색체의 존재는 모두 이 속 그룹에 고유하다.두 개의 플라스미드는 독성 관련 과정을 담당하는 pTiC58과 한때 "암호화" 플라스미드로 [17][18]불렸던 pAtC58입니다.[b]
pAtC58 플라스미드는 pTiC58 플라스미드가 [19]없을 때 오핀의 대사에 관여하고 다른 박테리아와 결합하는 것으로 나타났다.Ti플라스미드가 제거되면 이 세균을 분류하는 수단인 종양 증식이 일어나지 않는다.
바이오테크놀로지 용도
Asilomar Conference(Berg 등 1975년)는 재조합 기법이 충분히 이해되지 않아 엄격하게 [20]통제되어야 한다는 광범위한 합의를 확립했다.아그로박테륨의 DNA 전달 능력은 식물에 외래 유전자를 삽입하는 수단으로 생명공학에서 광범위하게 연구되어 왔다.Asilomar, Marc Van Montagu, Jeff Shell (벨기에 겐트 및 식물 유전 시스템 대학)은 아그로박테륨과 식물 사이의 유전자 전달 메커니즘을 발견했고,[21] 이는 식물에서 박테리아를 유전자 공학을 위한 효율적인 전달 시스템으로 바꾸는 방법을 개발하는 결과를 낳았다.식물에 전달되는 플라스미드 T-DNA는 유전자 [22]공학에 이상적인 매개체이다.이것은 원하는 유전자 서열을 진핵 세포에 관심 있는 서열을 전달하는데 사용될 T-DNA 이진 벡터로 복제함으로써 이루어진다.곧 아시로마르와 같은 보호가 식물 [20]기술에도 필요하다는 것이 널리 합의되었다.이 과정은 빛나는 [citation needed]식물을 생산하기 위해 반딧불 루시페라아제 유전자를 사용하여 수행되었습니다.이 발광은 식물 엽록체 기능과 보고 유전자 [23]연구에 유용한 장치였다.또한 꽃을 아그로박테리움 수프에 담그면 아라비도시스 탈리아나를 변형시킬 수 있다: 생산된 씨앗은 유전자가 될 것이다.실험실 조건 하에서 T-DNA는 또한 인간 세포로 전달되어 삽입 [24]적용의 다양성을 입증했다.
아그로박테륨이 숙주 세포에 물질을 삽입하는 메커니즘은 병원균이 물질(일반적으로 단백질)을 III형 분비물에 의해 인간 세포에 삽입하기 위해 사용하는 메커니즘과 매우 유사한 IV형 분비 시스템에 의한 것이다.그것은 또한 쿼럼[citation needed] 감지라고 불리는 많은 그램 음성 박테리아에 보존된 일종의 신호를 사용한다.이것은 또한[citation needed] 아그로박테륨을 의학 연구의 중요한 주제로 만든다.
자연유전자변형
세균의 자연적 유전자 변형은 DNA가 세포 간에 매개체를 통해 전달되고 상동 재조합에 의해 기증자 배열이 수용체 게놈에 통합되는 성적인 과정이다.A. 투메파시엔스는 특별한 물리적 또는 화학적 [25]처리 없이 흙에서 자연 변형을 겪을 수 있다.
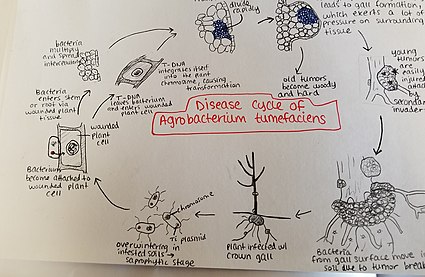
질병 주기
아그로박테륨 투메파시엔스는 들끓는 토양에서 겨울을 난다.아그로박테리움 종은 주로 부생식물의 생활양식을 가지고 있기 때문에, 이 속 식물 기생충 종들조차도 오랜 시간 동안 토양에서 생존하는 것이 [26]일반적이다.그러나 숙주 식물이 있을 때, 박테리아는 최근의 상처나 땅 근처의 뿌리나 줄기의 자연적인 개구부를 통해 식물 조직에 침투한다.이러한 상처는 문화적 관행, 이식, 곤충 등에 의해 발생할 수 있습니다.일단 박테리아가 식물에 들어가면 세포 간에 발생하며 세포 변형으로 인해 주변 조직이 증식하도록 자극한다.아그로박테륨은 식물의 게놈에 플라스미드 T-DNA를 삽입함으로써 이러한 제어를 수행한다.플라스미드 DNA가 숙주 게놈에 삽입되는 과정에 대한 자세한 내용은 위의 내용을 참조하십시오.식물 조직의 과도한 성장은 줄기와 뿌리에 담즙을 형성하게 한다.이러한 종양은 주변 식물 조직에 상당한 압력을 가하여 이 조직을 찌그러뜨리거나 변형시킵니다.찌그러진 혈관은 목질부의 물의 흐름을 감소시킨다.어린 종양은 부드럽고 따라서 곤충과 부생 미생물에 의한 2차 침입에 취약하다.이 2차 침입은 말초 세포층의 붕괴와 부패로 인한 종양 변색을 일으킨다.연조직의 파괴는 아그로박테리움 투메파시엔스를 토양으로 방출시켜 새로운 숙주 [27]식물과 함께 질병 과정을 다시 시작할 수 있게 한다.
질병관리
아그로박테리움 투메파시엔스에 의한 왕관담염은 다양한 방법으로 제어할 수 있다.이 병을 다스리는 가장 좋은 방법은 새로운 식물에 감염되지 않도록 가지치기 도구의 살균과 같은 예방 조치를 취하는 것이다.육종 의무 검사와 감염된 식물 거부, 감염된 밭에 민감한 식물을 심지 않는 것 또한 가치 있는 관행이다.재배 중에 식물의 크라운/뿌리를 다치지 않도록 하는 것이 질병을 예방하는 데 중요합니다.여러[28] 식물이 하나로 자라기 위해 결합하는 원예 기술에서, 이러한 기술은 식물의 상처로 이어집니다.상처는 숙주 식물에 세균이 침투하는 주요 장소이다.따라서, 이러한 기술은 아그로박테리아가 활동하지 않는 시기에 수행하는 것이 좋습니다.뿌리째 뽑히는 곤충은 식물의 [27]뿌리에 상처를 입히기 때문에 감염 수치를 줄이는데도 도움이 됩니다.감염된 식물성 물질은 토양에서 오래 [29]살 수 있기 때문에 퇴비 더미에 두는 것보다 태우는 것이 좋습니다.
생물학적 방제 방법도 이 질환의 관리에 활용되고 있다.1970, 80년대 발아 종자, 묘목, 뿌리줄기 등을 처리하는 방법은 K84의 현탁액에 담그는 것이 일반적이었다.K84는 A. radiobacter로 구성돼 있어 A. tumefaciens와 관련이 있지만 병원성은 없다.K84는 A. tumefaciens를 포함한 관련 박테리아에 대한 특이 항생제인 박테리오신(agrocin 84)을 생산합니다.상업적인 규모로 이 병을 조절하는 데 성공한 이 방법은 K84가 내성 유전자를 병원성 아그로박테리아로 옮길 위험이 있었다.따라서 1990년대에 K-84 유전공학 변종인 K-1026이 사용되었습니다.이 변종은 저항성 유전자 [30]이동의 경고 없이 K84만큼 크라운 쓸개를 제어하는 데 성공적이다.
환경
숙주, 환경, 병원체는 식물 병리학에 있어 매우 중요한 개념이다.아그로박테리아는 식물 병원체 [31]중 숙주 범위가 가장 넓기 때문에 크라운갈의 경우 가장 고려해야 할 요소는 환경이다.다양한 숙주를 감염시킬 때 A. tumefaciens에게 좋은 환경을 만드는 다양한 조건과 요인들이 있다.세균은 상처와 같은 진입점이 없으면 숙주 식물에 침투할 수 없다.식물의 상처로 이어지는 요인에는 문화적 관행, 이식, 동파 손상, 성장 균열, 토양 곤충, 그리고 식물에 피해를 주는 다른 동물들이 포함됩니다.결과적으로, 유난히 혹독한 겨울에는 날씨와 관련된 [32]피해로 인해 왕관 쓸개 발생률이 증가하는 것이 일반적이다.이와 함께 숙주 식물의 감염을 매개하는 방법이 있다.예를 들어, 선충은 식물의 뿌리에 아그로박테륨을 도입하는 벡터 역할을 할 수 있다.좀 더 구체적으로 말하면, 뿌리 기생 선충은 식물 세포를 손상시켜 박테리아가 [33]침투할 수 있는 상처를 만든다.마지막으로, 온도는 A. tumefaciens 감염을 고려할 때 하나의 요소이다.T-DNA 전달의 열감수성 때문에 이 박테리아로 인한 크라운 갈 형성 최적 온도는 22 °C이다.고온 [34]조건에서는 종양 형성이 현저하게 감소합니다.
「 」를 참조해 주세요.
레퍼런스
- ^ 이 문제는 다음과 같습니다.Velazquez E, Flores-Felix JD, Sanchez-Juanes F, Igual JM, Peix A. (2020). "Strain ATCC 4720T is the authentic type strain of Agrobacterium tumefaciens, which is not a later heterotypic synonym of Agrobacterium radiobacter". Int J Syst Evol Microbiol. 70 (9): 5172–5176. doi:10.1099/ijsem.0.004443. PMID 32915125.
{{cite journal}}: CS1 maint: 작성자 파라미터 사용(링크) - ^ 관련 플라스미드에 대해 이야기할 때 "플라스미드"
- ^ a b Smith EF, Townsend CO (April 1907). "A Plant-Tumor of Bacterial Origin". Science. 25 (643): 671–3. Bibcode:1907Sci....25..671S. doi:10.1126/science.25.643.671. PMID 17746161.
- ^ Buchanan RE (1965). "Proposal for rejection of the generic name Polymonas Lieske 1928". International Bulletin of Bacteriological Nomenclature and Taxonomy. 15 (1): 43–44. doi:10.1099/00207713-15-1-43.
- ^ a b Young JM, Kuykendall LD, Martínez-Romero E, Kerr A, Sawada H (January 2001). "A revision of Rhizobium Frank 1889, with an emended description of the genus, and the inclusion of all species of Agrobacterium Conn 1942 and Allorhizobium undicola de Lajudie et al. 1998 as new combinations: Rhizobium radiobacter, R. rhizogenes, R. rubi, R. undicola and R. vitis". International Journal of Systematic and Evolutionary Microbiology. 51 (Pt 1): 89–103. doi:10.1099/00207713-51-1-89. PMID 11211278.
- ^ Sawada H, Ieki H, Oyaizu H, Matsumoto S. (1993). "Proposal for rejection of Agrobacterium tumefaciens and revised descriptions for the genus Agrobacterium and for Agrobacterium radiobacter and Agrobacterium rhizogenes". Int J Syst Bacteriol. 43 (4): 694–702. doi:10.1099/00207713-43-4-694. PMID 8240952.
{{cite journal}}: CS1 maint: 작성자 파라미터 사용(링크) - ^ Judicial Commission (compiled by Tindall BJ). (2014). "Judicial Opinion No. 94: Agrobacterium radiobacter (Beijerinck and van Delden 1902) Conn 1942 has priority over Agrobacterium tumefaciens (Smith and Townsend 1907) Conn 1942 when the two are treated as members of the same species based on the principle of priority and Rule 23a, Note 1 as applied to the corresponding specific epithets". Int J Syst Evol Microbiol. 64 (Pt 10): 3590–3592. doi:10.1099/ijs.0.069203-0. PMID 25288664.
{{cite journal}}: CS1 maint: 작성자 파라미터 사용(링크) - ^ "Rhizobium radiobacter (Agrobacterium tumefaciens) (Agrobacterium radiobacter)". UniProt Taxonomy. Archived from the original on 2011-07-28. Retrieved 2010-06-30.
- ^ "Taxonomy browser (Agrobacterium radiobacter K84)". National Center for Biotechnology Information. Retrieved 7 December 2015.
- ^ Chilton MD, Drummond MH, Merio DJ, Sciaky D, Montoya AL, Gordon MP, Nester EW (June 1977). "Stable incorporation of plasmid DNA into higher plant cells: the molecular basis of crown gall tumorigenesis". Cell. 11 (2): 263–71. doi:10.1016/0092-8674(77)90043-5. PMID 890735. S2CID 7533482.
- ^ Moore LW, Chilton WS, Canfield ML (January 1997). "Diversity of opines and opine-catabolizing bacteria isolated from naturally occurring crown gall tumors". Applied and Environmental Microbiology. 63 (1): 201–7. Bibcode:1997ApEnM..63..201M. doi:10.1128/AEM.63.1.201-207.1997. PMC 1389099. PMID 16535484.
- ^ "Crown Galls". www.missouribotanicalgarden.org. Retrieved 2019-12-02.
- ^ a b Morton ER, Fuqua C (February 2012). "Laboratory maintenance of Agrobacterium". Current Protocols in Microbiology. Chapter 1: Unit3D.1. doi:10.1002/9780471729259.mc03d01s24. ISBN 978-0471729259. PMC 3350319. PMID 22307549.
- ^ Gordon JE, Christie PJ (December 2014). "The Agrobacterium Ti Plasmids". Microbiology Spectrum. 2 (6). doi:10.1128/microbiolspec.PLAS-0010-2013. PMC 4292801. PMID 25593788.
- ^ a b Gelvin SB (March 2003). "Agrobacterium-mediated plant transformation: the biology behind the "gene-jockeying" tool". Microbiology and Molecular Biology Reviews. 67 (1): 16–37, table of contents. doi:10.1128/mmbr.67.1.16-37.2003. PMC 150518. PMID 12626681.
- ^ Barate PL, Kumar RR, Waghmare SG, Pawar KR, Tabe RH (2018). "Effect of different parameters on Agrobacterium mediated transformation in Glycine max". International Journal of Advanced Biological Research. 8 (1): 99–105.
- ^ 미국 특허 6483013
- ^ Zupan J, Muth TR, Draper O, Zambryski P (July 2000). "The transfer of DNA from agrobacterium tumefaciens into plants: a feast of fundamental insights". The Plant Journal. 23 (1): 11–28. doi:10.1046/j.1365-313x.2000.00808.x. PMID 10929098.
- ^ a b Goodner B, Hinkle G, Gattung S, Miller N, Blanchard M, Qurollo B, et al. (December 2001). "Genome sequence of the plant pathogen and biotechnology agent Agrobacterium tumefaciens C58". Science. 294 (5550): 2323–8. Bibcode:2001Sci...294.2323G. doi:10.1126/science.1066803. PMID 11743194. S2CID 86255214.
- ^ a b Wood DW, Setubal JC, Kaul R, Monks DE, Kitajima JP, Okura VK, et al. (December 2001). "The genome of the natural genetic engineer Agrobacterium tumefaciens C58". Science. 294 (5550): 2317–23. Bibcode:2001Sci...294.2317W. CiteSeerX 10.1.1.7.9501. doi:10.1126/science.1066804. PMID 11743193. S2CID 2761564.
- ^ Vaudequin-Dransart V, Petit A, Chilton WS, Dessaux Y (1998). "The cryptic plasmid of Agrobacterium tumefaciens cointegrates with the Ti plasmid and cooperates for opine degradation". Molecular Plant-Microbe Interactions. 11 (7): 583–591. doi:10.1094/mpmi.1998.11.7.583.
- ^ a b Genetically Modified Pest-Protected Plants : Science and Regulation. Washington, D.C.: National Academies Press. 2000. pp. xxiii+263. ISBN 978-0-309-06930-4. OCLC 894124744.
- ^ Schell J, Van Montagu M (1977). "The Ti-plasmid of Agrobacterium tumefaciens, a natural vector for the introduction of nif genes in plants?". Basic Life Sciences. 9: 159–79. doi:10.1007/978-1-4684-0880-5_12. ISBN 978-1-4684-0882-9. PMID 336023.
- ^ Zambryski P, Joos H, Genetello C, Leemans J, Montagu MV, Schell J (1983). "Ti plasmid vector for the introduction of DNA into plant cells without alteration of their normal regeneration capacity". The EMBO Journal. 2 (12): 2143–50. doi:10.1002/j.1460-2075.1983.tb01715.x. PMC 555426. PMID 16453482.
- ^ Root M (1988). "Glow in the dark biotechnology". BioScience. 38 (11): 745–747. doi:10.2307/1310781. JSTOR 1310781.
- ^ Kunik T, Tzfira T, Kapulnik Y, Gafni Y, Dingwall C, Citovsky V (February 2001). "Genetic transformation of HeLa cells by Agrobacterium". Proceedings of the National Academy of Sciences of the United States of America. 98 (4): 1871–6. Bibcode:2001PNAS...98.1871K. doi:10.1073/pnas.041327598. PMC 29349. PMID 11172043.
- ^ Demanèche S, Kay E, Gourbière F, Simonet P (June 2001). "Natural transformation of Pseudomonas fluorescens and Agrobacterium tumefaciens in soil". Applied and Environmental Microbiology. 67 (6): 2617–21. Bibcode:2001ApEnM..67.2617D. doi:10.1128/AEM.67.6.2617-2621.2001. PMC 92915. PMID 11375171.
- ^ Schroth MN, Weinhold AR, Mccain AH (March 1971). "Biology and Control of Agrobacterium tumefaciens". Hilgardia. 40 (15): 537–552. doi:10.3733/hilg.v40n15p537.
- ^ a b Agrios GN (2005). Plant pathology (5th ed.). Amsterdam: Elsevier Academic Press. ISBN 9780120445653. OCLC 55488155.
- ^ "Grafting and Budding Nursery Crop Plants NC State Extension Publications". content.ces.ncsu.edu. Retrieved 2017-12-02.
- ^ "Crown gall : Yard and Garden : Garden : University of Minnesota Extension". www.extension.umn.edu. Archived from the original on 2017-10-16. Retrieved 2017-10-15.
- ^ Ryder MH, Jones DA (1991-10-01). "Biological Control of Crown Gall Using Using Agrobacterium Strains K84 and K1026". Functional Plant Biology. 18 (5): 571–579. doi:10.1071/pp9910571.
- ^ "Bacterial Crown Gall of Fruit Crops Ohioline". ohioline.osu.edu. Retrieved 2017-10-20.
- ^ "Crown Gall – A Growing Concern in Vineyards". extension.psu.edu. Retrieved 2017-10-20.
- ^ Karimi M, Van Montagu M, Gheysen G (November 2000). "Nematodes as vectors to introduce Agrobacterium into plant roots". Molecular Plant Pathology. 1 (6): 383–7. doi:10.1046/j.1364-3703.2000.00043.x. PMID 20572986.
- ^ Dillen W, De Clereq J, Kapila J, Van Montagu ZM, Angenon G (1997-12-01). "The effect of temperature on Agrobacterium tumefaciens-mediated gene transfer to plants". The Plant Journal. 12 (6): 1459–1463. doi:10.1046/j.1365-313x.1997.12061459.x.
추가 정보
- Dickinson M (2003). Molecular Plant Pathology. BIOS Scientific Publishers.
- Lai EM, Kado CI (August 2000). "The T-pilus of Agrobacterium tumefaciens". Trends in Microbiology. 8 (8): 361–9. doi:10.1016/s0966-842x(00)01802-3. PMID 10920395.
- Ward DV, Zupan JR, Zambryski PC (January 2002). "Agrobacterium VirE2 gets the VIP1 treatment in plant nuclear import". Trends in Plant Science. 7 (1): 1–3. doi:10.1016/s1360-1385(01)02175-6. PMID 11804814.
- Webster J, Thomson J (1988). "Genetic Analysis of an Agrobacterium tumefaciens strain producing an agrocin active against biotype 3 Pathogen". Molecular and General Genetics. 214 (1): 142–147. doi:10.1007/BF00340192. S2CID 180063.
외부 링크
 위키미디어 커먼스의 아그로박테리움 투메파시엔스 관련 매체
위키미디어 커먼스의 아그로박테리움 투메파시엔스 관련 매체- "Agrobacterium fabrum" C58 게놈 페이지 - Cereon Genomics / 리치몬드 대학에서 시퀀싱